[导读] 编译整理:魏建国,王强
病理研究,总是在持续进展中。比如从最初的形态学,到后续的免疫组化、乃至近些年蓬勃发展的分子病理学,让我们对具体病种的观察视野越来越广阔。孤立性纤维性肿瘤(solitary fibrous tumor,SFT)也不例外,《Am J Surg Pathol》杂志曾刊发了三例形态学和表型具有迷惑性的头颈部病例。为帮助大家更好的了解相关细节,并避免实际工作中的误诊误判,我们将该文要点编译介绍如下。
SFT简介
SFT是一种伴纤维母细胞分化的间质性肿瘤。该肿瘤并不常见,最初认为发生于胸膜,但随着病例报道的增多,包括头颈部在内的身体所有部位几乎都有报道。与此同时,该肿瘤的概念也有了显著扩展:2013年的世界卫生组织软组织和骨肿瘤分类中,SFT和血管外皮瘤被归为一类,二者均是特化的纤维母细胞构成,目前认为它们是同一病变形态学谱系的两个极端。因此SFT有两种主要表型,第一种是细胞数量少(paucicellular)的SFT,表型为梭形细胞区和胶原区交替出现,混有分支状厚壁血管;第二种是细胞丰富(cellular)的SFT或血管外皮瘤样SFT,形态更为单一、细胞丰富且纤维性间质数量少,且是薄壁血管。当然还有其他诸多形态学表现,如黏液样、脂肪瘤样、血管纤维瘤样/巨细胞型、肉瘤样/去分化型等。
去分化是软组织和骨肿瘤中一个广为人知的现象。就SFT中的去分化来说,最初是2009年引入的,当时将去分化定义为存在经典型SFT突然转化为低分化高级别肉瘤的现象,后者可以是新生(de novo),也可是此前切除SFT复发后的表现。去分化的成分大多表现为小圆细胞、上皮样细胞、梭形细胞或多形性,偶有病例表现为异源性软骨-骨肉瘤或横纹肌肉瘤区。最近,在SFT中还有一种新的、极为罕见的现象报道,即转分化(transdifferentiation),比如文献中有SFT转分化为神经内分泌表型、鳞状表型、腺癌样SFT的报道。与去分化不同,转分化是指出现与最初肿瘤高级别转化/去分化不同的异常表型。关于SFT的去分化,我们网站此前有过相关文献编译,具体请看:https://mp.weixin.qq.com/s/WCwERyPFtMmv2Dqqq6GgPw
https://mp.weixin.qq.com/s/ceqdR5TZ9TLE-ZgCGTXw-Q
病例展示
病例1为53岁女性,既往无恶性病史,送检为下颌下腺肿瘤。病变质软、界清,25*20*15mm。首诊病理医师考虑为基底样亚型鳞状细胞癌。组织学检查,该肿瘤为实性腺泡状及梁状结构构成的界清结节,伴大量纤维分隔。肿瘤内多个区域有小巢状鳞状分化,且这些区域免疫组化强阳性表达p40、p63、CK5/6、34βE12。瘤细胞中等大小,卵圆形,细胞核轻度多形性,胞质丰富、嗜酸性至透明,核仁显著。同时有皮脂腺化生区和菊型团样结构。病变主体周边有束状分布的环形上皮样至梭形细胞,其间有玻璃样变组织分隔,后者类似反应性改变、伴少许含铁血黄素沉着及显著薄壁血管。切缘无肿瘤。核分裂4个/10HPF;未见非典型核分裂或坏死。肿瘤周边可见一处约5mm的显著实性结节,几乎完全为小圆形细胞构成、伴少许纤维间隔;细胞核边界轻度不规则,核仁相对显著、居中;该区域核分裂高达12个/10HPF。该区域就对应SFT中去分化为小圆形肉瘤。整个病变内未见鹿角状血管。
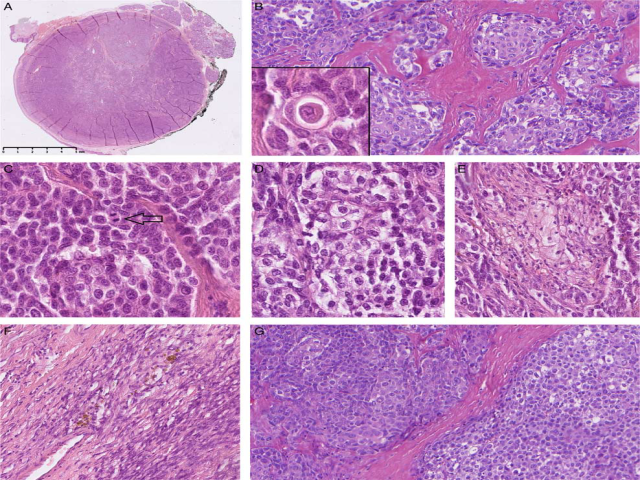
图1.病例1组织学所见。低倍镜下可见表面被覆鳞状上皮,周边有小涎腺。肿物界清,周边有纤维分隔。图A中上方区域为完全由小圆细胞构成的界清结节,对应高倍为图G。其余肿瘤为实性腺泡状至巢状,有纤维分隔。部分细胞巢类似非角化型鳞状细胞癌。散在有胞质内角化的细胞(图B插图)。部分区域呈梁状生长,细胞为中等大小的圆形至卵圆形,胞质嗜酸性,细胞核轻度多形性,核仁显著;可见个别核分裂(C)。部分瘤细胞胞质透明,类似玻璃样变透明细胞癌中的细胞(D)。还有些区域局灶有皮脂腺化生(E)。肿瘤周边为受压的梭形细胞,伴少许薄壁血管及簇状含铁血黄素;该区域最初认为是反应性改变,但实际上是经典型SFT区域,STAT6免疫组化阳性(F)。(G)鳞状分化区域转化为界清结节的部分,后者几乎完全为小圆形细胞,伴少许纤维间隔;该区域类似小圆细胞肿瘤。
免疫组化方面,肿瘤细胞弥漫强阳性表达p63、p40,多灶大片状阳性表达CK5/6、34βE12、CK7、CK14、CK19、CAM5.2,肿瘤周边界清小圆形细胞区域弥漫阳性表达AE1/AE3。SOX10完全阴性,AR和GATA3为个别(<5%)细胞不规则核着色。P16强阳性,但仅为约20%的瘤细胞局灶细胞核和胞质着色。P53为30%-50%的瘤细胞局灶着色。Ki-67增殖指数高,20%-40%的细胞着色,分布不规则。
根据上述形态学和免疫组化结果,拟诊玻璃样变的透明细胞癌。送二代测序,希望证实有EWSR1::ATF1基因融合;但结果检出了NAB2ex5::STAT6ex17融合,且后续RT-PCR证实了这一点。据此加做STAT6和CD34免疫组化:前者整个肿瘤弥漫性细胞核着色,包括最初被解读为反应性改变的梭形细胞区,因此其实质为小灶的经典型SFT;后者阳性几乎仅局限于病变周边的小圆细细胞结节。
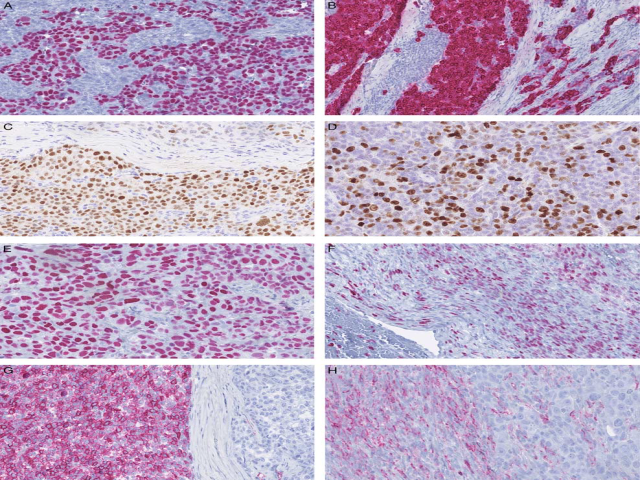
图2.病例1免疫组化:p63弥漫强阳性细胞核着色(A),多灶大片表达CK(B)。P53为30%至50%瘤细胞着色(C),Ki-67着色不规则,增殖指数约20%-40%(D)。STAT6整个肿瘤均为弥漫性细胞核着色(E),包括病变周边最初认为是反应性改变的区域(F)。胞质CD34着色几乎仅限于肿瘤周边小圆形细胞构成的结节(图G中左侧),前述反应样表现的组织周边也有少许着色(图H中着色区,无着色的为鳞状区域)。
病例2为71岁男性,肿物位于舌底;初诊医师考虑为非特殊类型的腺癌。本例形态学表现为单一的中等大小上皮样、基底型细胞,排列呈不规则、相互沟通的巢状及条索样,背景为血管化的纤维性间质,类似肌上皮肿瘤。未见经典型SFT区域。会诊时首先考虑GLI1扩增或重排的上皮样间质肿瘤,这也是为什么免疫组化中加入STAT6的原因,因为该肿瘤中STAT6偶见共扩增。
免疫组化检测,肿瘤广泛表达CK(AE1/AE3、CK7、CK18),局灶表达CK5。此外,S100和desmin阳性。P16阴性,p53呈野生型表达,CD34完全阴性。核分裂<2个/10HP。STAT6为50%肿瘤细胞的核着色。最终,二代测序证实有NAB2ex4::STAT6ex2基因融合。

图3.病例2,形态学为相互沟通的巢状及束状,背景为血管化的纤维性至玻璃样变间质,其中有陷入的表层鳞状上皮(A)。瘤细胞形态单一,中等大小,上皮样至基底样(B)。免疫组化AE1/AE3细胞膜强阳性(C),表达S100(D)、desmin(E);STAT6为50%左右的细胞核阳性(F)。
病例3为41岁女性,肿瘤位于鼻腔。形态学为相对温和的梭形细胞呈束状结构,并有显著的错构瘤样腺体增生(源自表面上皮的陷入)。核分裂<4个/10HPF。免疫组化瘤细胞弥漫阳性表达低分子量CK及SMA,中等程度表达高分子量CK和h-caldesmon。少数(10%-20%)瘤细胞表达S100。P16和CD34完全阴性,p53为野生型。本例最初考虑为低级别鼻腔鼻窦梭形细胞肉瘤伴肌-神经(myoneural)特征。靶向RNAS测序,意外发现有NAB2ex::STAT6ex16融合,但未见PAX3/MAML3融合。加做STAT6,结果为细胞核弥漫着色。确诊8年后,患者仍无病健在。
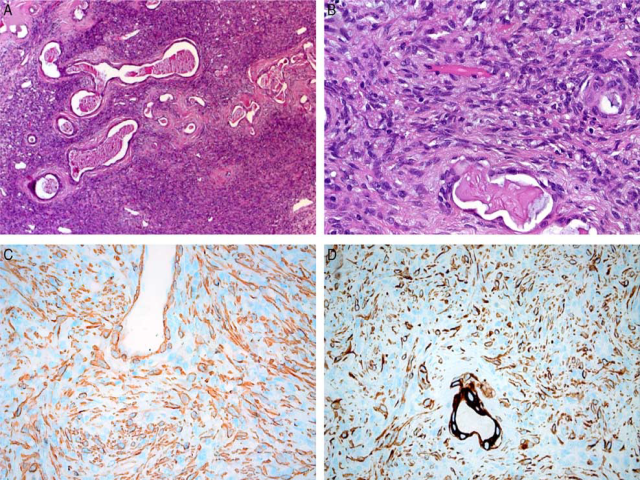
图4.病例3,形态学可见陷入的错构瘤样腺体(A),病变为形态温和梭形细胞构成的束状结构(B)。免疫组化瘤细胞表达α-SMA(C)和广谱CK(D)。
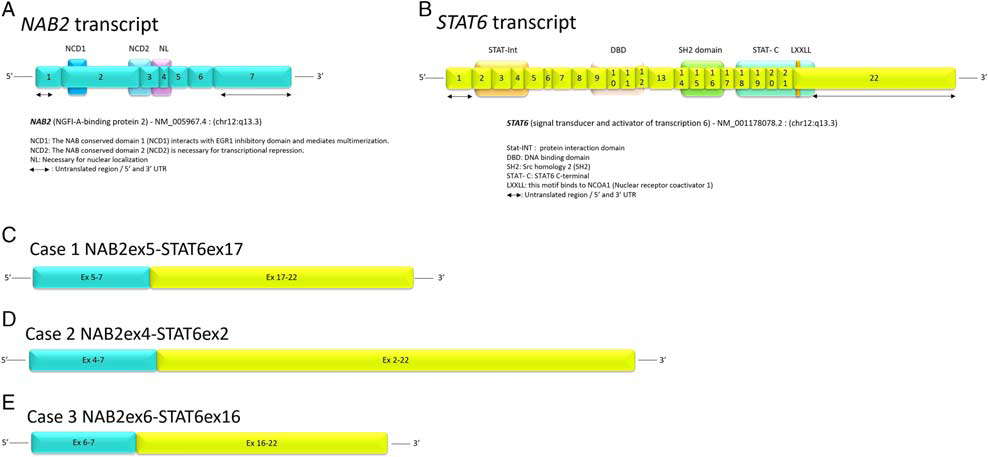
图5.图A、B分别示NAB2和STAT6。图C-E分别为病例1-3的融合方式。
小结
据本文原作者所述,加本文所述3例,目前发生于头颈部的去分化或转分化SFT病例共计11例,还有一例盆腔SFT转分化为低分化神经内分泌癌,具体请移步原文。
总之,本文报道了3例发生于头颈部、诊断有一定困难的SFT病例,其中2例伴上皮性转分化,1例伴低级别鼻腔鼻窦梭形细胞肉瘤分化。SFT中存在间质-上皮转分化可能是诊断陷阱之一,且这一陷阱可能并不仅仅见于头颈部病例。尽管该组肿瘤免疫表型多样,但STAT6免疫组化仍是可靠标记。
点此下载原文献
参考文献
[1]Baněčková M, Michal M, Hájkova V, et al. Misleading Morphologic and Phenotypic Features (Transdifferentiation) in Solitary Fibrous Tumor of the Head and Neck: Report of 3 Cases and Review of the Literature. Am J Surg Pathol. 2022;46(8):1084-1094.
doi:10.1097/PAS.0000000000001875


















共0条评论