[导读] 译者:陈旭
往期回顾:
乳房小叶病变的最新进展(1)
5.ILC进展
WHO乳腺肿瘤分类第5版,包括不同的ILC变异型,一些基于生长模式(即实性、腺泡和小管-小叶),另一些基于细胞形态学(即多形性、组织细胞样/大汗腺样)。在一些文献中,描述了其他组织学变异,例如1979年由Martinez和Azzopardi首次报道的小梁状ILC。这种模式主要由2或3层细胞厚的小梁组成,最初的描述还包括1层细胞厚的小梁。具有小梁生长模式的ILC,似乎与经典ILC具有相似的预后,如果IHC支持小叶分化,大多数病理医师可能将其归类为此类。在一些病例报告中,已经描述了与ILC相关的破骨细胞样巨细胞样改变。这些肿瘤有出血区域,以及增加的血管分布,如同在与破骨细胞样巨细胞相关的其他组织学类型的BC中所见那样,例如筛状癌。
在以下部分中,作者将描述最近认识到的变异型,即具有细胞外粘蛋白的浸润性ILC(ILCEM)、具有实性乳头状生长模式的ILC,并讨论具有混合导管和小叶成分的浸润性癌所面临的诊断困境。
5.1具有细胞外黏液的浸润性小叶癌
Rosa等人首先报道了一种与细胞外黏液池相关的异常形式的ILC。以前,只描述了ILC细胞内腔中存在黏液,细胞外黏液被认为导管分化的标志。迄今为止,文献中已报道了39例ILCEM。这些肿瘤在绝经后妇女(中位年龄=62岁;范围=31-87)中更常见,主要表现为可触及的肿块。多灶性并不少见,大多数肿瘤(69%)≥2cm(范围0.7–10cm)。
细胞外黏液的量从5%到95%不等,其中61%的病例具有至少25%的粘液区域。与细胞外黏液相关的病灶,表现为黏液池内的散在肿瘤细胞、实心巢,并且在某些区域,可观察到假腺体或假筛状结构。几乎一半的肿瘤具有3级核。在所有病例中,都可以看到具有单细胞和单行的传统浸润模式的区域,并且在切除后,在大多数肿瘤(79%)中发现印戒细胞。腺泡样或实性生长模式并不少见。大多数肿瘤伴有LCIS。3例LCIS还显示细胞外黏液。图3示一例ILCEM。

图3.具有细胞外黏液的浸润性小叶癌(ILCEM)。A.肿瘤呈实性和典型的浸润模式,局部伴有ILC相邻的黏液池。B.肿瘤细胞显示核多形性,但见印戒形态。C.E-cadherin表达缺失或异常,细胞质p120阳性(D)确认小叶分化。
E-cadherin在所有病例中,均为阴性或异常。这些肿瘤在10%的病例中呈HER2阳性(4/39例),在所有病例中均为ER阳性。
大多数病例表现为淋巴结转移。52%的病例出现局部或远处复发,近1/3患者死于疾病,这表明与经典ILC相比,这些肿瘤的预后更差。已在复发病例中描述了涉及TP53、ERBB3、ERBB2、POLQ和CCND1的基因组改变。
CNB检查对于ILCEM的诊断,可能很困难,因为:①假腺体或假筛状ILCEM可能类似于导管癌;②在CNB上肿瘤可能具有大片实性区域而没有黏液,这可能与实性ILC甚至非特殊型浸润性乳腺癌(IBC–NST)相混淆,并且③细胞外黏液历来与导管表型相关。虽然这些病例罕见,但很可能该疾病未被充分识别。有限的CNB材料可能无法诊断ILCEM;然而,具有肿瘤簇的细胞外黏液显示细胞粘附性丧失、印戒细胞和/或并存LCIS,应怀疑小叶分化的可能性。
5.2具有实性乳头状生长模式的ILC
浸润性癌中的乳头状结构,历来与导管表型相关。然而,最近报道了一种ILC变异型,其特征类似于SPC和EPC的生长模式。2016年Rakha等人首次报道3例,迄今仅报道6例,均为老年女性(范围73-86岁)。CNB的诊断范围从LCIS到ILC,具有小叶特征的IBC-NST和SPC或EPC。这些肿瘤表现为单个或多个界限清楚的肿块,由具有纤维血管轴心的实体增殖细胞组成,一些肿瘤还具有囊性区域和厚的纤维包膜,类似于EPC。所有病例均可见经典ILC区域,通常从乳头状癌延伸或密切相关。核级别从低到高不等。所有病例均呈E-cadherin膜表达缺失,证实了小叶表型。肌上皮标志物(平滑肌肌球蛋白,平滑肌肌动蛋白或p63),在乳头状肿块中的所有病例中均呈阴性,并且没有表现出神经内分泌标志物(突触素和嗜铬粒蛋白)的表达。所有肿瘤均为ER阳性和HER2阴性。没有淋巴结转移的报道。在相对较短的随访期内(中位随访时间为8至13个月),所有患者均存活且无复发记录。
我们最近遇到1名没有BC病史的53岁女性,她出现了可触及的肿块。外院CNB活检报告为具有神经内分泌分化的ILC。乳房切除术标本显示一个2.1cm的边界不清的肿瘤,由多个边界清楚的实性结节组成,具有纤维血管轴心,并混合有传统的浸润成分(图4)。有趣的是,这种肿瘤以细胞外黏液为特征。细胞学上,肿瘤细胞不粘附,细胞质稀少,中级别核。E-cadherin和p120染色证实了小叶分化。肿瘤细胞对突触素和嗜铬粒蛋白呈弥漫性阳性,类似于SPC中所见的模式。浸润性癌为ER阳性(99%,强)、PR阳性(20%,强)和HER2阴性(1+)。所有前哨淋巴结均为阴性。Oncotype Dx复发评分为29,患者目前正在接受辅助化疗。

图4.具有实性乳头状生长模式的ILC。A.肿瘤由具有纤维血管轴心的膨胀实性结节组成,在周围可见传统的生长模式的ILC区域(左)。B.实性结节由具有小叶细胞形态的肿瘤细胞组成,被纤维包膜包围。肿瘤细胞呈E-cadherin阴性(C)并显示p120(D)的细胞质表达。突触素(E)和嗜铬粒蛋白(F)呈弥漫性阳性。
具有实性乳头状模式的ILC的鉴别诊断,包括ILC实性变异型、非浸润性乳头状癌(原位SPC和EPC)和广泛累及乳头状病变的LN。ILC的实体模式,也包括肿瘤细胞的实体生长;然而,它们呈片状排列,而不是局限性结节,并且缺乏纤维血管轴心或纤维包膜。鉴于有限的数据,区分这两种亚型的临床相关性尚不清楚。
在没有IHC的情况下,与SPC的区别,更具挑战性,因为SPC中的肿瘤细胞,通常具有低核级别,并且可能显示出浆细胞样特征、胞浆内空泡和显著的印戒细胞。SPC经常表达神经内分泌标志物,这可能在具有实性乳头状模式的ILC中看到。此外,正如Rakha等人报告的那样,在具有实性乳头状模式的ILC中,肿瘤细胞粘附性的丧失,可能并不明显,导致CNB诊断为EPC。与乳头状癌相关的经典ILC和LCIS的存在,应该怀疑乳头状肿瘤是小叶分化的可能性,并且建议使用E-cadherin、p120或β-catenin进行进一步检查。
极少数情况下,LN可能广泛累及乳头状瘤或乳头状病变。在这种情况下,IHC可能会揭示残余导管上皮细胞和肌上皮细胞的存在,以及任何(微)浸润的证据。
这些报道以及描述的病例表明,EPC和SPC代表了乳腺癌的生长模式,而不是独特的实体。所有研究的病例,都与经典或实体ILC相关。因此,尚不清楚具有完全实性乳头状生长模式的小叶癌如何表现,并且应该与目前分期为Tis(DCIS)的SPC和EPC类似地进行管理。病理学界对该疾病的认识,有望对这些病变的识别,并对其临床行为更清晰的了解。
5.3具有混合形态特征的浸润性癌
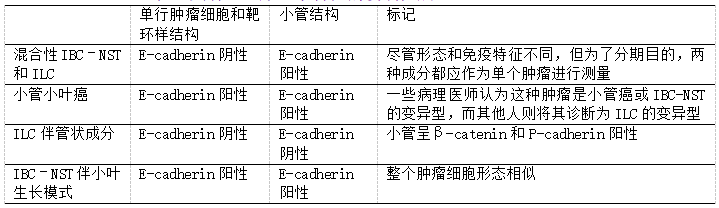
在目前的WHO分类中,具有双重(IBC-NST和小叶)组织病理学特征的肿瘤分为混合性IBC-NST和ILC(如果小叶成分占浸润性癌的10-90%)、ILC的管状小叶型模式(定义为“由管状生长模式和以线性模式排列的小而均匀的细胞混合而成”)和IBC-NST伴小叶生长模式。这些定义基于形态学评估,诊断不需要E-cadherin。最近,ILC与腺体/小管形成的临床病理学特征,在“ILC伴管状成分(ILC with tubular elements)”下进行了描述。
5.3.1混合性IBC–NST和ILC
混合浸润癌的定义,随着时间的推移而改变,可能也是它的解释。WHO分类的第4版(2012年),将它们定义为“至少50%的肿瘤具有ILC模式,10%至49%之间具有浸润性导管癌模式”。然而,该定义并未考虑具有少量小叶成分的肿瘤。因此,当前的WHO分类,将IBC-NST和ILC(或其他特殊亚型)混合定义为具有包含10-90%肿瘤的小叶成分(图5A、B)。WHO专家小组建议报告ILC成分的百分比,即混合IBC–NST和ILC(40%小叶成分)。那些具有<10%ILC的浸润性癌,应归类为IBC–NST。虽然此诊断不需要E-cadherin,但研究表明,IBC–NST/导管成分呈E-cadherin阳性,小叶区域有异常染色。这些浸润性癌中的一些成分,可能代表碰撞瘤,而另一些可能通过从导管到小叶表型的克隆分化,以及获得CDH1突变而发展出双重表型。尽管在一些研究中,混合IBC-NST和ILC更常被诊断为更晚期的疾病,但预后与纯ILC或IBC-NST没有显着差异。在Rakha等人的一项研究中,混合肿瘤的复发率,介于纯ILC(最低)和IBC-NST(最高)之间,尽管这些差异似乎与多变量分析中的肿瘤分级有关。Metzger-Filho等人的另一项研究显示,组织学分级在混合IBC-NST中具有预后意义,但在纯ILC中则不然,并且与绝经后妇女的ILC相比,这些肿瘤与更好的预后相关。

图5.具有混合导管和小叶特征的浸润性癌。(A)混合浸润性乳腺癌——无特殊类型(IBC–NST)和浸润性小叶癌(ILC)。这两种成分显示出不同的形态【见插图】。E-cadherinIHC(B)突出显示,左ILC成分为阴性,右NBC–NST成分为阳性。(C)小管小叶癌是一种低度恶性肿瘤,由浸润性小、圆小管和单列组成,均显示E-cadherin膜性表达(D)。
5.3.2小管小叶癌
Fisher等人于1977年首次描述了小管小叶癌(tubulolobular carcinoma)。肿瘤细胞排列成浸润性条索和靶环样模式,混杂着小管结构,其形态学特征既像ILC又像小管癌。作者赞成归类为ILC,因为预后比小管癌差。然而,随后的研究表明,小管和单个细胞都显示E-cadherin呈膜强阳性,支持导管表型。此外,使用连续切片CK染色进行三维重建,发现在HE切片上看到的单行排列的肿瘤细胞在不同切片层面上与小管是相连的。泪珠状小管的尾部,看起来像实性细胞条索。相反,ILC可以在至少10%的病例中,显示E-cadherin呈膜状阳性,并且局灶性小管形成是ILC中公认的发现。因此,一些病理医师认为,这些肿瘤是ILC的一种变异型(图2C、D)。
5.3.3ILC伴管状成分
很少的腺体或小管形成,可见于具有ILC的组织病理学特征(非粘附性细胞、单行排列、靶环样模式)并且E-cadherin阴性的肿瘤。Christgen等人最近提出了术语“ILC伴管状成分(invasive lobular carcinoma with tubular elements)”。他们研究了13个ILC,其中管状成分显示出相似的细胞形态学,E-cadherin表达缺失,但细胞粘附性得以保留。小管占肿瘤区域的5-60%,并显示出不同的大小和形状。虽然所有肿瘤都显示E-cadherin的膜表达丢失或减少,但管状成分保留了β-catenin表达,表明细胞间粘附性得以保留。管状成分中P-cadherin阳性,但在传统ILC区域没有。P-cadherin,类似于E-cadherin,是一种跨膜蛋白,通过与粘附性连接的其他成分(p120、γ-连环蛋白和β-连环蛋白)相互作用,来提供细胞间粘附性。所有病例均为ER阳性和HER2阴性。13例中有11例携带CDH1突变,11例中有9例显示16q丢失。具有管状成分的病灶,显示出比传统ILC模式更低的Ki67增殖指数。图6为其中1例。

图6.浸润性小叶癌(ILC)伴管状成分。A.ILC显示具有腺体/小管形成的区域。B.异常的E-cadherin染色。C.单个细胞群和小管都显示细胞质p120表达。D.只有小管显示保留的β-catenin膜染色。
5.3.4IBC–NST伴小叶生长模式
在IBC-NST中发现具有单行排列的肿瘤细胞浸润和靶样模式的区域并不少见,这些区域是E-cadherin阳性,并且缺乏小叶癌中所见的细胞形态学。通常这些区域是局灶性的,整个肿瘤很少显示这种浸润模式。肿瘤细胞粘附性存在、核多形性和伴有DCIS(没有LCIS)应该考虑IBC-NST的可能性。E-cadherin染色有助于分类,因为它们保留了膜表达。
上述研究表明,具有混合形态学的浸润性癌,可以根据发病机制和免疫特征分为不同的类别(表5)。混合性IBC–NST和ILC,在腺体/管状成分中呈E-cadherin阳性,而在单行浸润区域呈阴性。其中一些可能代表碰撞肿瘤,而另一些代表IBC-NST伴有携带CDH1突变的E-cadherin阴性亚克隆。将小管小叶癌分类为“导管”或“小叶”表型是有争议的。最后,具有局灶性腺体/小管形成的ILC呈广泛的E-cadherin阴性,但在管状区域表达P-cadherin,表明cadherin转换是细胞间粘附性的一种拯救机制,有人提议称之为“ILC伴管状成分”。其他方面典型的ILC中出现局灶性E-cadherin阴性小管,是公认的发现,具有管状成分的ILC,是否代表不同的临床病理学实体,目前仍不清楚。
表5.具有混合形态学特征的浸润性癌
 6小叶癌的诊断及临床意义
6小叶癌的诊断及临床意义
ILC和LCIS的诊断,历来仅基于形态学。自1941年Foote和Stewart首次描述ILC和LCIS以来,学者已经描述了ILC和LCIS的不同形态模式。随后,CDH1双等位基因失活、E-cadherin免疫组化表达缺失,成为小叶病变的标志性特征,以区分“导管”癌。病理医师在非浸润性上皮增生性病变和浸润性癌的日常实践中,使用E-cadherin以及相关连环蛋白(β-catenin和p120),会引发关于形态和/或免疫组化不明确病变的最佳分类的其他问题。
原位病变中小叶表型诊断的意义,上文已有描述。简言之,无论ALH或LCIS患者是否接受了切除术,这些患者通常都会接受内分泌治疗,以进行化学预防,从而降低随后发生浸润性癌和DCIS的风险。研究表明,FLCIS和PCLIS是侵袭性更强的变异型,通常完全切除至阴性切缘,类似于DCIS。然而,与DCIS不同的是,在非CLCIS中,适当的边缘清除,以及放射治疗和化学预防的作用,目前尚不清楚。
目前,ILC的标准治疗,与IBC–NST相似。然而,研究表明,ILC具有不同的临床表现、预后和复发模式,好发于骨和乳腺癌转移的非典型部位,例如胃肠道、腹膜和妇科器官。与IBC–NST相比,ILC在手术后的前10–15年内,似乎具有生存优势;然而,此后ILC患者的预后更差。此外,ILC患者更有可能接受乳房切除术,并且在手术切除时具有阳性切缘。大规模病例对照研究显示,与IBC-NST相比,ILC对新辅助治疗的病理学完全缓解率较低。虽然磁共振成像(MRI)不常规用于BC筛查,但这是ILC患者的推荐筛查方式,因为这些肿瘤更可能是隐匿性的或在乳房X线检查和超声检查中难以界定的。
尽管越来越多的证据表明,ILC在病理表现和临床行为方面,是一种独特的BC亚型,但目前还没有用于BC小叶分化的组织病理学诊断的金标准。IHC标记物(E-cadherin、β-catenin和p120)在小叶病变中差异表达,但有时异常表达,可能增加了病理学解读的复杂性。
最近的一项研究,包括来自9个国家的35名病理医师(27名对乳腺病理有特殊兴趣,7名大外科病理医师),评估了ILC诊断中观察者间的一致性。参与者独立评估了两组激素受体(HR)阳性BC,每组具有相似数量的IBC–NST和ILC,以及相似的肿瘤特征。仅为A组提供了HE切片(n=61),而B组提供了HE和E-cadherin染色切片(n=62)。每个病例的肿瘤分类,最初是由ADAPT试验中的中心病理学复查时确定的,由2-4名乳腺病理专家根据HE切片和E-cadherin染色切片来确定。使用数字切片对病例进行复查,并由参与者分类为ILC、非小叶性BC和混合性BC。当只复查HE切片时,配对的观察者间一致性中等(中位数κ=0.58,四分位数范围=0.48-0.66)。当提供E-cadherin时,参与者的亚型判断不一致的情况较少见(B组15/62与A组30/61)。两组中的大多数不一致病例,包括由排列成细长小梁的肿瘤细胞组成、呈E-cadherin弱阳性的IBD-NST。加做β-catenin和p120均为膜阳性,均无CDH1突变。另一组不一致病例,包括具有错义CDH1突变的E-cadherin阳性ILC(根据参考标准)。这些肿瘤显示典型的ILC形态,看过E-cadherin后易误诊(A组1/30,B组3/15)。最后一组不一致病例,包括E-cadherin阴性浸润性癌伴单行肿瘤细胞和局灶小管,且并发LCIS。小管显示P-cadherin的表达。原因是ILC中的小管成分存在E-cadherin向P-cadherin转换(A组1/30,B组3/15)。
这项研究支持以前的建议,例如WHO建议:当浸润性癌显示出明确的ILC形态时,无论E-cadherin结果如何,都应将肿瘤归类为ILC。若无典型形态学,IHC可能有助于最终分类。
然而,使用IHC诊断ILC,似乎因不同的临床实践而异。为了评估目前用于诊断ILC的标准,DeSchepper等人最近公布了一项针对来自34个国家的92名参与者的全球调查结果。调查结果显示,超过一半的参与者常规执行IHC来诊断ILC,而45%的参与者仅在有疑问时才要求IHC。当具有小叶模式的肿瘤呈E-cadherin阳性时,大约一半的病理医师会加做其他IHC。值得注意的是,两名受访者评论,如果一个病例有小叶形态但E-cadherin阳性,他们仍然会诊断为ILC。抗体克隆的类型和使用的方案,有很大差异。此外,还要求参与者提及他们报告的ILC亚型。以及WHO认可的模式(实性、腺泡状、多形性、组织细胞样/大汗腺样),及其他亚型,包括小梁状和ILC伴小管成分。
总结
近年来,LCIS和ILC的疾病谱系有所扩大,病理医师应了解这些变异型及其鉴别诊断,以便进行适当的临床管理。E-cadherin(及其他连环蛋白相关蛋白,如p120和β-catenin)的异常表达,是这些病变的特征;然而,判读时IHC应视为形态学的辅助手段,因为具有典型的小叶形态学的病变,可能保留E-cadherin表达并缺乏CDH1基因突变。目前的研究表明,用于诊断ILC的组织病理学标准存在差异,尤其是具有混合形态的肿瘤。组织学肿瘤分类,应基于临床行为,以便更有效地对患者进行分层和管理。目前需要ILC和不同亚型的组织病理学诊断的共识指南。
点此下载原文献
参考文献
[1] Maria Gabriela Kuba, Edi Brogi. Update on lobular lesions of the breast. Histopathology. 2023 Jan;82(1):36-52. doi: 10.1111/his.14829. PMID: 36482279 PMCID: PMC9752180 (available on 2024-01-01) DOI: 10.1111/his.14829


















共0条评论