[导读] 译者:陈旭
STK11附件肿瘤
STK11附件肿瘤是2020年发现的一种肿瘤,过去被错误分类为其他肿瘤类型,最常见的是FATWO和EC。由于这种肿瘤是一个非常新的类型,随着更多病例的报道和更多信息的积累,下面描述的特征可能会在未来发展。
临床表现
STK11附件肿瘤与Peutz-Jeghers综合征有显著关联。它发生的平均年龄为40岁(范围=17-66岁),与 FATWO不同,大多数女性都有症状(腹盆疼痛、泌尿道问题、异常子宫出血)。少数患者与血清睾酮升高相关,大多数患者缺乏激素表现。就诊时转移性疾病和复发患者分别占总体的50%和80%。在迄今为止唯一的系列研究中,40%的患者带病存活,20%的患者死于疾病(中位随访时间=3年)。
大体特征
大多数STK11肿瘤发生在输卵管旁软组织,并可能累及卵巢或输卵管;然而,它们很少起源于卵巢或腹盆软组织。肿瘤直径为4.5至25.5(平均=12.4)厘米,颜色各不相同,通常为实性或实性和囊性,通常伴有出血和坏死。
微观特征
虽然STK11肿瘤的结构模式多样,但大多数为均匀的非典型细胞的相互吻合索和小梁渗入整个粘液水肿间质,类似于唾液腺肿瘤(图 6和图7)。其他生长包括管状、囊状、筛状、微泡状、巢状、结节状、乳头状、滤泡状和实性。细胞通常呈立方形至柱状,但偶尔呈纺锤形。它们显示嗜酸性至细小空泡和透明的细胞质,具有圆形至卵形核、泡状染色质和明显的核仁,缺乏明显的核多形性。可见核沟,但并不显眼。核分裂计数从稀有到每10个HPF20个(平均值=10)。细胞涡状结构、鳞状细胞外观、印戒样细胞、肾小球样结构或良性混合粘液上皮细胞很少见。间质范围从稀少到丰富,可以是粘液样、水肿、松散胶原质或玻璃样变,如果索状和小梁生长占主导地位,前者尤其引人注目。与FATWO相比,嗜碱性而非嗜酸性管腔内分泌物更常见。坏死很少见。
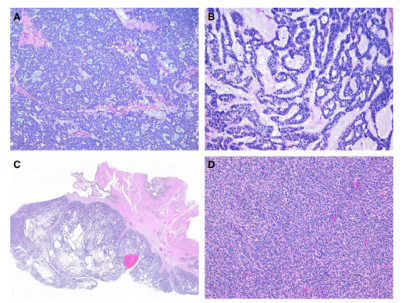
图6.具有唾液腺肿瘤样外观的STK11附件肿瘤(A)、粘液样基质中的吻合索和小梁(B)、大囊性生长(输卵管旁位置)(C)和伴梭形细胞的实性生长(D)。
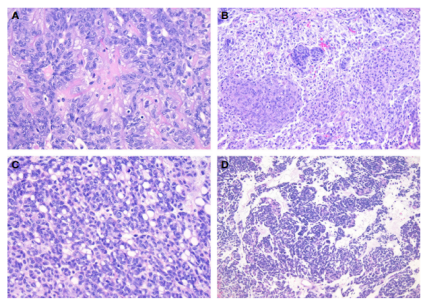
图7.STK11附件肿瘤具有均匀的非典型细胞,显示突出的细胞核、罕见的核沟和间质透明化(A)。鳞状细胞外观(B)、印戒样细胞(C)和细胞化生(D)。
免疫组织化学
STK11肿瘤具有非特异性免疫组织化学特征,通常对全细胞角蛋白(强,程度可变)、几种性索间质标志物(WT1和calretinin,强而弥散;抑制素,通常为中度和局灶性)、激素受体(ER、ER、中度至强和弥漫性;PR中度至强,程度可变;AR,弱至中度,程度可变),CD10(局灶性)和D2-40(程度可变)。CK7在60%的肿瘤中通常呈局灶性表达,而SF-1、EMA和PAX8在不到30%的肿瘤中呈局灶性表达。FOXL2、claudin-4和TTF-1始终呈阴性,在部分肿瘤中发现非常局灶且微弱的GATA3阳性。
分子特征
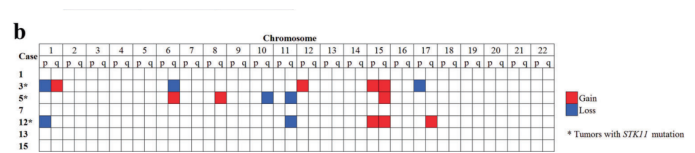
图.STK11附件肿瘤中发现了拷贝数变异。图片源自于 https://doi.org/10.1038/s41379-019-0375-9
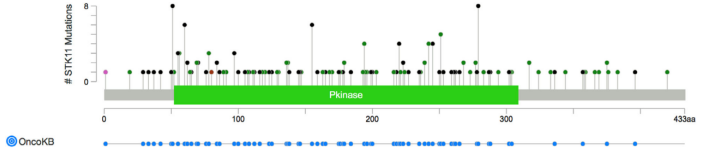
图.STK11常见突变位点。图片源自于The Oncologist 2020;25:733–737.
报道的STK11改变,包括致病性突变、意义不确定的变体和缺失;因此,报告突变和拷贝数改变的下一代测序组,在诊断检查中是必需的。杂合性缺失常见,大多数表现为野生型等位基因的缺失。 反复出现的拷贝数变异包括1p和11q的丢失,以及1q、15q和15p的增加。报告的非复发性突变包括PIK3C3、GNAQ、KMT 2C、ARID1B、RAD51B和PCDH15。
鉴别诊断
STK11附件肿瘤很少与EC混淆,特别是那些类似于Wolffian起源的附件肿瘤,广泛取样以揭示EC的典型特征(结构良好的腺体、子宫内膜异位症、鳞状细胞分化等)以及免疫组织化学和分子分析应有助于这种鉴别诊断。对于性索间质瘤,定位和临床血清学评估,以及对具有挑战性的病例进行分子分析,将会最有帮助。然而,应该注意的是,部分Sertoli细胞肿瘤可能与Peutz-Jeghers综合征有关。最后,肿瘤分布、BAP-1丢失/BAP-1基因组改变和电子显微镜,都有助于STK11肿瘤和间皮瘤之间的鉴别诊断。
中肾管样腺癌(MLA)
MLA最早由McFarland等人于2016年报告,该肿瘤最常见于子宫内膜和卵巢,很少见于输卵管或结肠系膜。目前专家倾向认为,MLA具有苗勒管派生特性,因为它们经常与卵巢子宫内膜异位症,以及其他苗勒管肿瘤相关。
临床表现
卵巢MLA患者通常处于绝经后(平均/中位数=61;范围=36-81岁),并表现为盆腔疼痛、异常子宫出血或腹胀。晚期FIGO分期 (II-IV)见于39-62%的患者。据报道,分别有42%和67%的患者出现局部和远处(肺、肝、网膜)复发。在随访系列(n=25)中,5年无进展生存率和疾病特异性生存率分别为68%和71%。
大体和微观特征
肿瘤直径为4至32厘米,通常为实性和囊性,切面呈灰白色或黄褐色。在组织学上,生长模式包括管状、腺状、乳头状、裂隙状和实体状,前两种通常占主导地位(图 8)。嗜酸性胶体样物质通常存在于管腔中,至少是局灶性的。细胞呈柱状至立方形,中度非典型,与甲状腺乳头状癌相似。它们可能被细胞质钉住,从稀少和苍白到嗜酸性,核分裂指数多变。鳞化和粘液分化不存在。已报道罕见的中肾样癌肉瘤,由同源肉瘤或软骨肉瘤组成。在一个病例报道中,MLA被描述为“软骨分化”;然而,缺乏进一步的细节或显微照片来确定它是否代表中肾样癌肉瘤。
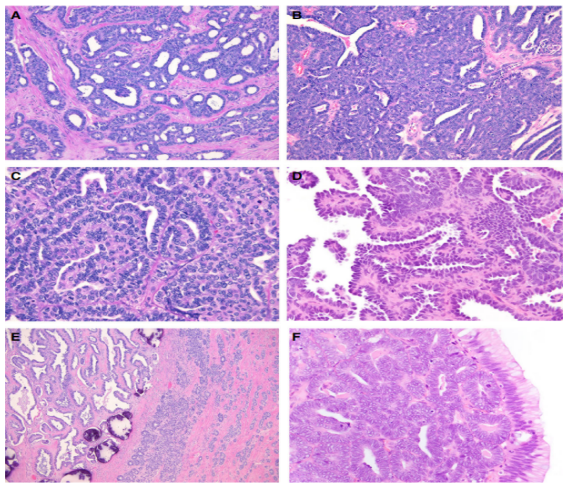
图8. 具有管状(A、B)和导管(C)生长的中肾样腺癌。具有重叠细胞核和散在核假包涵体的乳头状生长(D)。低级别浆液性癌(E,左)和粘液性囊性肿瘤(F,右)与中肾样腺癌并列。
免疫组织化学
虽然MLA是一种形态学诊断,但几种免疫染色支持这种诊断(图9)。肿瘤通常为GATA3和TTF-1阳性,尽管染色可能是局灶性的。ER和PR通常为阴性(或最多为局灶性阳性,尽管据报道在子宫内膜中高达40%的阳性率),而PAX8和CK7为阳性。CD10在大约20%的肿瘤中,表现出顶端/管腔染色,约35%的肿瘤为Calretnin阳性。P53始终是野生型,WT1是阴性的。HNF1b、Napsin A和p16可以可变地表达,但尚未得到广泛研究。c-KIT表达已在3例MLA中被报道,没有伴随的CKIT突变,PD-L1在一个病例中。有20%的肿瘤细胞表达。
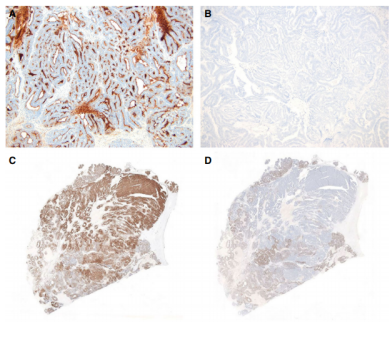
图9.具有管腔CD10表达 (A)、阴性雌激素受体(ER)(B)和GATA3(C)和TTF-1(D)的中肾样腺癌。
分子改变

图.宫颈中肾癌和卵巢和子宫内膜中肾样癌的突变谱和拷贝数的改变。通过针对468个癌症相关基因的大规模平行测序,在8个宫颈中肾样癌和28个卵巢及子宫内膜中肾样癌中检测到一个非同义体细胞突变。案例以列表示,基因以行表示。临床病理特征包括组织学、复发部位和原发性/转移(上)。体细胞突变类型根据图例用颜色编码。野生型等位基因的杂合性缺失(LOH)用对角线条表示。请注意,对于混合组织学的病例,只显示中肾或中肾样成分。B对8例中肾样癌和28例中肾样癌进行靶向MSK冲击大规模平行测序后的拷贝数改变。病例沿x轴行显示,染色体以列显示。临床病理特征包括组织学、复发部位、原发性/转移(左)。浅红色,拷贝数增加;浅蓝色,拷贝数丢失;白色,无变化。未发现反复出现的扩增或纯合子缺失。图片源自于Modern Pathology (2021) 34:1570–1587.
几乎所有卵巢MLA在KRAS(p.G12D、p.G12V、p.G12C、p.G12A)中都存在热点突变,在其余部分检测到NRAS p.Q61R突变。在大约40%的KRAS突变型MLA中描述了并发PIK3CA突变,但在具有NRAS突变的患者中没有描述。非重复突变包括AMER1, MYCN, BCOR, CTNNB1,SPOP, CREBBP, NOTCH3, ARID1A, FBXW7, SETD8, FANCA, AKT1, ASXL1和RAD54L。虽然不是MLA特有的,但可能会发生染色体1q、2、10和12的增加以及1p的丢失。所有评估的肿瘤都是微卫星稳定的,具有低肿瘤突变负荷。
与苗勒管相关的病变/肿瘤
有多份关于MLA与子宫内膜异位症和/或苗勒管肿瘤相关的报告,分子分析证明后者是克隆相关的(共有KRAS/NRAS突变)。MLA与浆液性交界性肿瘤/低级别浆液性癌混合,是最常见的关联 , 并且转移性疾病可以由一种或两种成分组成。其他相关的苗勒管肿瘤包括浆液性囊腺瘤、混合性浆液性和粘液性腺纤维瘤、子宫内膜样交界性腺纤维瘤、粘液性交界性肿瘤和高级别浆液性癌。然而,后者在两种成分(高级别浆液性癌中为TP53;MLA中为 KRAS和PIK3CA)中显示出不同的分子谱,可能代表碰撞瘤。
Deolet等人描述了与成熟囊性畸胎瘤相关的MLA,后者占肿瘤的10%。虽然MLA成分具有中肾免疫特征(PAX8、GATA3、TTF1、CD10 阳性;ER、PR阴性),但在任一成分中均未发现KRAS、NRAS或PIK3CA改变。在两个组件中检测到大量拷贝数变异,包括1q重复和12号染色体四体。同一作者描述了一种与MLA紧密并列但未混合的混合性恶性生殖细胞肿瘤。有趣的是,这两种成分都具有相同的分子改变(KRAS和PIK3CA突变,PTEN扩增,等染色体12p),但无法确定“亲代”肿瘤的来源。
鉴别诊断
除了FATWO和STK11肿瘤(表 2),MLA鉴别诊断的主要实体包括EC、透明细胞癌(CCC)、MC和甲状腺乳头状癌。MLA与EC非常相似,虽然两者都与子宫内膜异位症有关,只有EC显示鳞状或粘液性化生,未观察到乳头状甲状腺癌样核特征。值得注意的是,GATA3(强和弥漫性)和TTF-1(通常是局灶性的,未描述染色强度)分别在多达5%和27%的卵巢EC中表达因此,除非存在原型形态学特征,否则阳性不能诊断MLA。同样,ER在1、2和3级EC中分别有7%、26%和23%的表达率。据报道,12%的卵巢EC中错配修复蛋白表达缺失,但在MLA 中没有。分子分析的帮助有限,因为两者都可能携带KRAS和PIK3CA突变。
由于MLA可以有管状和囊性生长以及透明细胞和钉状细胞,因此要与CCC鉴别诊断。两者通常都是 PAX8 阳性,ER和PR阴性(或至多为局灶性阳性)。尽管 HNF1b和Napsin A表达是CCC的特征,在MLA中可以看到可变阳性,这限制了它们的效用。同样,GATA3(斑片状、弱到中等)和TTF-1(通常是局灶性、强度可变)分别在高达 10%和14%的CCC中呈阳性。异常的p53表达或异常的错配修复蛋白表达仅在 CCC 中有报道(分别占肿瘤的25%和6%)。分子检测可能是有益的,因为尽管这两种肿瘤都可能携带PIK3CA和KRAS突变(后者仅存在于5-14%的CCC中),CCC更可能具有ARID1A、TP53和TERT启动子突变。
MC通常出现在深宫颈壁或外层子宫肌层,并可能与MRs或中肾增生有关。在描述MLA之前,报告了三个假定的卵巢或阔韧带MC,它们很可能代表MLA。因此,由于MLA和MC具有几乎相同的形态学和免疫组织化学特征,主要区别在于前者的TTF-1阳性频率更高,位置对于这种区分至关重要。
甲状腺乳头状癌,无论是原发性(起源于畸胎瘤)还是转移至卵巢,都极为罕见。然而,由于MLA表现出甲状腺乳头状癌样核特征,并且通常PAX8和TTF-1呈阳性,因此需与甲状腺癌鉴别诊断。临床病史和放射学发现有助于排除转移,而畸胎瘤成分(包括瘤)的存在有助于指向原发性肿瘤。有时,畸胎瘤中出现的躯体恶性肿瘤会过度生长残留的畸胎瘤成分,在这些情况下,甲状腺球蛋白可能会有用,因为MLA对该标记物始终呈阴性。
结论
尽管 FATWO、STK11附件肿瘤和MLA是罕见的肿瘤,但它们的识别不仅在预后方面很重要,而且对于治疗也很重要,因为STK11肿瘤通常与Peutz-Jeghers综合征相关。额外的基因组学、表观遗传学、转录组学和蛋白质组学调控研究是确定这些独特肿瘤组织发生的关键,从而为靶向治疗的发展铺平了道路。
往期回顾:
女性上生殖道的中肾管样病变、 STK11附件肿瘤和中肾管样肿瘤的临床病理特点(一)




















共0条评论