[导读] 本文作者:薛德彬
往期回顾:
乳腺浸润性癌切除标本(注释A-D)
CAP模板
一、乳腺浸润性癌切除标本(注释)
2022年6月 v4.7.0.0
E.肿瘤大小(浸润性癌大小)
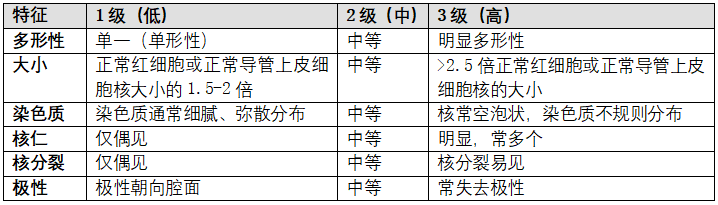
浸润性癌的大小是一项重要的预后因素。使用最大浸润性癌灶的单个最大径确定T分期(图C1,A-F)。AJCC中T分期的最佳大小应结合影像学、病理大体检查和镜下评估信息来确定1。目测肿瘤大小常不可靠,因为癌常边界不清,浸润、混入邻近纤维组织。可触及的质硬肿块,常与肿瘤细胞浸润间质并伴促结缔组织反应相关。肿瘤大小的测量应精确到毫米。某些病例中,大小很难确定。
DCIS伴微浸润:AJCC对微浸润的定义是浸润不超过1mm1。如果微浸润灶超过1个,应报告微浸润灶的数量、估计数量或备注微浸润灶太多难以计数等。某些病例中,肌上皮免疫组化染色有助于识别浸润灶区域和浸润灶大小。浸润性肿瘤如果大于1mm但小于2mm,应四舍五入为2mm。
References
1. Amin MB, Edge SB, Greene FL, et al, eds. AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer; 2017.
F.肿瘤数量(单灶或多灶性浸润性癌)
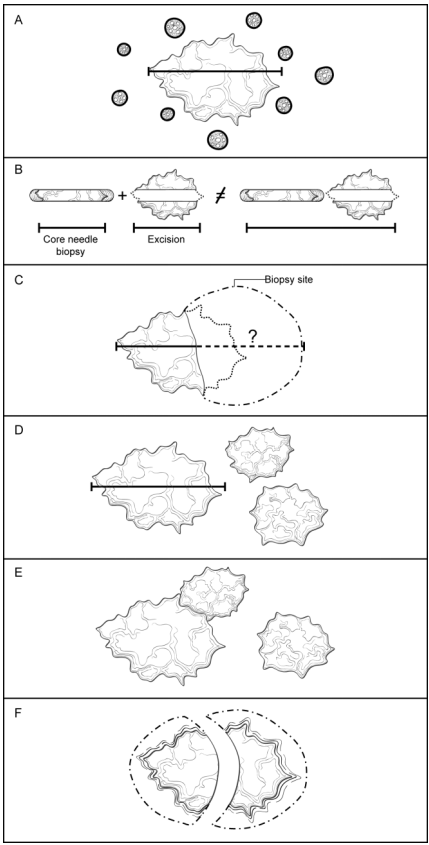
如果只是单发浸润性癌,不必特殊说明肿瘤数量。如果是多发,应报告病灶数量。多灶性浸润性癌分为以下6组:
· 广泛原位癌(CIS)伴多灶浸润(图F1,A)。广泛DCIS有时伴有多灶浸润。浸润性癌成分组织学表现和免疫表型通常相似,除非DCIS显示显著异质性。这是多灶浸润性癌最常见的病因。
· 浸润性癌伴较小的卫星浸润灶(图F1, B)。有时一个大癌灶周围围绕较小的浸润灶。这种情况下,因浸润性癌不规则侵犯间质,二维切面看起来像多灶。此时,较小癌灶与主要癌灶的组织学表现和免疫表型通常相同。
· 浸润性癌伴广泛淋巴管-血管侵犯(LVI)(图F1, C)。其他浸润灶可能源自LVI区域(即,乳腺内转移)。多发癌的组织学表现和免疫表型通常相同。归为T4b的皮肤卫星结节常是源自真皮淋巴管-血管侵犯。
· 生物学独立的多灶性浸润性癌(图F1, D)。部分浸润性癌是多灶、同时发生、生物学表现不同。种系突变的患者进展为多灶癌的风险增加。癌的组织学表现和免疫表型可以相似或不相似。
· 新辅助治疗后的浸润性癌(图F1, E)。化疗反应显著的癌通常表现为纤维化瘤床内的多个残留癌灶(见注释K)。各浸润灶的组织学表现和免疫表型常一致。
· 单个癌灶被切成多个碎块(图F1, F)。如果破碎标本的多个碎块都有浸润性癌,应认为是一个癌灶被切碎。结合临床和影像学发现有时能帮助确定最佳T分期,并确定是否癌灶。
与特殊癌有关的特征(即,组织学类型、级别、大小、ER/PgR/HER2结果),应按最大浸润性癌灶情况在病例总结中报告。如果较小的癌灶有不同的组织学类型或组织学级别,应将该信息写入“其他发现”中,并推荐进行其他相关辅助检查。与乳腺浸润性癌所有类型有关的特征(如,切缘和淋巴结状况),在病例总结的主要部分报告。
大体明显多发性的浸润性癌,淋巴结转移的风险更高1。但是,淋巴结无转移的患者,发生远处转移的风险并未显示增加。
对于多发同侧浸润性癌,AJCC的T分期是根据最大灶确定。用“m”区分那些只有单个浸润性癌灶的病例。如果患者有同时发生的双侧浸润性癌,每个癌灶分别分期,分开检测T分期、N分期和生物标记物。
References
1. Andea AA, Wallis T, Newman LA, Bouwman D, Dey J, Visscher DW. Pathologic analysis of tumor size and lymph node status in multifocal/multicentric breast carcinoma. Cancer. 2002;94:1383-1390.
G.导管原位癌
行保乳手术、伴浸润性癌的导管原位癌患者,局部复发的风险增加。更重要的是,以导管原位癌为主时要报告它的特征(如,DCIS伴微浸润或广泛的DCIS伴T1a乳腺癌)。如果DCIS是浸润性癌的次要成分,DCIS特征的临床意义变小。乳腺切除标本中DCIS的范围没有预后意义。因此,DCIS的大多数报告要素都是可选项,病理医生可以自行选择决定报或不报。
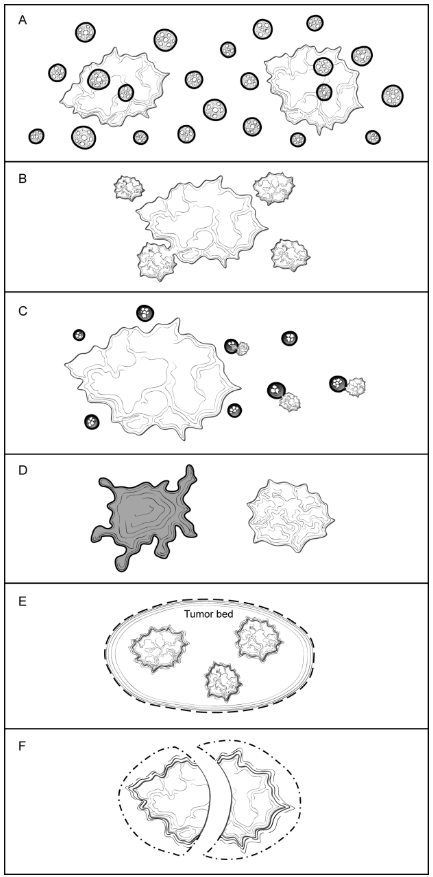
病理报告应注明是否有广泛的DCIS。广泛导管内癌成分(EIC)阳性的浸润性癌有2种定义方式(图G1,A-D)1:
1、浸润性区域内导管原位癌为主要成分(≥25%),而且周围乳腺组织内也含有DCIS。
2、 浸润性癌伴广泛的DCIS。
广泛导管内癌成分(EIC)阳性的浸润性癌,手术切缘未评估或局灶有累及时,局部复发风险增加。DCIS未贴近切缘时,EIC阳性的意义不大。乳腺切除术治疗的患者,DCIS的范围没有局部复发的风险。
某些病例中,尽管浸润性癌区域外有DCIS,但严格地讲并不符合EIC阳性的浸润性癌诊断标准。这种情况下,定量DCIS范围可帮助判断是否需要放射治疗。
其中的DCIS范围与广泛DCIS伴微浸润相关性最强,与无EIC的巨大浸润性癌相关性最弱。估计DCIS范围的方法包括:病变只限于一张组织切片时直接测量病变大小;按顺序检查全部标本切片并按相同厚度取材送检,计算DCIS总大小;或计数有DCIS的蜡块数量。美国病理学会DCIS模板2还提供其他信息确定DCIS范围。
DCIS结构模式
DCIS的结构模式,历来都要报告。但核级别和坏死更能预测临床预后。
DCIS核级别
DCIS核级别通过6个形态学特征确定(表2)3。
表2.DCIS核级别
坏死
坏死的存在与乳腺钼靶检查发现钙化相关(即,大多数坏死灶会有钙化)。导管原位癌,经乳腺钼靶检查发现的钙化,常能在组织学中重复出现。坏死可分为以下两种:
· 中央(“粉刺样”)坏死:原位癌导管腔的中央区域被膨胀性坏死灶取代,低倍镜下容易识别。通常能见到影细胞和核碎片。尽管中央性坏死常伴高级别核(即,粉刺样DCIS),低或中核别的DCIS也能发生中央坏死。
· 局灶坏死:低倍镜下坏死灶小、不明显,或为单个细胞坏死。
坏死应与分泌物区分开,后者也伴随钙化,但不含核碎片。
References
1. Morrow M, Harris JR. Local management of invasive breast cancer (chapter 33). In: Harris JR, Lippman ME, Morrow M, Osborne KE, eds. Diseases of the Breast. 2nd ed. Philadelphia, PA: Lippincott Williams & Wilkins; 2000:522-523.
2. Fitzgibbons PL, Bose S, Chen Y, et al. Protocol for the Examination of Specimens From Patients with Ductal Carcinoma In Situ (DCIS) of the Breast. 2019; www.cap.org/cancerprotocols.
3. Schwartz GF, Lagios MD, Carter D, et al. Consensus conference on the classification of ductal carcinoma in situ. Cancer. 1997;80:1798-1802.
H.肿瘤的大体及镜下范围
乳腺癌可浸润上方的皮肤或侵犯胸壁,浸润情况取决于肿瘤大小和部位。AJCC分期要报告皮肤和肌肉浸润,用于决定是否进行局部治疗。如果标本连带皮肤或肌肉,大体描述应始终包括皮肤或肌肉,最终诊断中应报告皮肤或肌肉与癌的结构关系。癌伴发的DCIS范围很重要,决定手术术式,确保切缘阴性。
皮肤
乳腺癌累及皮肤有多种方式:
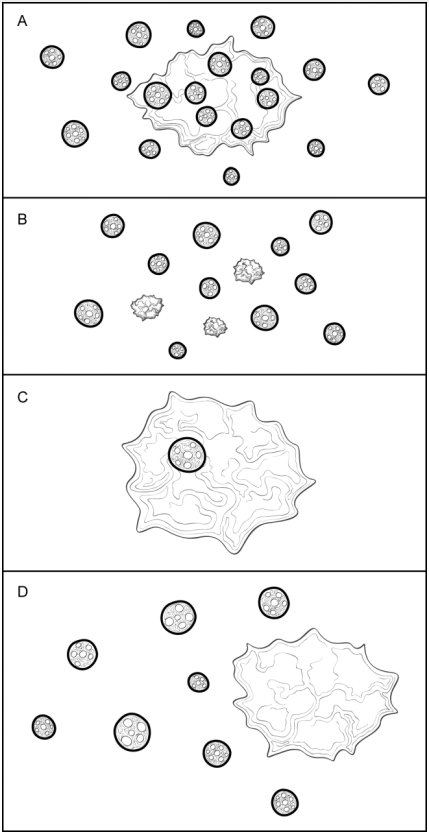
· DCIS累及乳头表皮(乳头Paget病)(图H1,A):DCIS不突破基底膜,沿输乳管窦扩展到相连的皮肤。该发现不改变浸润性癌T分期。
· 癌浸润真皮或表皮,无溃疡形成(图H1, B):皮肤浸润与临床发现癌固定于皮肤相关,可伴随皮肤皱缩或乳头内陷。该发现不改变T分期。
· 癌浸润真皮或表皮,伴皮肤溃疡形成(图H1, C):过去认为皮肤溃疡常与巨大、局部进展的乳腺癌相关。然而,皮肤溃疡也与小的表浅性乳腺癌相关。皮肤受累的乳腺癌是否比肿瘤大小相近但无皮肤浸润的癌预后差,尚不得而知。有皮肤溃疡的乳腺癌分期为T4b。
· 同侧皮肤卫星结节(图H1,D):真皮内的浸润癌灶,与主癌灶不相连,常伴淋巴管-血管侵犯。卫星结节应肉眼可见,镜下证实。该发现归为T4b 。镜下偶然发现的真皮卫星结节,其临床意义有待进一步研究。
· 真皮淋巴管-血管侵犯(图H1,E):真皮淋巴管内见癌常与临床炎性癌特征相关(弥漫红斑及水肿,累及乳腺皮肤1/3以上),这样的病例应归为T4d。缺乏临床炎性癌特征时, 该发现仍是一项预后差因素,但不足以分期为T4d 。该发现应单独记录在“真皮淋巴管-血管侵犯”项下面。
肌肉
在标本深部/后缘可能有骨骼肌。看到骨骼肌证明已切除到深筋膜。有骨骼肌浸润时应报告,因为该发现可用于提示乳腺切除术后需行放射治疗。
看到的骨骼肌通常是胸肌。浸润胸肌不属T4a。肿瘤分期为T4a,必需是穿过胸肌浸润到胸壁(肋间肌或更深)。但乳腺手术标本很少切除胸壁肌肉。T4a分期通常是通过局部晚期癌的影像学检查确定。
图C1.确定浸润性癌大小。A、浸润性癌伴周围DCIS。肿瘤大小只包括浸润性癌区域,不包括邻近的DCIS区域。测量时应精确到毫米。B、之前粗针活检过的小浸润癌灶。粗针活检中癌灶大小不应加入切除标本中癌灶大小中,因为加入计算的话常会高估肿瘤真正大小。最佳的肿瘤大小分期须考虑到粗针活检和切除标本中癌灶的最大径和粗针活检前影像学检查的肿瘤大小。C、浸润性小癌灶,伴邻近活检部位反应。部分切除标本,小癌灶附近有相对大的活检部位反应区。肿瘤的实际大小无法准确测量。应结合粗针活检、切除标本和影像学检查中的肿瘤大小确定最佳的肿瘤大小分期。D、多个浸润性癌。如果癌灶多发,用最大的浸润性癌灶数值进行T分期。多发的浸润性癌用代码“m”表示。E、多发浸润性癌大小接近。区分相邻多发癌灶与一个大浸润癌灶,可能困难。肉眼仔细检查标本,观察大体明显的癌灶之间组织,很有必要。结合影像学发现也很有用。通常,将肉眼最大浸润性癌灶取材,在镜下观察证实其大小用于T分期。F、浸润性癌被切断。如果浸润性癌已切断,组织碎片超过1块,不应将每块破碎组织的肿瘤大小相加,因为有可能高估肿瘤真正大小。多数情况下,结合影像学检查乳腺肿瘤大小,有助于选择最佳肿瘤大小进行分期。其他情况下,病理医生需运用自己的判断,确定AJCC的T分期。
(图中文字:Core needle biopsy粗针穿刺活检;Excision切除;Biopsy site活检部位)
图F1.多发浸润性癌。A、广泛原位癌伴多灶浸润。浸润性癌的组织学和免疫表型通常相似,除非DCIS显示显著的异质性。B、浸润性癌伴较小的卫星灶。较小的癌灶通常距离主要的癌灶1-5mm,很可能是主要癌灶侵犯周围引起,在蜡块另一切面或许能看到主要癌灶与周围小癌灶相连。癌灶的组织学表现和免疫表型通常一致。大小规则的例外——如果两个组织学相似的癌灶彼此之间的距离在5.0 mm以内,则从两个癌灶的外边缘测量。C、浸润性癌伴广泛淋巴管-血管侵犯。淋巴管-血管侵犯可形成其他浸润性癌灶(即,乳腺内转移)。各癌灶的组织学表现和免疫表型通常相同。D、生物学独立的多发浸润性癌。癌灶通常相隔很远,组织学表现和免疫表型可不同。E、术前(新辅助)治疗后浸润性癌。如果治疗反应明显,纤维化的瘤床中可见多个癌灶散在发布。残留癌的组织学表现和免疫表型通常与术前癌灶的相似,但某些病例中可因治疗发生变化。F、单个癌灶被切成多个碎块。如果手术时切碎癌灶,确定癌灶单发或多发会很困难。各个癌灶的组织学表现和免疫表型应相似。
图G1. 广泛的导管内癌成分(EIC)。A、广泛导管内癌成分(EIC)阳性的浸润性癌,界定标准如下:(1)浸润性癌灶内有显著的DCIS,(2)浸润性癌灶外也有DCIS。 B、EIC阳性的浸润性癌还包括DCIS伴一灶小(不超过10mm左右)浸润性癌或多灶小浸润癌。C、EIC阴性的浸润性癌,不满足EIC阳性浸润性癌的诊断标准。D、部分癌严格地讲并不满足EIC诊断标准,但周围组织中伴广泛的DCIS。这种情况下,测量标本中DCIS的范围是有帮助的。
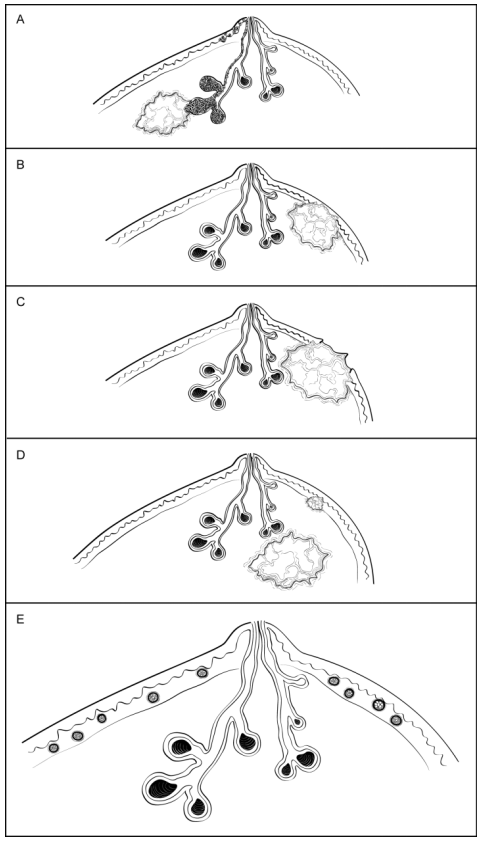
图H1.浸润性癌:皮肤累及。A、导管原位癌(DCIS)累及乳头表皮(乳头Paget病)伴浸润性癌。DCIS可穿过输乳管窦进入表皮,不需突破基底膜。该发现不改变下方浸润性癌的T分期。B、癌浸润真皮或表皮,无溃疡形成。该发现不改变浸润性癌的T分期。C、癌浸润真皮和表皮,伴皮肤溃疡形成。癌应分期为T4b,除非有其他特征符合T4c(胸壁浸润)或T4d(炎性癌)分期标准。D、同侧皮肤卫星结节。真皮中的浸润性癌灶,与主癌灶不相连,常伴淋巴管-血管侵犯。该发现归类为T4b,除非有其他特征满足T4c(胸壁浸润)或T4d(炎性癌)标准。E、真皮淋巴管-血管侵犯。如果真皮淋巴管内见癌,临床有炎性癌特征(弥漫红斑及水肿,累及乳腺皮肤1/3以上),应归类为T4d。如果临床没有炎性癌特征,该发现不改变其T分期,但是是预后差的一个指标。


















共0条评论