[导读] 作者:陈旭
导读:
横纹肌肉瘤 (rhabdomyosarcoma,RMS)是相对少见的软组织恶性肿瘤之一,WHO根据其临床以及病理学特点将其分为4个亚型:胚胎性横纹肌肉瘤(embryonic rhabdomyosarcoma,ERMS),腺泡性横纹肌肉瘤(alveolar rhabdomyosarcoma,ARMS ),多形性横纹肌肉瘤(pleomorphic rhabdomyosarcoma,PRMS)和硬化性横纹肌肉瘤(sclerrosing rhabdomyosarcoma,SSRMS) 。大多数横纹肌肉瘤靠形态学及免疫组化可以做出诊断,对于一些分化较差的病例,特别是一些腺泡性横纹肌肉瘤,诊断较为困难。2022年1月20日,美国南加州大学洛杉矶分校凯克医学院的Larry L.Wang博士为通讯作者,在病理学顶尖综述期刊《Archives of Pathology &Laboratory Medicine》(IF值为5.686分)上发表题为“An Integrative Morphologic and Molecular Approach for Diagnosis and Subclassification of Rhabdomyosarcoma”的综述性文章,详尽介绍了横纹肌肉瘤的分型、分子遗传学改变及诊断思路。下面将这篇综述全文编译如下,供相关医师及研究者参考。

文献要点:
摘要
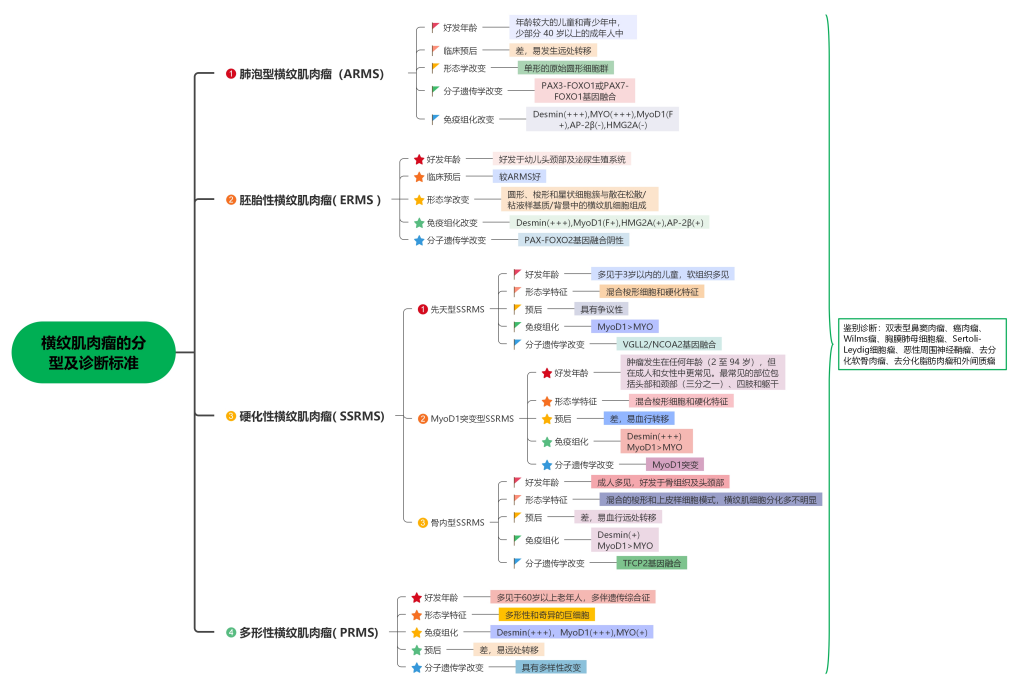
横纹肌肉瘤(RMS)是儿童最常见的软组织肉瘤,根据最近的分子遗传学知识和形态学特征,目前将横纹肌肉瘤分为以下4个亚型:胚胎性横纹肌肉瘤(ERMS)、肺泡型横纹肌肉瘤(ARMS)、梭形细胞/硬化性横纹肌肉瘤(SSRMS)和多形性横纹肌肉瘤(PRMS)。根据WHO软组织和骨肿瘤分类第五版以及最近发表的文献和临床实践经验,横纹肌肉瘤的最新基因型和表型受到病理医师的广泛关注。
目前RMS的分类受到基因型和表型相关性的显着影响,尤其是PAX-FOXO1融合阳性横纹肌肉瘤与融合阴性横纹肌肉瘤,以及梭形细胞/硬化性横纹肌肉瘤 3 种不同的新亚型的出现。尽管过去所有的横纹肌肉瘤都被认为是单一的疾病,但它们现在被认为是一组组织学相似但生物学多样化的疾病,因为它们的临床行为和潜在的分子改变存在显着差异。这篇综述概述了RMS最近的分子遗传学发展、相应的形态学特征以及病理学家在日常实践中面临的当前挑战。
简介
横纹肌肉瘤(RMS)是儿童和青春期最常见的软组织肉瘤,约占儿童肿瘤的5%及小儿软组织肉瘤的 50%。该病在成人中相对少见,PRMS几乎只发生在成人,男性较为多见。RMS基本上发生在任何部位,但亚型往往出现在特定区域;例如,ARMS好发于四肢,而ERMS通常出现在头颈部、泌尿生殖道和胆管。最初的 Horn-Enterline 分类是基于反复出现的形态特征,其中RMS被细分为胚胎型、肺泡型、葡萄状和多形型,分子遗传学的出现导致人们认识到遗传和表观遗传改变是RMS各种亚型的特征,并与其形态特征相对应。结合形态学和分子遗传学特点,目前WHO分类将RMS分为以下4种亚型:胚胎型 (ERMS)、肺泡型 (ARMS)、梭形细胞/硬化型(SSRMS) 和多形性(PRMS)。在这篇综述中,作者阐述了目前对RMS的分子特征和形态特征的理解,以及将分子遗传学改变纳入病理诊断的基本原理。
RMS的诊断
尽管传统上被认为是骨骼肌肿瘤,但许多RMS起源于缺乏肌肉组织的部位。在组织学上,肿瘤细胞类似于原始间充质来源的肿瘤,含有发育未成熟的肌肉细胞,并显示出从未分化的“胚泡”细胞到横纹肌细胞到具有横纹的终末分化骨骼肌细胞的分化谱,最原始的横纹肌细胞是具有稀疏两亲细胞质的星状细胞。随着横纹肌细胞分化,可见更多嗜酸性的细胞质并变得更细长,形成肌管并最终形成横纹。分化的组织病理学证据程度因病例而异。横纹肌细胞的鉴定可能是做出确定诊断的关键。标准免疫标志物需标记肌肉分化的蛋白质,例如desmin和SMA,以及导致横纹肌分化的转录因子,例如Myogenin和 MyoD1。在肿瘤细胞中,desmin呈弥漫性阳性,而Myogenin和MyoD1染色在不同亚型中表达具有差异性。
基因检测的基本原理
最明确的横纹肌肉瘤类别是与复发性分子改变相关的那些。大多数具有ARMS组织学的RMS包含FOXO1融合,而SSRMS包含MYOD1突变或NCOA2-VGLL2基因的融合。ERMS 显示出多种遗传改变,包括染色体11p15.5 杂合性的丧失和RASopathy相关的突变,这些突变通常伴随着复杂的染色体变化。分子遗传信息对于确认诊断至关重要,并且与肿瘤部位、患者年龄、组织学亚型、切除的完整性和肿瘤扩散作为关键证据,将RMS患者分层为低风险、中等风险和高危人群,对不同风险人群提供治疗策略,并指导潜在治疗靶点的开发。
PAX-FOXO1融合阳性的RMS:ARMS
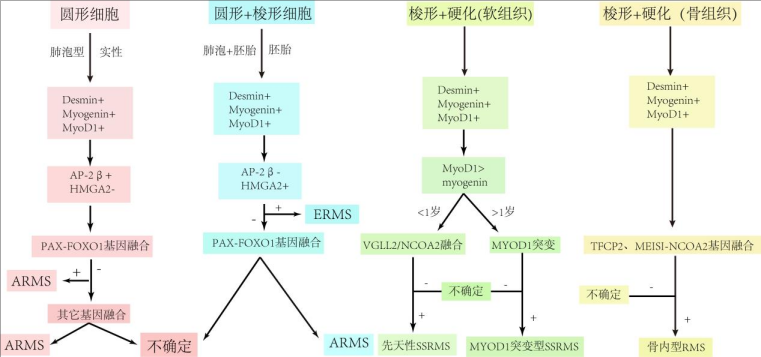
ARMS诊断中最重要的证据是确定PAX-FOXO1基因融合状态。尽管历史上ARMS和ERMS的名称和定义是指它们的组织学特征,但PAX-FOXO1融合阳性的存在与否已成为决定风险分层、治疗方案分配和预后的关键问题。PAX-FOXO1融合阳性RMS比PAX-FOXO1融合阴性RMS对治疗的敏感性更高,PAX-FOXO1融合阳性ARMS患者的预后比PAX-FOXO1融合阴性ARMS或ERMS患者更差。生物学研究表明,融合阴性ARMS和ERMS之间没有基因改变的差异。由于这些原因,现在将ARMS的诊断等同于PAX-FOXO1融合阳性的RMS,而PAX-FOXO1融合阴性ARMS,约占组织学ARMS的15%,被认为是WHO分类推荐的ERMS的原始形式。
ARMS具有明显的临床病理学特征,它是RMS的第二常见亚型,约占RMS的25%,主要发生在年龄较大的儿童和青少年中,少部分40岁以上的成年人中。ARMS是RMS组织学上未分化程度最高的亚型,由单形的原始圆形细胞群组成,通常没有骨骼肌分化的形态学证据。临床上,ARMS进展迅速,25%至30%的患者通过淋巴或血行扩散出现远处或局部转移。ARMS有2种组织学生长模式:经典肺泡型和实性型,经典ARMS显示细胞内聚力的中心丧失和不规则肺泡空间的形成(图1A)。从文献报道的病例分析看,对ARMS组织学的识别,无论是纯形式还是“混合”形式,都足以诊断ARMS。在混合肿瘤中,根据儿童肿瘤学组和组间横纹肌肉瘤研究组的研究,至少需要50%以上的ARMS组织学成分才能诊断ARMS。散发的花环样肿瘤巨细胞是ARMS的特有特征,但这并不是诊断ARMS的关键证据。
ARMS常见的融合基因包括PAX3-FOXO1或PAX7-FOXO1,它们出现在大多数(>95%)融合阳性病例(图1B)。在一些病例中,这些融合将配对PAX基因与叉头结构域基因联系起来,包括PAX3-NCOA1、PAX3 -FOXO4 、PAX3-INO80D和FOXO1-FGFR1。然而,其中一些融合形成了与PAX-FOXO1类型不同的分子种类,因此这些罕见肿瘤的性质尚不确定。
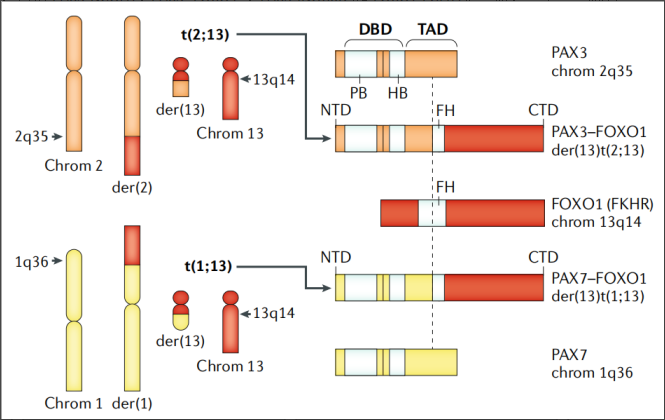
PAX-FOXO1融合基因驱动RMS的形成。
融合阳性横纹肌肉瘤(RMS)定义为位于2号染色体长(q)臂(2q35)上Giemsa带35上的PAX3(编码配对盒蛋白3)和1号染色体(1q36)上的PAX7之间的平衡易位,其中FOXO1_13号染色体(13q14)上的基因(编码叉头盒蛋白O1),产生融合蛋白。这些平衡易位产生两条衍生染色体(图左侧),其中只有一个编码PAX3或 PAX7-FOXO1融合mRNA和蛋白质(图右侧)。这些融合蛋白包含PAX3或不太常见的PAX7的氨基末端结构域(NTD)和FOXO1的羧基末端结构域(CTD)。融合蛋白的氨基末端包括来自各个PAX的DNA结合所需的基序基因,并且融合蛋白的羧基末端被认为会改变致癌转录因子的转录激活结构域(TAD)。图片源自于Skapek S X, Ferrari A, Gupta A A, et al. Rhabdomyosarcoma[J]. Nature reviews disease primers, 2019, 5(1): 1-19.
PAX-FOXO1融合阴性:ERMS
ERMS是RMS最常见的亚型,发生在年幼的儿童中,三分之一发生在 5 岁以下的儿童中。ERMS约占20岁以下RMS的50%至70%,也约占成人RMS的20%。ERMS包含不同肌生成阶段的横纹肌细胞混合物。肿瘤具有混合形态,由圆形、梭形和星状细胞簇与散在松散/粘液样基质/背景中的横纹肌细胞组成(图1C,D)。这种交替的松散和致密形态是ERMS最典型的特征之一,尽管有些主要是粘液样,而另一些主要是致密的。ERMS 的密集形式可能是大多数所谓的“融合阴性”ARMS的原因。
PAX-FOXO1融合阴性是ERMS亚型的特征,尽管已经观察到反复的基因组改变,在 ERMS 组织学或混合组织学的病例中很少见到PAX-FOXO1融合阳性。ERMS 中的基因组改变包括染色体增加(8、2、11、12、13 和/或20)和丢失(10和15),11p 染色体上的杂合性严重丧失。P53功能丧失突变发生在大约10%的ERMS 中,并且可能与间变性有关。最近一项关于横纹肌肉瘤的结果表明:在融合阴性和融合阳性的病例中,TP53突变提示不良的预后。RAS(NRAS、KRAS和HRAS)突变发生在大约50%的ERMS中;P13K效应子(PTEN,PIK3CA )的重复突变也可见。RAS同种型的突变发生在三分之一的ERMS中。NRAS突变在青少年ERMS中很常见,而HRAS和KRAS突变在70%的婴儿ERMS中可见。
ERMS葡萄样变体是一种形态学变体,见于黏膜内衬器官,好发于女性的胆总管、膀胱和阴道,通常表现为息肉状葡萄样肿块。在组织学检查中,显著的的形成层,即紧靠上皮表面的致密线性细胞区域,可作为诊断线索。然而,在某些情况下,形成层可能很窄或不存在,是一个诊断陷阱。葡萄样 RMS 患儿的预后优于其他 ERMS 患儿,尽管葡萄样 RMS 在 Horn-Enterline 分类中是一个独特的亚型,但它现在被认为是 ERMS的一个亚型,其更好的临床预后结果可能与肿瘤部位而不是组织学分型相关。
ERMS中的间变性定义为存在明显增大的深染细胞核(至少是相邻细胞核大小的3倍),伴有或不伴有大的非典型奇异多极核分裂像,并且成分占ERMS3%-13%。有学者认为,不应将儿童 RMS 的间变性与成人 RMS的多形性亚型相混淆,后者是一种完全不同的亚型。ERMS中的间变性可能是局灶性或弥漫性的(图1E),患者年龄有助于区分这两种诊断。有研究证实,ERMS中的间变性现象可能存在TP53的遗传突变。
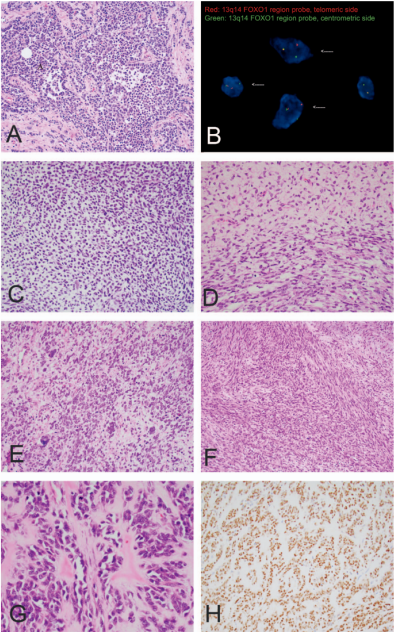
图1. 横纹肌肉瘤的形态学和遗传特征。(A)肺泡横纹肌肉瘤(ARMS)。HE染色显示圆形肿瘤细胞被纤维隔膜和肿瘤内的典型肺泡空间分隔。(B)分子遗传学改变。FISH分析显示,FOXO1涉及13q14FOXO1基因区域的重排双色分离式探头(箭头)。(C和D)胚胎性横纹肌肉瘤 (ERMS)。粘液样背景中圆形和短梭形细胞 (C) 以及圆形细胞和梭形细胞(D)的界面。(E)有间变性的ERMS。圆形和卵圆形肿瘤细胞簇与散在的间变性肿瘤细胞混合。(F)梭形细胞/硬化性横纹肌肉瘤 (SSRMS)。呈束状生长的均匀梭形肿瘤细胞。(G)硬化RMS。在硬化胶原背景中具有假血管排列的肿瘤细胞簇。(H)SSRMS。SSRMS的MyoD1突变亚型中弥漫性MyoD1阳性。
ERMS 中的遗传易感性
在一些遗传突变综合征的情况下,容易伴发ERMS,包括 Li-Fraumeni综合征、Beckwith-Wiedemann 综合征、1 型神经纤维瘤病、Noonan综合征和Costello综合征。Noonan综合征伴有RMS涉及PTPN11、SOS1、RAF1和KRAS突变,而Costello综合征伴有RMS涉及HRAS突变。神经纤维瘤病1伴RMS涉及RAS突变,DICER1 综合征伴DICER1突变引容易伴发妇科和泌尿生殖系统的ERMS。发生在遗传突变综合征中的ERMS 在形态上与散发性ERMS无法区分。
免疫组化和分类
作为RMS诊断的重要指标,肌肉标志物(如Desmin、Myogenin和 MyoD1)的免疫组化表达起着重要作用,不仅有助于诊断,而且有助于预测基因融合状态。Myogenin通常在ARMS中强烈且弥漫性表达,而其在ERMS中的表达往往不那么分散或集中(从10%到90%的肿瘤细胞染色)。另一方面,在MyoD1突变体的SSRMS中,MyoD1的阳性率比Myogenin的阳性率低。
免疫组化作为分子测试的替代品
尽管基于组织学特征的ARMS或ERMS是RMS分类的一部分,但ARMS和ERMS的预后与PAX-FOXO1融合基因状态相关。尽管强有力的科学证据表明ARMS的诊断应基于基因检测而非组织学特征,但在一些地区,基因检测没有广泛开展,这对ARMS的病理诊断提出挑战。一些免疫标志物似乎与融合基因状态相关,可以从相对方便和经济的角度预测基因融合阳性的病例。弥漫性Myogenin (>90%) 高度提示ARMS ,但与ERMS的结果有部分重叠。基因表达研究表明,一些蛋白质可能作为PAX3/7-FOXO1融合测试的替代物。在FOXO1融合阳性 RMS中,存在AP-2β、NOS1和P-cadherin的过表达;在FOXO1融合阴性RMS中,存在HMGA2和EGFR过表达。这些标志物的组合将诊断特异性提高到90%以上,并提供超过60%的诊断灵敏度。
非FOXO1融合改变的横纹肌肉瘤:SSRMS
2013年,WHO软组织和骨肿瘤分类提出将其作为RMS的特殊分类,即SSRMS。值得注意的是,最近的大量研究表明SSRMS中至少存在三种亚型,一种亚型被定义为具有VGLL2/NCOA2/CITED2重排的先天性/婴儿型 SSRMS,另一种亚型称为具有MYOD1-突变体p.Leu122Arg的SSRMS,第三种罕见亚型是骨内RMS为主,伴有EWSR1-TFCP2、FUS-TFCP2或MEISI-NCOA2重排。
SSRMS具有束状梭形细胞和/或硬化形态。梭形细胞肿瘤包含显示细长边界并形成束状或人字形生长模式(图1F),硬化性RMS表现为明显的玻璃样变和硬化,肿瘤细胞呈条索、巢状或小梁排列(图1G),有时具有“微泡”外观。在免疫组织化学上,SSRMS的特征在于Desmin和 MyoD1 的弥漫性表达,但Myogenin局灶性表达。
先天型SSRMS几乎只发生在5岁以下、通常小于3岁的儿童中,并且仅涉及软组织。形态学上,大多数肿瘤具有混合梭形细胞和硬化特征,通常形成两种不同的模式,硬化型或细胞型。SSRMS的先天性/婴儿亚型是一种低级别肿瘤,虽然可局部复发,但是良好的预后。然而,最近的一项研究表明,在一些患者中,这种肿瘤可能具有高度转化的倾向,导致局部进展和远处转移。
MyoD1突变RMS于2013年首次被描述,与MYOD1基因的体细胞激活突变有关。肿瘤发生在任何年龄(2 至 94 岁),但在成人和女性中更常见。最常见的部位包括头部和颈部(三分之一)、四肢和躯干。大多数肿瘤显示混合生长模式,但偶尔会看到纯粹的硬化模式或梭形细胞模式。在某些情况下,可以局部观察到横纹肌细胞分化。Desmin和MyoD1呈弥漫性阳性,Myogenin局灶性表达。MyoD1突变型SSRMS是一种临床预后较差的肿瘤。
骨内RMS于2018年首次被描述并发生在骨骼中,尤其是颅面骨。患者年龄介于11至86岁之间。骨内RMS具有三种相关基因融合,EWSR1-TFCP2、FUS-TFCP2和不太常见的MEIS1-NCOA2重排。肿瘤包含复杂的核型,并显示CDKN2A的持续纯合缺失。形态学上,骨内 SSRMS 在大多数情况下显示混合的梭形和上皮样细胞模式,但三分之一的病例显示纯上皮样或很少有束状模式,横纹肌细胞分化多不明显。肿瘤细胞通常表达Desimin、MyoD1和Myogenin,大多数病例还表达上皮标志物,例如AE1/AE3或EMA。与RMS的其他亚型,尤其是ARMS类似,具有TFCP2融合的RMS有可能通过淋巴扩散到区域淋巴结和通过血行扩散到远端部位(肺或其他骨骼)。这种 RMS 亚型是一种高级别肿瘤,中位生存期为8个月。在儿童中,具有SSRMS组织学的肿瘤比其他区域更常起源于睾丸旁区域。值得注意的是,在这个最大的SSRMS亚组中尚未报道特征性突变。其中许多病例显示混合的胚胎和梭形细胞组织学,因此它们可能是ERMS的一个子集。
SSRMS的组织学是异质的,诊断可能需要肿瘤中存在主要的(至少80%)梭形细胞,以将其与一些同时具有圆形和梭形肿瘤细胞的ERMS区分开来。由于SSRMS的形态学与平滑肌肉瘤和纤维肉瘤相似,因此应牢记这些鉴别诊断。Myogenin和MyoD1染色有助于将它们与平滑肌肉瘤区分开来,而Desmin、Myogenin和 MyoD1将纤维肉瘤与RMS区分开来。在某些情况下,可能需要对MYOD1突变或VGLL2/NCOA2/CITED2基因融合进行确认。
多形性横纹肌肉瘤
PRMS是一种高级多形性肿瘤,其特征是片状大的、非典型的或奇异的多边形肿瘤细胞,类似于未分化的多形性肉瘤。它几乎只发生在21至81岁的成年患者中,中位年龄约为72岁。肿瘤发生于深部软组织,可见于任何部位,但最常发生于下肢,发病机制和分子驱动改变尚不清楚。形态学上,PRMS呈弥漫性,横纹肌细胞分化不足。免疫染色显示肿瘤细胞对Desmin呈强阳性,MyoD1或Myogenin表达有限,临床预后极差。
具有RMS样分化的肿瘤
横纹肌细胞分化可见于多种肿瘤,包括上皮和间叶恶性肿瘤,如双表型鼻窦肉瘤、癌肉瘤、Wilms瘤、胸膜肺母细胞瘤、Sertoli-Leydig细胞瘤、恶性周围神经鞘瘤、去分化软骨肉瘤、去分化脂肪肉瘤和外间质瘤。这些病变中的横纹肌细胞分化有时会导致与RMS混淆,尤其是在活检标本中。
总结
最近的分子遗传学数据提供了与RMS的病因和发病机制相关的大量信息,并将其纳入标准测试为RMS 建立了新的诊断标准(表一)。除了在诊断中的重要作用外,基因检测对于RMS患者的预后也变得至关重要。PAX-FOXO1融合基因广泛用于RMS的病理分类,并纳入标准风险分层。当分子检测不可用时,替代免疫组织化学标记物可能是确定融合基因状态的有用指标,但缺乏相关指南标准。融合阴性ARMS现在在分子生物学、临床表现、结果和预后方面与ERMS相关。在常规情况下,常规HE评估和Desmin、MyoD1和Myogenin表达模式足以确认RMS的诊断并确定组织学亚型,尽管所有ARMS(尤其是实体变体)都应进行PAX融合测试以证实诊断。SSRMS的新亚分类包括临床和生物学异质性病变,并且在与基因检测相结合时似乎在临床上更有用(图2)。分子改变的知识将导致更好地接近RMS的发病状态和恶性潜能的诊断,并且分子检测被指示为这些肿瘤的常规实践。
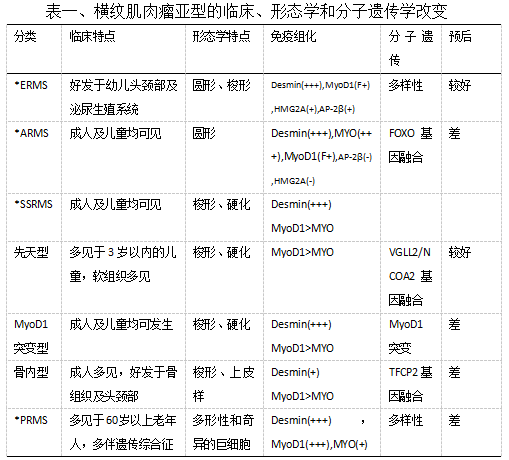
图2、横纹肌肉瘤诊断思路



















共0条评论