[导读] 编译整理:强子
HHV8相关MCD的病理机制
关于多发性Castleman病(multicentric Castleman disease,MCD)的机制猜测比比皆是,如自身免疫性、感染性、反应性、克隆性等。尽管仍有争议,但关于这一病种发生机制的较新概念是:淋巴结和系统性表现都是对IL-6升高、较小程度上是对细胞因子及趋化因子风暴中其他循环因子的反应性表现。
根据有无HHV8,MCD可进一步分为HHV8相关MCD、HHV8阴性的特发性MCD(idiopathic MCD,iMCD)。细胞因子风暴在iMCD中的潜在机制仍处于假说阶段,但在HHV8相关MCD中具有明确致病性是不容置疑的。这类患者中,免疫抑制导致HHV8逃过了宿主免疫控制。裂解复制的增加,触发了抗病毒信号级联,从而导致人IL-6(human IL-6,hIL-6)和其他细胞因子(如IL-10、TNF-α、IL-1)大量产生。
需要注意的是,已知HHV8基因组可编码多种与人体细胞增殖、存活及免疫反应相关调节蛋白的类似物,尤其是vIL-6,被认为是HHV8相关MCD的关键致病因素,循环中的vIL-6水平与病变活动情况有关。尽管vIL-6与人体产生的IL-6(hIL-6)只有25%的序列相同、且信号效力更低,但却可以以相同方式激活所有已知的hIL-6诱导的信号通路。此外,vIL-6可对多种类型细胞起作用。
vIL-6和hIL-6在MCD中具有多种作用:刺激B细胞和浆母细胞增殖,激活血管生成,介导系统性炎症症状;这些机制相应导致特征性病理改变及临床表现。其中最重要的是hIL-6,具有强力趋化活性,吸引浆母细胞在小血管周围成簇分布,形成一个更有利于交叉感染、细胞之间旁分泌通路的环境。这一过程使得浆母细胞增多、大量病毒复制、细胞裂解,最终产生大量细胞因子、增强病毒在细胞与细胞之间的传输及细胞增殖。这一恶性循环的最终结果就是hIL-6和vIL-6在局部及全身指数级增加。
细胞水平上,hIL-6和vIL-6与受体结合导致相应信号通路活化。二者都是两个感染源(浆母细胞和淋巴血管内皮细胞)扩展中的重要因素。细胞因子对局部靶细胞群的影响,是维持淋巴细胞增殖、进而增加免疫球蛋白的产生。这些效果也表现为内皮细胞活化、EGFR产生,导致新生血管形成。此外,HHV8的裂解复制导致内皮细胞破坏、形成透明样瘢痕及一过性淋巴结肿胀。
系统的层面来说,hIL-6和vIL-6均有强效促炎作用;疾病发作的时候,释放入循环、与其他细胞因子协同作用,导致全身炎性反应综合征。此外,这些细胞因子可以降低宿主对共感染(如HIV、EBV)的免疫反应。HHV8和共感染的微生物相互协同、促进并增强致病活性。这种协同作用不仅促进HHV8相关MCD的进展,也促进协同感染相关的病变发生。因此,HHV8相关MCD的发生及严重程度受宿主因素、以及同时存在的病毒感染的显著影响。
对HHV8相关MCD致病机制的理解,在新型治疗方案方面尤其有用。针对关键细胞因子通路的靶向治疗已证实在减轻系统性表现方面是有效的,具体如针对IL-6/IL-6受体的抗体、IL-1R拮抗剂。针对感染细胞(淋巴细胞及内皮细胞)的治疗也是一种新型方案。比如抗CD20及抗CD19的治疗可以完全破坏HHV8感染的淋巴细胞,已证实可以改善HHV8相关MCD患者的预后。针对淋巴细胞和内皮细胞的多维方案还未转化为临床应用,但临床前结果令人鼓舞,不久的将来有望成功实施。
HHV8相关MCD的病理特征及临床表现
HHV8阳性MCD单独区分出来,因为其病因是病毒感染、临床病程不一、很可能发生HHV8阳性淋巴瘤。
MCD患者一般表现为系统性证实,常较严重、且如不恰当治疗则可危及生命。HHV8相关MCD的临床表现主要为三种情况:第一种、也是最重要的,常表现为系统性炎性反应的间断性加剧,具体包括全身症状、脏器肿大、血细胞减少、多器官功能障碍、急性期蛋白水平升高、高丙种球蛋白血症、白蛋白降低。高达50%的HHV8相关MCD患者可发生嗜血细胞综合征。第二种,低蛋白血症可导致显著的体液潴留,表现为水肿、腹水、胸腔或心包腔积液、惊厥。第三种,患者可出现并发症或合并症的相关症状,具体如HIV(82%的患者)、其他感染、Kaposi肉瘤(48%的患者)、淋巴瘤、副肿瘤性天疱疮。
需要注意的是,上述症状无一是MCD所特有的,都和其他病变之间有所重叠,具体如病毒感染、风湿性疾病、血管病变、恶性肿瘤。淋巴结活检对于MCD非常关键,但HHV8相关MCD中可见的炎性症状及相关实验室检查结果均可见于某些并无显著淋巴结病变的患者(称之为KSHV炎性细胞因子综合征【KSHV inflammatory cytokine syndrome,KICS】);相关结果也可见于开始抗逆转录治疗的患者、是其免疫重建的一部分(称之为KSHV-IRIS)。
淋巴结活检是确诊MCD的最重要一环,因为虽然MCD也有结外受累,但目前MCD的病理诊断标准时根据淋巴结组织学表现做出的。HHV8相关MCD累及的淋巴结表现为滤泡的退行性改变、血管增多。淋巴结的结构一般相对保持,滤泡大小不一,有小静脉穿入。滤泡间区的特征为血管增生、显著浆细胞浸润。这一类型MCD的一个独特、且不变的特征是有HHV8感染的“浆母细胞”,主要位于套区,但也可随机散在于滤泡间区。部分病例中,这类浆母细胞形成较大簇状,此前曾形容为微小淋巴瘤(microlymphoma),可累及或取代生发中心。这些细胞的特点为中等至较大,细胞核空泡状,有一个或多个核仁,染色质嗜双色性。与正常浆细胞前体细胞相似,这类细胞均一表达MUM1,程度不等的表达CD20和CD79a,不表达PAX5、BCL6和CD138,EBV阴性。浆母细胞仅表达IgM和λ轻链,但DNA水平的免疫球蛋白基因检查为多克隆或寡克隆(oligoclonal)。
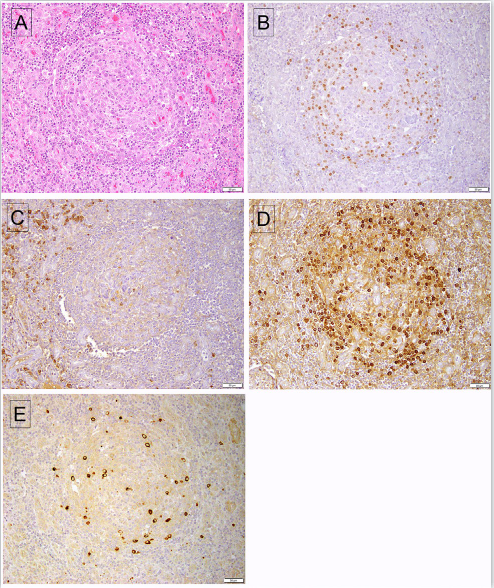
图2. HHV8相关MCD累及淋巴结。(A)滤泡套区萎缩,滤泡间区血管增多非常显著。(B)LANA-1免疫组化,阳性细胞主要位于受累滤泡的周边。(C)κ轻链免疫组化,滤泡间的浆细胞为阳性,而HHV8感染的浆细胞为λ轻链阳性(D)。(E)HHV8阳性细胞也表达vIL-6。
HHV8是通过对宿主细胞进行重新编程(reprogramming)而改变免疫球蛋白多样性的病原体的典型例子。HHV8感染局限于表达IgM-λ轻链的B细胞,是MCD中早已明确的特征;不过,对其潜在机制的了解仍不完全。目前认为是病毒操控了人体信号通路所致。浆母细胞似乎来源于生发中心前静息B细胞(pre-GC naïve B cells),因为这些细胞并无免疫球蛋白基因的体细胞性重排。也有人提出,HHV8病毒潜伏产物可能可以在无生发中心反应的情况下将IgM阳性静息B细胞转化为浆母细胞,可能是通过介导生发中心反应中正常情况下信号事件所致。因此,感染的浆母细胞并无类别转换重组(class switching recombination),仍为IgM阳性。此外,HHV8编码的蛋白(如vFLIP)可作为NF-κB活化因子,而NF-κB信号通路是产生λ轻链表达B细胞的关键(正常B细胞发育中κ基因重排未成功所致)。因此,HHV8可能通过在最初表达κ的细胞中诱导人体NF-κB转录活性而重新诱导免疫球蛋白重排。
未完待续
往期回顾
多中心Castleman病的前世今生(一)














共0条评论