[导读] 编译整理:强子
术业有专攻,尤其医学的专科,可能很多问题不是普通字面意义那么简单。比如,“多中心Castleman病”,并非仅仅是文字意义上的“多个病灶”。美国国立卫生研究院血液病理专家Zhou Ting等人在《Pathologica》杂志发表综述,对多中心Castleman病进行了详尽介绍。为帮助大家更好的了解相关知识并指导临床实践,我们将该文要点编译介绍如下。
多中心Castleman病概念的提出
Castleman病这个名词,最初是在麻省总医院的定期临床病理会议上讨论一个病例时提出的,1954年得以发表。当然,这一病例就是现在认为的单中心Castleman病。后来发现,单中心Castleman病有两种组织学及临床亚型:一种是滤泡有显著纤维化、退行性变,且血管增多,即透明血管型;另一种则是浆细胞增多,更常见伴有系统性症状,即浆细胞型。不过,这两种情况都表现为局灶肿物性病灶。
1980年,与Juan Rosai一起工作的Glauco Frizzera在USCAP会议、也就是现在的美加病理学会年会上发表了一篇文章,描述了10例组织学特征类似单中心Castleman病的多中心性淋巴结病变。1983年,他们描述了一例形态学特征为Castleman病的系统性淋巴组织增生性病变,再次扩展了我们对该类病变的视野。他们报道的病例主要是淋巴结,后续他们还报道了4例该类病变的脾脏组织学所见,且这15个病例中大部分都有脾脏肿大。
该组病例所有患者都有全身性症状,如发热、盗汗、体重减轻、全身淋巴结肿大。两例患者具有Kaposi肉瘤,为理解其病理机制提供了重要线索。其他临床特征还有贫血、血小板减少、多克隆高丙种球蛋白血症。
该组病例临床进展情况不一,4例患者在5-14个月内死亡,其他患者为长期、惰性经过,既有缓解、也有恶化。在文章发表时,随访39-156个月的时间段内,有6例仍存活。死亡患者的死因为多因素,5例死于脓毒血症,1例发生了淋巴瘤。
根据目前的研究,上述报道的病例中,可能有很多是人疱疹病毒8型(Human Herpesvirus 8,HHV8;也称为Kaposi肉瘤相关疱疹病毒【Kaposi sarcoma-associated herpesvirus,KSHV】)相关型多中心Castleman病;而病程更长、慢性表现的其他病例则可能是特发性多中心性Castleman病。
Rosai等人也注意到了多中心Castleman病和“胶原性血管病变(collagen vascular diseases)”的相似性,并根据当时所知提出这类似血管免疫母细胞性淋巴结病(angioimmunoblastic lymphadenopathy,AIL)和T细胞淋巴瘤之间的相似性。他们的标志性文章,帮助奠定了1984年在有Kaposi肉瘤的多中心Castleman病患者中发现KSHV/HHV8的基础,而这是多中心Castleman病概念中涉及多种临床及病理特征的重要一步。总之,多中心Castleman病并非一个单一病变,它与血管增生、浆细胞增多、免疫功能缺陷之间重叠的特征,可能与它们病理机制方面的相似性有关。
KSHV相关MCD之HHV8:多种血液系统疾病的病原体
如前所述,HHV8又称为KSHV,最初是在1984年由Chang等人从Kaposi肉瘤中分离出来的。后来,确定这一因素和多中心Castleman病的发生有因果关系。不受控制的HHV8感染,导致了约半数的多中心Castleman病,在HIV相关的Castleman病中则总是存在。HHV8也是原发渗出性淋巴瘤(primary effusion lymphoma,PEL)的致病因素。
潜伏性HHV8感染极为常见:HHV8血清阳性率6%至50%不等,和地域因素及人种有关。不过,大部分病例中的HHV8为休眠状态,仅少部分感染的个体在数年后甚至几十年后发生HHV8相关多中心Castleman病和其他疾病,这表明HHV在这类疾病的发生中是辅助因素。就这方面来说,免疫缺陷是发生HHV8相关病变的主要危险因素,而HIV感染是最常见的潜在免疫受损状态。
与疱疹病毒家族其他成员一样,HHV8在宿主是终生感染的。由于其基因组较大、较复杂,因此这一病毒可通过巧妙的免疫逃逸而维持慢性感染,且常通过低拷贝数而在潜伏(latent)和裂解性复制(lytic replication)之间转换。淋巴细胞和内皮细胞是HHV8的主要隐伏病毒库(latent reservoirs);不过,HHV8也可感染并持续存在于其他类型细胞,如单核细胞、树状突细胞、上皮细胞。
潜伏期,HHV8基因组的大部分通过多种表观修饰而保持静默;这时候的转录局限于少数潜伏相关核抗原-1(latency-associated nuclear antigen-1,LANA-1),这也是所有HHV-8感染之中总是可以检出、表达量最丰富的蛋白。病毒抗原的限制性表达,有助于其避免被宿主免疫系统识别、从而可以长期持续存在。因此,人体免疫系统可以抑制感染、但却决不能清除这一病原体。适当的条件下,潜伏的被感染细胞可被诱导、进入裂解期。已明确可激活HHV8裂解复制的部分因素有:免疫抑制、同时有其他病原体的感染、细胞应激、缺氧、炎症。裂解期的特点是高度有序的基因级联(cascade of genes)表达,确保病毒高效复制。
需要注意的是,HHV8基因的表达并非总是遵循潜伏或裂解-复制的程式,某些一般在裂解期表达的病毒基因可被宿主的转录机制活化、而并非全面裂解激活。比如,HHV8编码的病毒性IL-6(viral IL-6,vIL-6)可被B细胞谱系高表达的转录因子X-box结合蛋白-1(X-box binding protein-1,XBP-1)诱导表达。这种附加的调节导致了HHV8相关的不同病变中病毒基因表达谱具有异质性。比如,Kaposi肉瘤中大部分瘤细胞为潜伏感染,而小部分细胞表达裂解蛋白。原发渗出性淋巴瘤中,表达裂解蛋白的细胞比例较高,而多发性Castleman病中裂解复制的比例最高(高达25%)。可想而知,病毒基因表达谱的异质性和HHV-8相关疾病宽泛的临床病理谱系有关,比如从亚临床到进展性疾病,从局灶性到系统性疾病,从反应性增生或良性瘢痕到显著恶性病变。
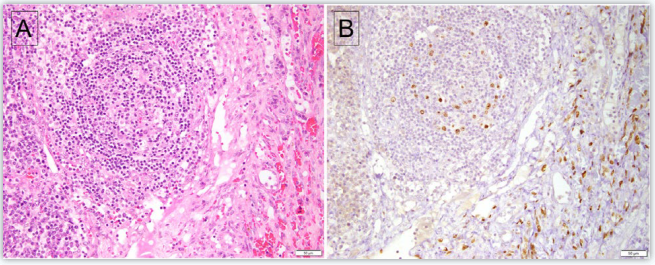
图1. 多中心Castleman病和Kaposi肉瘤同时累及的淋巴结。(A)该处滤泡呈退缩改变,同时周边有梭形细胞增生、伴血管外红细胞。(B)LANA-1免疫组化,滤泡内的淋巴细胞和Kaposi肉瘤的梭形细胞均为阳性;但是Kaposi肉瘤中的梭形细胞并不表达vIL-6(未示)。
未完待续
参考文献
Zhou T, Wang HW, Pittaluga S, Jaffe ES. Multicentric Castleman disease and the evolution of the concept. Pathologica. 2021;113(5):339-353.
doi:10.32074/1591-951X-351














共0条评论