[导读] 编译整理:强子
妇科癌的常用免疫组化详解(一)
妇科癌的常用免疫组化详解(二)
子宫内膜癌
2020年版世界卫生组织分类著作中,传统的组织形态学仍是子宫内膜癌分类的基础,且也是患者临床治疗的主要参考依据。不过,潜在分子遗传学改变的重要意义、其对临床病理学的影响,都越来越受到更多重视。癌症基因组图谱(Cancer Genome Atlas,TCGA)整合相关遗传学特征后,确定了子宫内膜癌的四种独特分子分组:(1)POLE突变型(超突变);(2)微卫星高度不稳定型(高突变);(3)拷贝数低型;(4)拷贝数高型。这四种分子分型,对应的无进展生存率具有显著不同:POLE突变的肿瘤预后较好,拷贝数高(TP53突变)的肿瘤预后差,高突变和拷贝数低的肿瘤临床预后居中。后续研究提出并证实了用免疫组化标记错配修复(mismatch repair,MMR)蛋白及p53来做诊断、POLE突变分析整合入临床实践的相关问题。子宫内膜癌错配修复检测已成为大部分实验室进行Lynch综合征筛查的常规操作,p53免疫组化也已常用于形态学分类的辅助。不过,POLE突变分析还未得到广泛应用。
1. 低级别子宫内膜癌鉴别诊断中的免疫组化
低级别(FIGO分级1级、2级)子宫内膜样腺癌的诊断解读中,大部分病例依靠详尽的形态学评估即可,只有少数特殊临床病理情况下才需结合免疫组化检查。如前所述,低级别子宫内膜样腺癌的某些形态学特征可能和普通型子宫颈腺癌有重叠,需要进一步加做检查。
另一种在预后和治疗方面具有显著差异、需要注意和低级别子宫内膜样腺癌鉴别诊断的病种是子宫内膜的浆液性癌:这两种病变之间可有共同的结构特征,如开放的腺管状、绒毛腺样、乳头状;但“低级别”的结构特点、却有显著的细胞学异型性(如细胞核增大、核浆比高、较大的核仁),且核分裂多见并有非典型核分裂,应考虑到浆液性癌的可能。这种情况下,免疫组化p53和p16非常有帮助。子宫内膜浆液性癌绝大部分具有TP53突变,且已发现免疫组化p53是这种情况下的可靠标记物。无TP53突变的肿瘤中,p53免疫组化呈野生型着色,即弱至中等程度的细胞核不均一着色、且有p53阴性细胞;背景中的间质细胞和淋巴细胞可作为阳性内对照。最常见的p53异常着色为弥漫强阳性,其次为着色完全缺失,最近还报道了一种罕见的着色模式,即胞质着色、一般伴细胞核不同程度着色。需要注意的是,TP53剪接位点突变或截短突变的罕见肿瘤免疫组化p53也可呈野生型着色,这是由于存在无功能性p53蛋白所致。低级别子宫内膜样腺癌中,TP53突变及相应的免疫组化p53异常着色极为罕见,如果存在这一情况,一般为亚克隆分布,表明这是在高突变(MMR缺陷型)或超突变(POLE突变)肿瘤的克隆性进化中出现了继发性突变事件。对于免疫组化p53着色结果不能确定、或者形态学和免疫组化p53结果不一致的病例,p16可能也会有帮助:浆液性癌中,大部分为p16弥漫、强阳性表达,而子宫内膜样癌中一般为中等程度的、斑片状(马赛克样)着色。
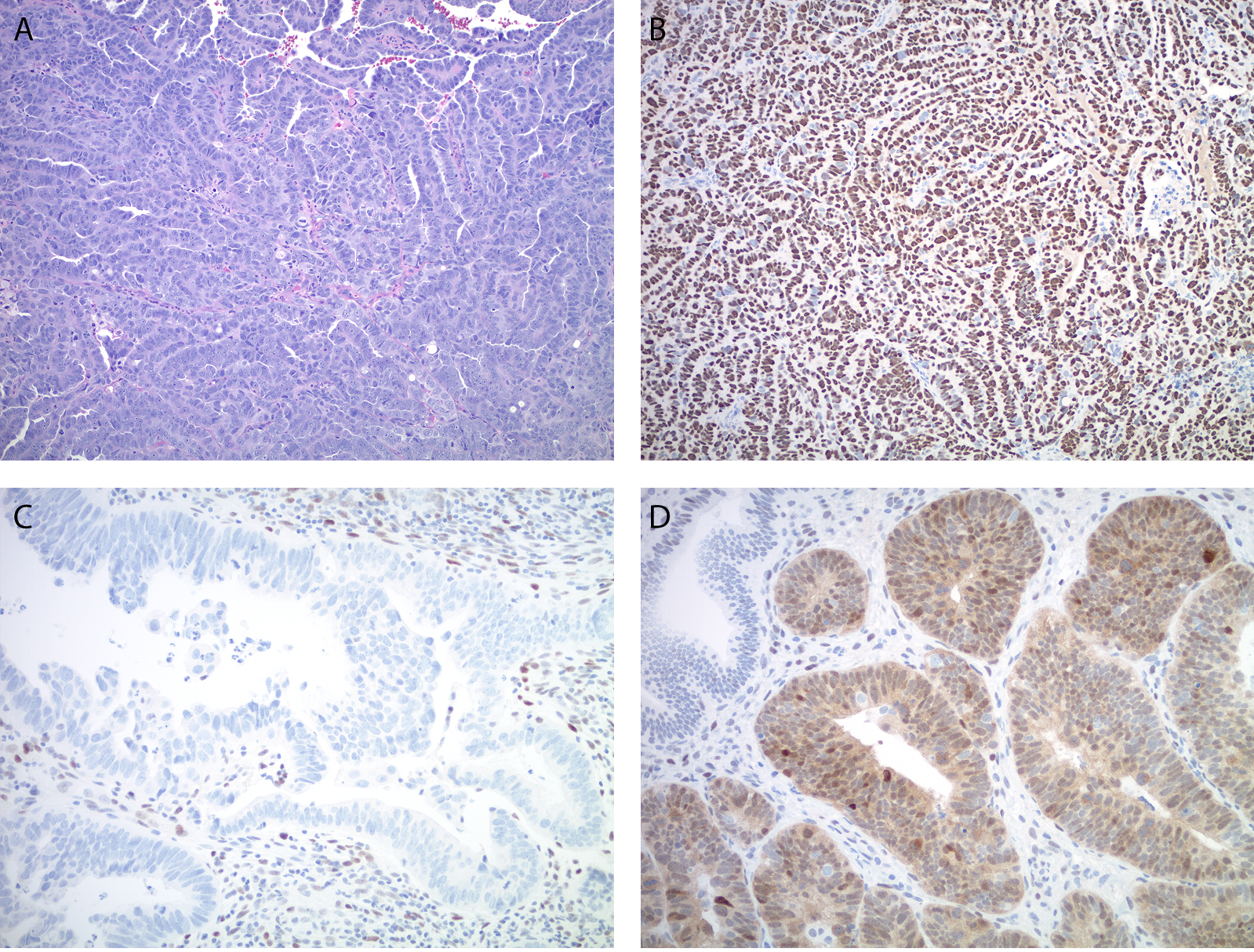
图1. 子宫内膜浆液性癌(A),瘤细胞免疫组化p53一般呈下述方式之一的异常表达:(B)弥漫强阳性;(C)完全缺失;(D)弥漫性胞质着色、伴细胞核程度不等的着色。
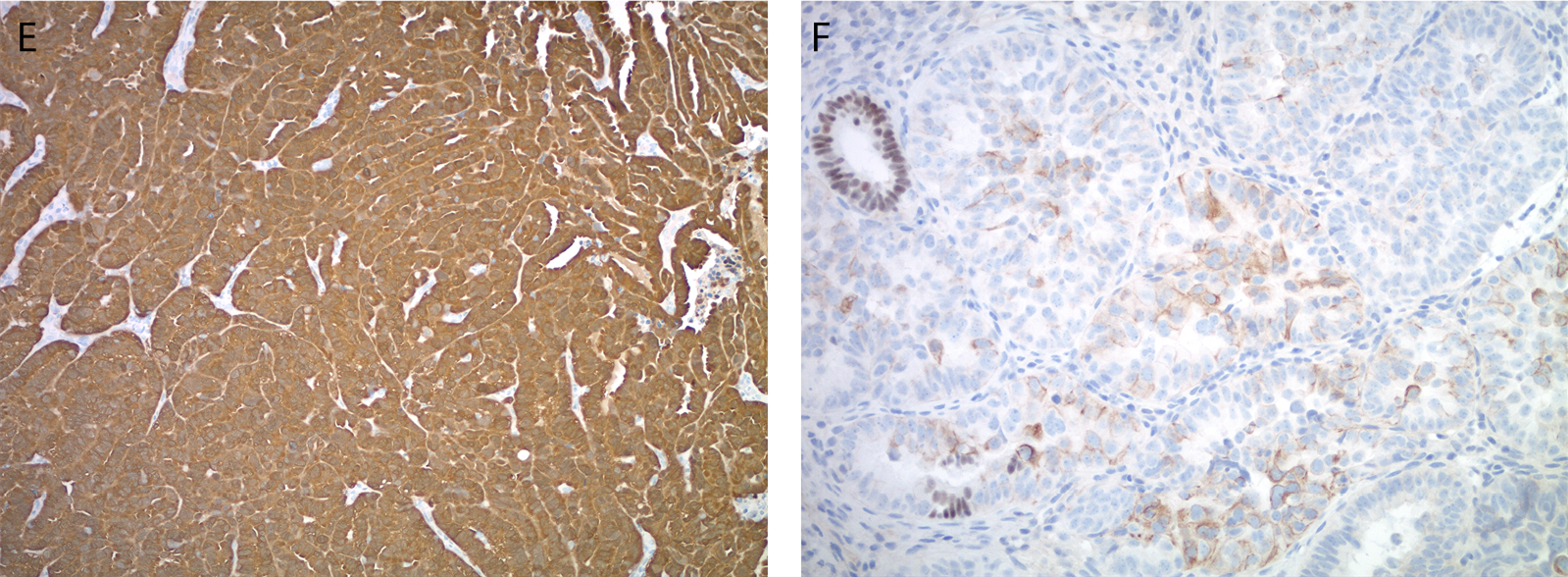
图2. 子宫内膜浆液性癌免疫组化p16弥漫强阳性(左),瘤细胞细胞核不表达HNF-1β(右)。需要注意的是,HNF-1β免疫组化中,图中左上角陷入的良性子宫内膜腺体可作为内对照。
2. 高级别子宫内膜癌鉴别诊断中的免疫组化
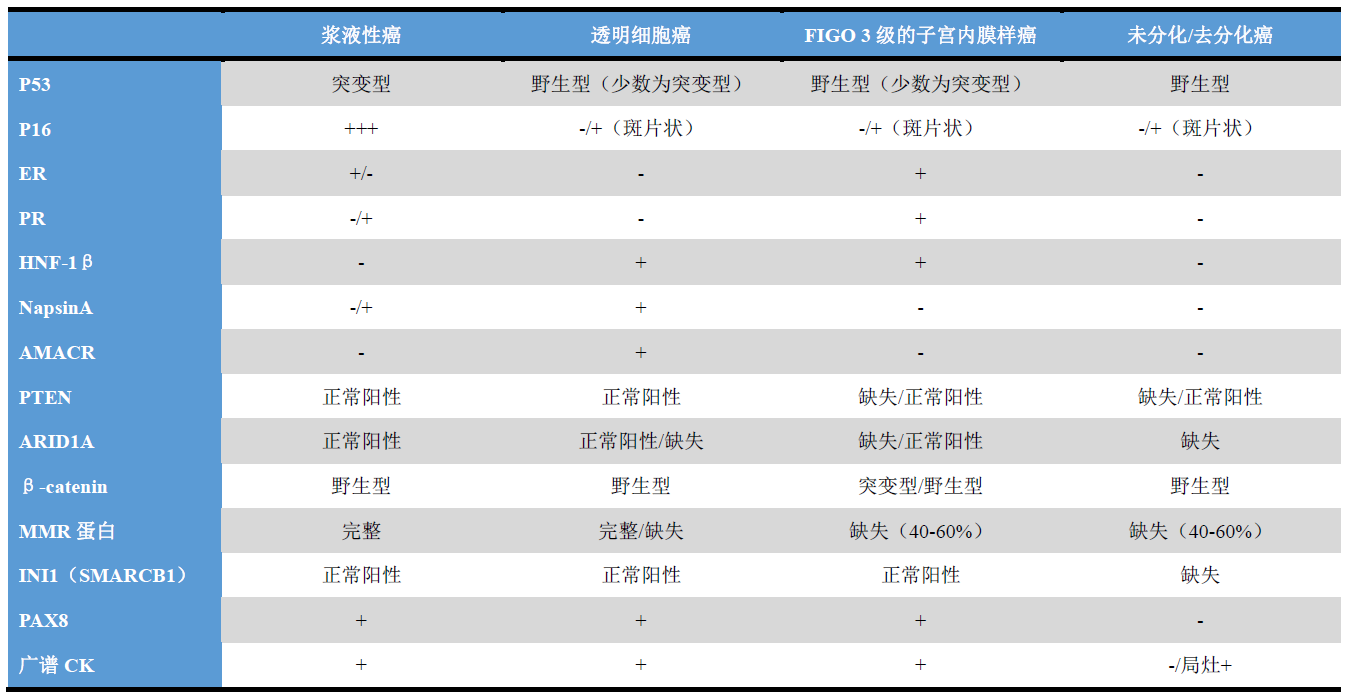
高级别的子宫内膜癌在形态学和免疫表型方面存在显著重叠,具体如FIGO分级3级的子宫内膜样癌、浆液性癌、透明细胞癌、未分化/去分化癌、癌肉瘤,即使在妇科亚专科的病理医师之间也存在显著的观察者间变异。不过,形态学不明确的病例中,免疫组化检测一般也有帮助、且是组织学分类所必需。
子宫内膜FIGO分级3级的子宫内膜样癌是一组具有遗传学异质性的肿瘤,其在前述TCGA分子分组中的分布情况如下:约18%为TP53突变,10%具有POLE突变,40-60%为错配修复缺陷,3-6%具有多种分子异常,其余归为“无特殊分子特征”(no specific molecular profile,NSMP)。
相比较而言,几乎所有的子宫内膜浆液性癌都具有TP53突变、免疫组化p53异常表达,而错配修复缺陷者少见,据报道仅占约10%。浆液性癌的p16表达一般为弥漫强阳性,而大部分子宫内膜样癌(包括高级别肿瘤)仅为斑片状、弱阳性表达。ER和PR也可有一定帮助,这两项指标在子宫内膜样癌中要比浆液性癌中的阳性率高。β-catenin呈异常的细胞核阳性表达、PTEN或ARID1A表达缺失,均支持子宫内膜样癌。
子宫内膜的透明细胞癌大部分为p53野生型表达,同时HNF-1β、NapsinA、AMACR阳性,而ER、PR一般为阴性。不过,其免疫表型可能和浆液性癌、高级别子宫内膜样癌之间有重叠,所以一定要结合形态学评估来解读免疫组化结果。至少约三分之一的透明细胞癌中可见p53免疫组化的异常表达,错配修复缺陷的比例不一。HNF-1β是透明细胞癌诊断极为敏感的标记,但却缺乏特异性,因为该标记也常表达于子宫内膜样癌、甚至非肿瘤性子宫内膜。一项实用的建议,是先根据形态学特征缩小鉴别诊断范围至透明细胞癌和浆液性癌、子宫内膜样癌这两种组织学类型之间的鉴别,再加做免疫组化:和浆液性癌的鉴别,加做p53、p16、HNF-1β、ER、PR、MMR标记,而和子宫内膜样癌的鉴别,则加做ER、PR、NapsinA、AMACR。
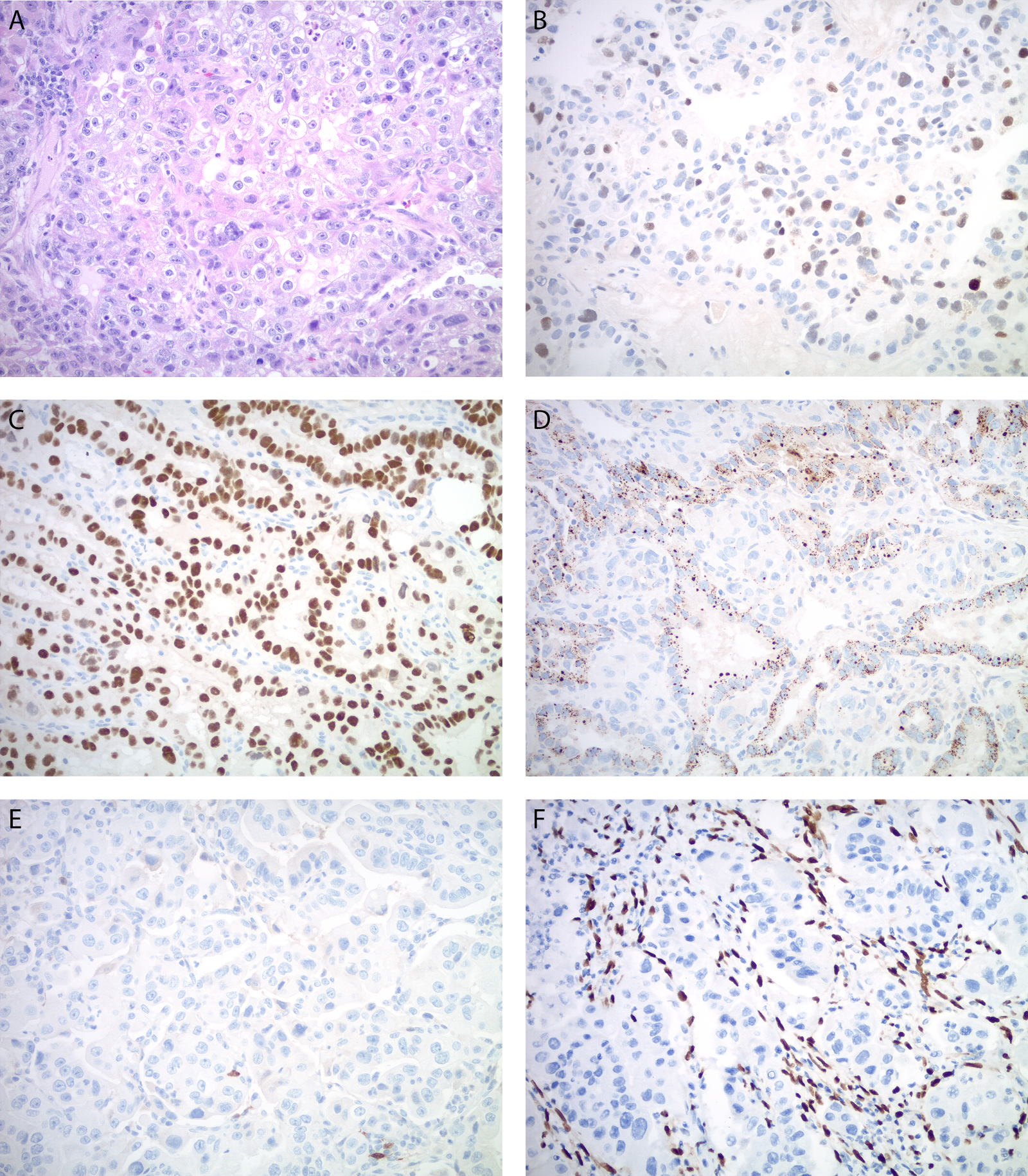
图3. 子宫内膜透明细胞癌(A),免疫组化p53为野生型表达(B),HNF-1β为弥漫阳性(C)且NapsinA呈胞质颗粒状着色的阳性(D),ER(E)、PR(F)为阴性。
子宫内膜未分化癌的特点,是形态相对均一、失黏附的细胞形成实性片状而无腺性结构。去分化癌中一般存在第二种肿瘤成分,多为FIGO分级1级或2级的子宫内膜样癌。子宫内膜未分化癌/去分化癌中常有上皮标记的表达缺失,支持为上皮起源的EMA或CK8/18仅局灶阳性。PAX8、E-cadherin、ER、PR一般为阴性或仅局灶阳性,该组肿瘤约半数为错配修复缺陷,大部分是由于MLH1启动子超甲基化所致。常见SWI/SNF染色质重塑复合体失活突变,导致SMARCA4(BRG1)、SMARCB1(INI1)或ARID1A表达缺失。不足10%的肿瘤可见神经内分泌标记(CgA、Syn)局灶着色。
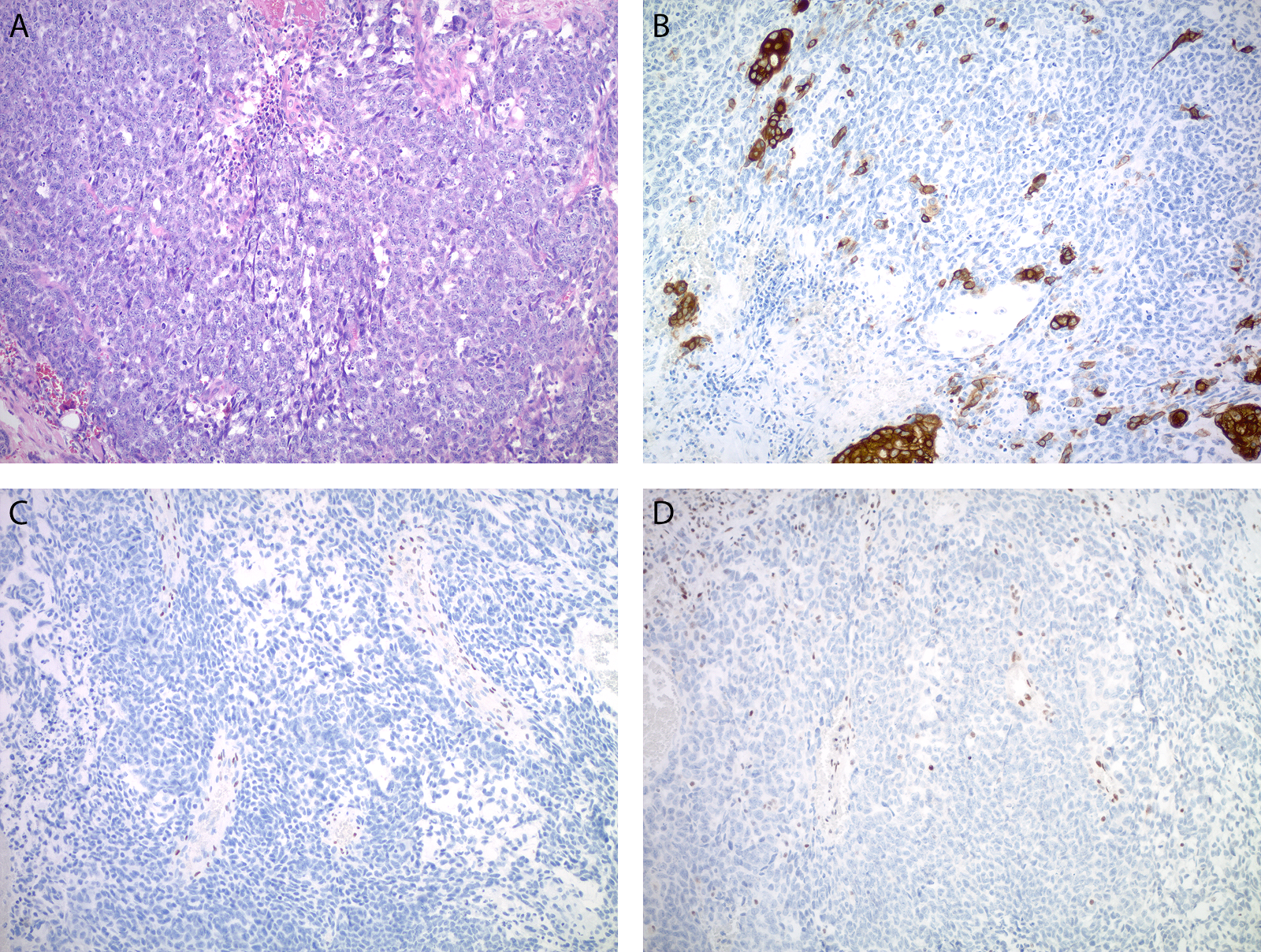
图4. 子宫内膜去分化癌中的未分化癌成分,瘤细胞形成大片实性结构(A),免疫组化AE1/AE3几乎完全缺失(B),ER阴性(C),错配修复蛋白中的MLH1表达缺失(D)、PMS2表达缺失(未示)。
表2. 高级别子宫内膜癌鉴别诊断免疫组化概述
3. 2020年版世界卫生组织分类中引入的子宫内膜癌新类型
最近阐明的子宫内膜癌组织学类型有中肾管样腺癌、胃型(胃肠型)黏液腺癌。这两种类型在形态学和免疫组化特点方面,都和子宫颈对应的肿瘤有相似性。
子宫内膜的中肾管样腺癌罕见,在子宫内膜癌中的比例不足1%,但有限的病例研究表明其临床病程极具侵袭性。瘤细胞一般表达GATA3、TTF1。CD10呈管腔着色模式,p53表达呈野生型,部分肿瘤表达calretinin,而ER、PR、HNF-1β、NapsinA一般为阴性。
子宫内膜胃型(胃肠型)黏液腺癌目前仅有十余例报道。与常见的伴黏液分化低级别子宫内膜样癌不同的是,大部分胃型腺癌生物学行为更具侵袭性,可远处转移且死亡率高。该肿瘤的诊断常需免疫组化,且以此鉴别子宫内膜癌更为常见的组织学类型,不过免疫表型方面有部分重叠。子宫内膜胃型腺癌一般表达MUC6、CK7、PAX8、CEA,CK20和CDX2也可呈阳性,而ER和NapsinA一般为阴性。P53可呈异常表达,有一例报道p16呈团块状阳性表达,是由于RB1的无义突变所致。MUC6在该肿瘤的诊断中相对敏感,但并无特异性,因为有报道称88%的子宫内膜样癌会有至少局灶的MUC6表达。此外,少部分子宫内膜样癌中也可见CK20、CDX2、SATB2的表达。
未完待续
参考文献
Buza N. Immunohistochemistry in gynecologic carcinomas: Practical update with diagnostic and clinical considerations based on the 2020 WHO classification of tumors. Semin Diagn Pathol. 2022;39(1):58-77.
doi:10.1053/j.semdp.2021.10.006


















共0条评论