BRAFV600E突变肿瘤的临床病理学特征:从一个具有两种疾病形态的病例说起(1)
【前 言】
非典型畸胎样/横纹肌样肿瘤(Atypical teratoid/rhabdoid tumor,AT/RT)是一种高度恶性的中枢神经系统肿瘤,超过90%的AT/RT发生在5岁以下儿童,主要发生于婴幼儿。横纹肌样细胞的存在以及SMARCB1基因的双等位基因突变导致SMARCB1/INI1蛋白表达缺失是该疾病的特征表现。然而,在表观遗传学水平上,AT/RT是一种异质性疾病,由3个不同的分子亚群组成,即SHH、TYR和MYC。大多数AT/RT是原发性的,但罕见的继发性AT/RT已有报道。最常见的前体病变包括多形性黄色星形细胞瘤(pleomorphic xanthoastrocytoma,PXA)和神经节胶质瘤(ganglioglioma)。所有这些病例中都存在SMARCB1/INI1表达的非横纹肌样成分,遗传分析显示BRAF V600E突变。在此,Thomas等作者于2021年在《Am J Surg Pathol》杂志报道了3名年龄较大的儿童SMARCB1缺陷性肿瘤,其组织病理学特征为AT/RT,但也具有PXA的遗传学和表观遗传学特征。
【结 果】
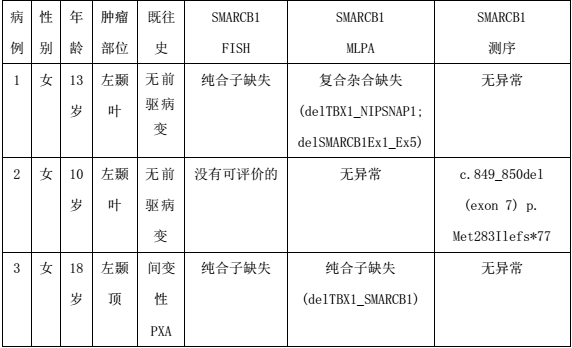
3例患者临床病理资料见表1:
【病理学检查】
所有肿瘤均由致密的横纹肌样细胞组成,瘤细胞核偏位、核仁明显,胞质嗜酸性(图1A-C)。肿瘤表现出明显的恶性迹象,包括活跃核分裂象(4~6个/10HPF)和地图样坏死。1例(病例1)周围脑组织可见弥漫性肿瘤细胞浸润,另1例(病例3)周围脑组织边界清晰。1例肿瘤(病例2)有明显的淋巴细胞浸润。多形性星形细胞瘤的组织学特征包括嗜酸性颗粒状小体、致密网状纤维结构、均未无脑膜累及。免疫组化显示所有肿瘤细胞核SMARCB1/INI1蛋白表达缺失(阳性对照细胞为血管内皮细胞和淋巴细胞)(图1D-F)。1例(病例3)EMA为膜强阳性表达,而在其他病例中EMA呈斑片状或阴性表达(图1G-I)。所有病例均有少量散在的肿瘤细胞表达细胞角蛋白(MNF116)。所有病例肿瘤细胞GFAP染色均为阴性(图1J-L)。肿瘤细胞神经元标记物(Syn和NF)和SMA也为阴性表达。Ki-67/MIB-1增殖指数较高(15%、25%和60%)。
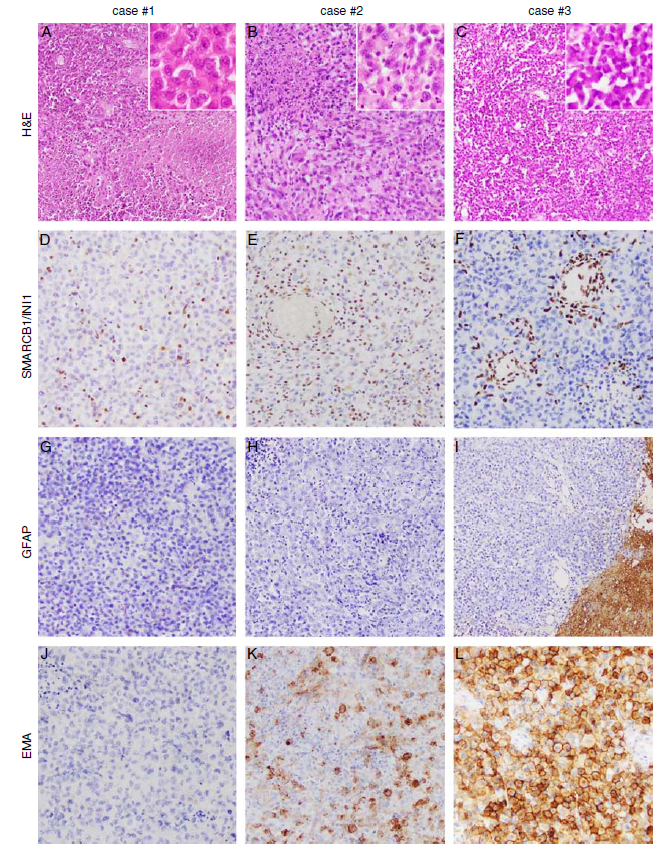
图1所示组织病理学:HE染色显示,3个肿瘤(A-C)完全由密集的横纹肌样细胞(插图)组成,并显示明显的恶性迹象,包括活跃的核分裂象和地图样坏死。肿瘤细胞细胞核中SMARCB1/INI1表达缺失(D-F),而SMARCB1/INI1在非肿瘤细胞细胞核中保留(内对照阳性)。所有病例肿瘤GFAP染色均为阴性(G-I);注意病例3 (I)相邻脑组织GFAP阳性。病例3 (L)见EMA膜强阳性,而其他病例EMA染色呈斑片状(K)或阴性(J)。
【讨 论】
我们的数据表明,需要考虑具有PXA分子特征的AT/RT,特别是在年龄较大的儿童AT/RT。这类肿瘤尚未被描述,很可能是因为根据目前世界卫生组织的标准,恶性中枢神经系统肿瘤中SMARCB1/INI1蛋白丢失的证明足以诊断AT/ RT,因此没有常规进行详细的分子谱研究。虽然来自我们系列肿瘤的DNA甲基化谱无法使用海德堡脑肿瘤分类器(Heidelberg Brain Tumor Classifier)的当前版本(11b4)进行分类,它们在t-SNE分析和无监督层次聚类上通过PXA明确分组。这种差异可能反映了当前发布的随机森林分类器的局限性,但也突出了补充t-SNE分析在诊断设置中的价值。
癌症DNA甲基化特征被认为是躯体获得的DNA甲基化变化和反映细胞起源的强烈特征的结合。因此,我们有理由假设,我们的系列肿瘤与PXA共享一个共同的前体细胞,并最终获得横纹肌样表型,这可能成为主导,因为SMARCB1失活赋予了选择优势。我们发现所有病例中都存在BRAF V600E突变和纯合子CNDKN2A/B缺失,进一步支持了这一假设,这两种突变在PXA中都是常见的遗传病变,但在原发性AT/RT中没有遇到。肿瘤的免疫组化染色特征为AT/RT,未表达PXA中常见的胶质和神经元标志物。
在其他原发性中枢神经系统肿瘤中出现的继发性AT/RTs以前也有报道。在所有这些病例中(与本系列肿瘤不同),存在保留SMARCB1/INI1表达的非横纹肌成分。在PXA和室管膜瘤中产生的AT/RTs的遗传分析显示,与各自的前体病变具有相同的BRAF V600E突变或C11orf95-RELA融合基因,提示存在克隆关系。因此,一些AT/RT可能来自胶质/胶质神经元前体细胞,并获得由SMARCB1失活触发的主要横纹肌样表型。病例3在3个月前诊断为间变性PXA进一步支持了这一假设。在本系列的样本中,PXA成分的缺失可能很好地反映了恶性横纹肌成分迅速增大导致的过度生长,但也可能与抽样偏倚有关。
Smarcb1和Tp53的消融诱导在GFAP阳性谱系中选择性地产生AT/RT样小鼠肿瘤。继发性AT/RT似乎主要发生在BRAF V600E突变肿瘤的原因仍不确定,但我们很容易推测,BRAF V600E诱导的MAP激酶通路的激活可能会促进SMARCB1缺陷克隆的进化,并且/或者这些肿瘤的起源细胞更容易获得BRAF和SMARCB1突变。
在大龄儿童和成人中很少发生AT/RTs。在美国中央脑肿瘤登记处(CBTRUS)数据集中,年龄较大的儿童占AT/RT病例的比例小于10%。奥地利脑瘤登记处也报告了类似的比例,但在这些基于人群的研究中没有进行分子谱分析。尽管在我们机构的数据库中观察到,具有PXA分子特征的AT/RTs占8~18岁儿童恶性smarcb1缺陷CNS肿瘤的23%,这需要谨慎解释,但这可能表明,这种肿瘤在该年龄组中并不少见。
通过PXA的分子特征识别AT/RT也可能具有临床意义,因为激活BRAF突变在儿童神经肿瘤学中作为治疗靶点发挥着不断发展的作用。BRAF抑制剂vemurafenib、dabrafenib以及BRAF/MEK双阻断剂已被证明对复发PXA的治疗是耐受和有效的,也可能是具有PXA分子特征的AT/RT治疗选择。
总之,需要考虑具有PXA分子特征的AT/RT,并需要对AT/RT进行仔细的分子检查,尤其是在年龄较大的儿童中。由于针对突变BRAF的治疗是可行的,识别此类病例也可能具有治疗效果。
【参考文献】
[1] Atypical Teratoid/Rhabdoid Tumor (AT/RT) With Molecular Features of Pleomorphic Xanthoastrocytoma[J].Am J Surg Pathol,2021.















共0条评论