1、概述
胰腺实性假乳头状肿瘤(solid pseudopapillary tumor of the pancreas, SPTP,or solid-pseudopapillaryneoplasm,SPN)是胰腺较为罕见的肿瘤,1959年由Frantz等首先报道,当时称为胰腺乳头囊性肿瘤(papillary cystic tumor of the pancreas),占胰腺原发性肿瘤1%-2%,占胰腺囊性肿瘤10%-15%,其发生具有非常显著年龄与性别特征。曾有多种命名,包括胰腺实性乳头状上皮肿瘤、低度乳头状肿瘤、乳头状囊实性肿瘤、囊性-实性肿瘤和Frantz瘤等种, 这些命名分别从不同角度描述形容该肿瘤病理形态形态学特征。直到1996年WHO才正式统一命名为SPTP,2000版WHO将其分为交界性肿瘤和实性假乳头状癌,而2010版WHO则重新定义将其直接归入恶性肿瘤。随着近年来该肿瘤发病率的不断增加,人们对其认识不断深入,同时在诊断和鉴别诊断方面也开展了很多相关研究,取得了一定的研究进展。笔者复习国内相关文献,将其临床特征及病理形态学特征和免疫表型结果,临床治疗及预后,现复习如下,望能提高对该肿瘤的认识,减少临床误诊或漏诊情况。
2、临床表现
SPTP临床上非常罕见,占胰腺外分泌肿瘤0.17%-2.70%。文献报道以亚洲和美国非裔较为多见,高发人群主要包括青春期及年轻女性,发病年龄18-35岁,大多集中在30岁左右,其中约1/3为处于青春期女孩,儿童发病率为20%-25%,老年女性和男性发病极少见。男女比为1:10,男性发病年龄偏大。该肿瘤在胰腺任何位置都可发生,但胰尾略多见,其次是胰体尾部,也有报道多在胰头。偶见邻近器官浸润,可转移到肝、肺和皮肤等部位。偶有报道原发于胰腺外SPT (extrapancreatic solid pseudopapillary tumor,ESPT),如肝脏、肺、结肠、腹膜后、卵巢、睾丸及肠系膜等部位。
临床表现可无明显症状或仅有上腹部不适,但缺乏特异性;肿瘤压迫胃肠道产生恶心、呕吐等症状,偶见肿瘤破裂引起腹腔出血或急腹症。实验室血清学检查肝肾功能、凝血功能、电解质、降钙素原 ( PCT)、血淀粉酶 (AMS)、肿瘤标记物甲胎蛋白(AFP)、癌胚抗原(CEA)、鳞状上皮抗原 (Scc) CA19-9、CA125、CA50、CA153等多为正常值。偶有文献报道因AMS升高而误诊为急性胰腺炎后确诊为SPTP。
目前诊断SPTP主要手段是影像学检查,腹部CT、B超、MRI可显示胰腺或腹膜后占位性病变,其影像学主要特点是肿块呈低密度,囊实混杂,边界清晰,可见钙化,少有胰管或胆管扩张。CT表现平扫示单发的边缘尚清的圆形或类圆形包膜完整低密度影,大多呈囊实性混杂病灶,内部有变性、钙化、出血、坏死等征象;B超表现为胰腺区可查单发低回声肿物,密度不均匀,内部回声不均,可有无声区,血运不丰富;MRI在探查肿瘤内部组织结构方面有很大优势,如肿瘤包膜状态、是否囊性变、是否内部出血等情况。影像学术前检查大多能对肿瘤作准确定位,但一般难以确定病变性质, 需与其他胰腺肿瘤或囊性普通病变相鉴别, 内镜超声(EUS)引导下肿瘤细针穿刺活检 (FNA) 是诊断SPTP可靠手段,但属于有创操作且操作难度大,并发症多,临床上较少采用。
3、病理形态学特征
肉眼观SPTP肿瘤通常较大,常为单发圆形或椭圆形,有假包膜囊实性混合性肿块,包膜多较完整,肿瘤切面呈非均质表现,由灰黄及灰红色实性区域和暗红色囊性区域组成,囊性结构罕见,常可见出血与坏死。肿瘤质地较软,常有包膜或纤维组织分隔。
镜下观SPTP镜下具有多种组织学结构,肿瘤由囊性区、实性区、假乳头区、退变区按照不同比例混合而成,包膜纤维性厚薄不均。肿瘤细胞退变脱落后形成囊性区,囊腔大小不等,微囊或大囊腔均可见,周围肿瘤细胞呈小梁状或腺泡状等形态排列,常可见不同程度出血、坏死及黏液样变性;实性区肿瘤呈片块状或弥漫分布,被纤细小血管分隔,且该血管周围常呈透明变性, 肿瘤细胞形态大小较一致,圆形或椭圆形,胞质丰富且染色较浅,胞核卵圆形,居中常见核沟,核仁一般不明显,核分裂象罕见;假乳头区可见瘤细胞被周围纤细的纤维血管分隔包绕复层排列形成特征性的假乳头状结构,为该肿瘤诊断重要形态学特征。
SPTP免疫组化标记物如Vimentin、β-catenin、α-1-抗胰蛋白酶(α-1-antitrypsin,AAT)、NSE、CyclinD1、CD10、CD56、PR等均阳性表达,而CgA、外分泌胰酶、雌激素受体-α(estrogen receptor-α,ER-α)及甲胎蛋白(alpha fetoprotein,AFP)、EMA等为阴性。最新文献研究认为CD99在肿瘤细胞质内点灶状阳性表达为其特征性。目前有人推荐将β-catenin、E-cadherin、CD10、CgA、Vimentin等用作诊断一组核心抗体。
TFE3属于转录因子(microphthalmia-associated transcription factor,MiT)家族成员,包括4个癌基因:MITF、TFEB、TFE3 和TFEC等,其中TFE3基因还参与溶酶体、自噬体生物合成及细胞碎片清除。最近研究发现TFE3在SPTP中呈肿瘤细胞核阳性是其独特免疫表型,联合检测TFE3+β-catenin+CD10可作为诊断SPTP重要标记。TFE3在SPTP表达对于诊断及鉴别诊断有重要意义,但FISH检测并无染色体易位,其确切机制尚待更进一步的分子基因学研究。
4、鉴别诊断
由于SPTP缺乏特异性辅助诊断指标,易与其他胰腺肿瘤混淆,包括以下胰腺良恶性肿瘤。
①胰腺高分化神经内分泌瘤( neuroendocrine tumor,NET):多见于青年女性,好发于胰腺尾部,增强CT肿瘤多呈明显强化,此类肿瘤常缺乏广泛出血、假乳头状结构及退行性病变,有明显血管间质。临床表现常有内分泌紊乱症状。NET镜下常排列成特定结构,包括缎带、条索、腺样、实性等多种结构,免疫组化特征内分泌标记物CgA、Syn、NSE等常弥漫阳性,此外最重要是NET肿瘤细胞β-catenin和Ecadherin呈现明确细胞膜阳性,而SPTP显示β-catenin细胞核/质阳性而E-cadherin阴性。Claudin蛋白属于完整的紧密连接膜蛋白家族成员,在维持上皮细胞极向、黏附性和细胞旁通透性中起重要作用,与细胞某些功能失常和肿瘤发生密切相关。近年来有学者发现Claudin5和Claudin7可以用来鉴别胰腺SPTP和NET,建议联合检测Claudin5、β-catenin、CD10和Claudin7有助于诊断和鉴别诊断SPTP和NET。
②腺泡细胞癌(acinar cell carcinoma,ACC):该肿瘤更常见于男性,与周围正常组织分界不清,结节状,镜下见癌组织以腺泡或小梁状结构为主,而无SPTP特有假乳头状结构。癌细胞胞核形态呈空泡状,有明显核仁及显著核分裂象,一般位于细胞基底部区域。免疫组织化学特征β-catenin局灶状阳性表达,胞核阳性率较低;该肿瘤CD56呈阴性表达。
③胰腺囊性肿瘤:好发人群为40-60岁女性,胰体及胰尾部常发生。CT平扫呈圆形或卵圆形囊实性肿块,囊壁厚薄不均,可有分隔,增强后囊壁明显强化;若恶变,囊壁上可见强化的壁结节。浆液性囊腺瘤镜下可见小乳头状结构叠于大乳头上,囊壁内层上皮为单层或假复层。粘液型囊腺瘤可见单囊或多囊,腔内含粘液,囊壁内层为高柱状粘液上皮,肿瘤细胞可呈实心团状或乳头状排列并向嚢腔内凸起,且无SPTP特征性假乳头结构,也未见出血坏死等现象。
④胰母细胞瘤:该肿瘤恶性程度高,生长迅速,转移早,临床预后较差,常见于10岁以下男童。鉴别要点主要表现为特征性鳞状小体;肿瘤组织成分为多源性胰腺细胞,可同时表现出腺样分化、腺管分化及内分泌分化状态。该肿瘤缺乏SPTP特征性表现。
⑤胰腺导管腺癌:最常见胰腺肿瘤,恶性程度极高,进展迅速,但起病隐匿,早期可无明显症状。增强CT能够显示肿物大小、部位、形态及与周围结构关系,并能判断有无转移及肿大淋巴结。肉眼常为边界不清的灰黄色质硬结节,肿瘤细胞高中分化呈大小不等的腺管样排列,个别肿瘤出现微乳头状结构和透明细胞表型,肿瘤呈浸润性生长,间质呈促纤维结缔组织增生,与SPPT多细胞少间质及假乳头状结构不同。免疫组化胰腺导管腺癌表达上皮标记物而vimentin阴性。
5、发病机制及组织来源
SPTP发生机制目前尚未明确。有研究表明与β-catenin和E-cadherin基因变异和异常表达有关。β-catenin是一种细胞骨架蛋白,是粘连系统的主要成分,同时参与Wnt信号转导通路激活,能与E-cadherin形成复合结构,在细胞粘附中发挥着重要作用。Abraham等对20例SPTP研究发现几乎所有病例都发生APC和β-catenin信号转导通路的改变,其中95%胞核β-catenin显示阳性表达,90%发生β-catenin基因变异。Müller-Hocker等研究发现β-catenin在SPTP阳性表达率高达100%,但100%呈胞核/胞质阳性表达,说明其可能还有3号外显子外其他外显子突变,因此有待于大样本深入研究探讨。
关于肿瘤起源目前有两种看法:一种来自于多能性胰腺细胞,另一种考虑女性的生殖胚胎起源。WHO于2000年将其定位为胰腺外分泌肿瘤。随着大量电镜及免疫组化等研究结果出现,发现该肿瘤细胞具有多向分化能力,即内分泌、外分泌、局灶上皮等分化方向。电镜研究发现肿瘤细胞存在着内分泌细胞、导管及腺泡的分化。免疫组化结果也提示该肿瘤具有多向表达能力,研究者认为SPTP起源细胞与任何一种胰腺细胞都不相同,其组织起源的一个重要性为胰腺胚胎多能干细胞。电镜检查可见瘤细胞内出现类似于腺泡细胞酶原颗粒样颗粒,文献报道ATT在SPTP中几乎全部阴性表达;Syn是上皮型和神经性神经内分泌肿瘤特异性标志,约70%SPTP中可见表达,呈局灶阳性,不同于胰腺NET弥漫强阳性表达;Nestin蛋白是目前公认胰腺干细胞的标志,Zulewski等研究报道SPTP中Nestin呈胞质弥漫阳性表达,提示该肿瘤可能起源于多能干细胞;Dong等研究发现胰岛素和胰高血糖素在SPTP中呈阳性表达,提示SPTP具有内分泌和外分泌细胞的双重分化特征。
6、临床治疗和预后
虽然SPTP属低度恶性肿瘤,目前手术切除是首选及最有效的治疗方法。手术原则是完整切除肿瘤并最大可能保留胰腺组织。手术方式选择主要取决于肿瘤的生长部位、大小、边界、包膜是否完整、血管及周围组织脏器侵犯、淋巴转移、胰管扩张程度及术中冰冻病理检查结果等;出现侵袭性生长还应同时行胰周淋巴结清扫;对于侵袭血管的肿瘤应可在风险可控范围内争取行肿瘤加血管切除。胰体尾部的肿瘤可行保留或不保留脾脏的胰腺远端切除;胰头部肿瘤可行胰十二指肠切除术。关于放化疗手段治疗SPTP是否有效,目前存在意见分歧。也有报道称放疗对于姑息性切除患者具有—定效果。关于放化疗对SPTP的疗效还需进一步研究和探讨。还有报道称性激素受体阳性病人采用内分泌治疗也取得了一定疗效。
患者肿瘤切除后5年生存率为95%-97%,术后5年局部复发率<10%。增加该肿瘤复发风险因素包括:首次手术时出现肿瘤转移,附近器官侵袭,淋巴血管侵袭、肿瘤大小(大于5cm)、患者年龄、肿瘤破裂和切缘阳性等。
7、结语
SPTP是一种好发于年轻女性的低度恶性肿瘤,但具有复发转移能力,临床表现无特异性且容易被误诊为良性病变。组织学特征为假乳头状结构,是诊断重要形态学标志。手术切除是SPTP首选的治疗手段。其他的治疗方式仍有待于进一步探索和验证。发病机制可能与β-catenin和E-cadherin的基因变异和异常表达有关。
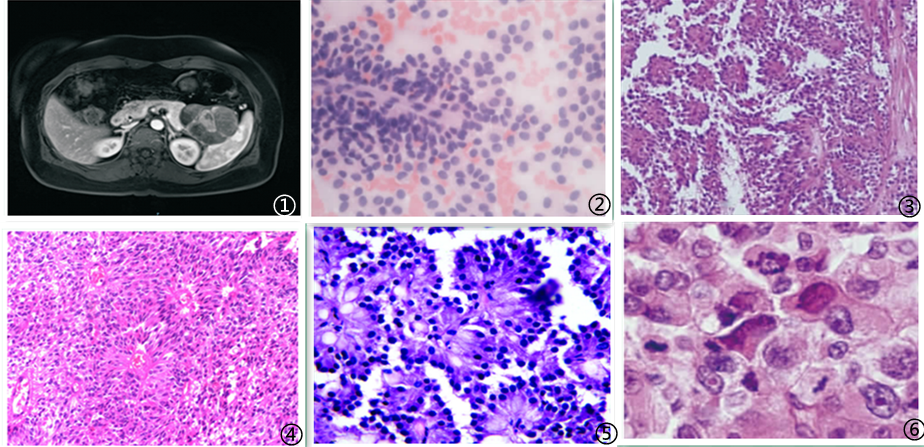
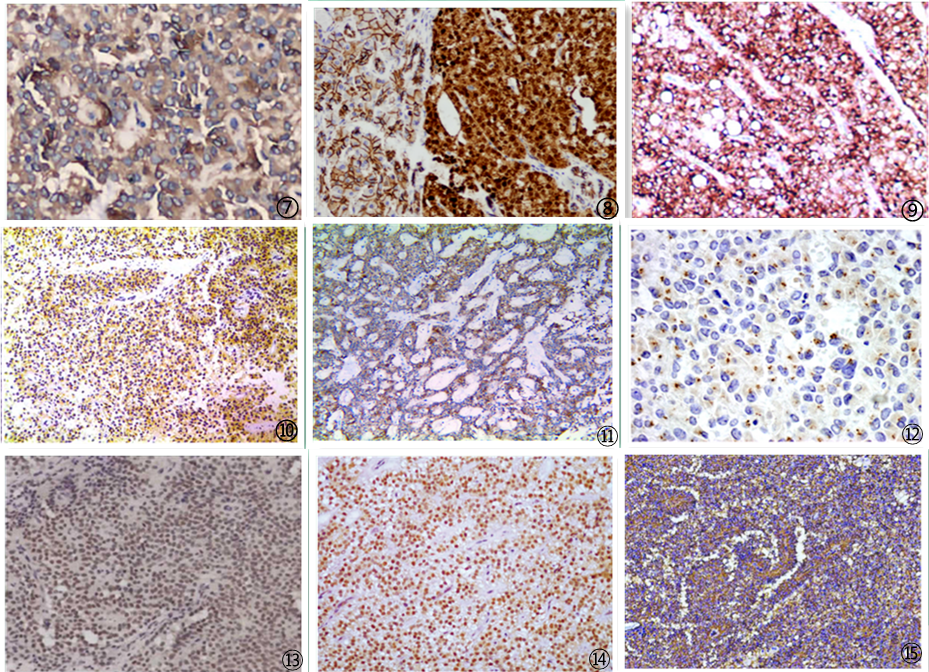
图1 影像学可见胰腺肿瘤;图2 穿刺细胞学:肿瘤细胞温和一致,核染色质细腻均匀,胞质淡染,细胞边界不清;图3 肿瘤细胞呈假乳头状结构;图4 肿瘤细胞可见菊型团结构;图5 肿瘤细胞被周围纤细的纤维血管分隔包绕复层排列形成特征性假乳头状结构;图6 肿瘤细胞形态大小较一致,圆形或椭圆形,胞质丰富且染色较浅,胞核卵圆形,核分裂象罕见;图7 肿瘤细胞Vimentin弥漫强阳性;图8 肿瘤细胞β-catenin核/浆阳性;图9 肿瘤细胞E-cadherin阳性;图10 肿瘤细胞CD10阳性;图11 肿瘤细胞CD56阳性;图12 肿瘤细胞CD99核旁点灶阳性;图13 肿瘤细胞PR核阳性;图14 肿瘤细胞TTF3核阳性;图15 肿瘤细胞Claudin5阳性。图片来自于参考文献,如有侵权,请联系删除。
参考文献:
[1]王全义,李磊,赵丽华,张仁亚.胰腺外实性假乳头状肿瘤临床病理观察[J].诊断病理学杂志,2014,21(03):161-164.
[2]龚毅,汪晓红,张盛箭,王葳,信超.胰腺实性假乳头状肿瘤的影像特征分析[J].放射学实践,2020,35(01):56-60.
[3]龚毅,汪晓红,张盛箭,王葳,信超.胰腺实性假乳头状肿瘤的影像特征分析[J].放射学实践,2020,35(01):56-60.
[4]施炜.胰腺实性假乳头状肿瘤的研究现状和诊治进展[J].铜陵职业技术学院学报,2015, 14(02):27-30+65.
[5]王文,翁杰锋,古维立.胰腺实性假乳头状肿瘤病例报告并文献复习[J].广州医药,2021,52(03):88-91+126.
[6]秦中强,慈红非,周万飞,李红俊,谈燚.胰腺实性假乳头状肿瘤3例并文献复习[J].临床与实验病理学杂志,2018,34(07):796-798.
[7]马怡晖,高汉青,翟文龙,黄培,李珊珊.胰腺实性假乳头状瘤临床病理及预后的性别差异[J].中华病理学杂志,2018,47(03):203-204.
[8]王瑜,郭鹏,代燕波,吴欢,敬敏,谷从阳,刘贵平.胰腺实性-假乳头状肿瘤中TFE3的表达及意义[J].临床与实验病理学杂志,2020,36(08):957-959.
[9]张艳,张彦宁,陈书媛,冯骥良.胰腺实性-假乳头状肿瘤临床病理特征分析并文献复习[J].首都医科大学学报,2019,40(05):786-790.
[10]曹钟,魏建国,岑红兵,刘立红,常慧芳,敖启林.胰腺实性-假乳头状肿瘤和神经内分泌肿瘤中Claudin5和Claudin7的表达及意义[J].临床与实验病理学杂志,2017,33(10):1122-1125.
[11]郑金榆,柏涛,陈鸣,吴鸿雁,林旭,章宜芬,孟凡青.胰腺实性-假乳头状肿瘤的内镜超声引导下细针穿刺细胞学特征[J].南京医科大学学报(自然科学版),2015,35(09):1278-1282.
[12]代娜娜,孟刚,翁海燕.胰腺神经内分泌肿瘤与胰腺实性假乳头状瘤中β-catenin、E-cadherin及CD10的鉴别诊断价值[J].临床与实验病理学杂志,2018,34(04):404-408.
[13]赵雪艳,张桃桃,景彩萍,邓元.儿童胰腺实性-假乳头状肿瘤8例临床病理学分析[J].诊断病理学杂志,2018,25(06):447-450.
[14]Erguibi Driss,El Berni Yassine,Moufakkir Aziz,Boufettal Rachid,Rifki Jai Saad ,Chehab Farid. Solid pseudopapillary neoplasm of the head of the pancreas: A case report.[J]. Annals of medicine and surgery (2012),2021,69:
[15]Flores Rubén Lima,Rossi Ricardo,Castiblanco Adriana,Gallardo Alejandra,Schiappacasse Giancarlo. Solid bifocal pseudopapillary neoplasm of the pancreas: A case report[J]. International Journal of Surgery Case Reports,2021,84:















共0条评论