1 概述
胃梭形细胞间叶源性肿瘤主要包括胃肠道间质瘤、平滑肌肿瘤、神经鞘瘤、炎性肌纤维母细胞瘤、脂肪瘤、血管瘤、神经纤维瘤、颗粒细胞瘤及丛状纤维黏液瘤和胃母细胞瘤等,其中以胃肠道间质瘤(gastrointestinal stromal tumor,GIST)最为常见,胃肠道神经鞘瘤(gastrointestinal schwannoma,GS)又称为胃肠道施万( Schwann)细胞瘤,占所有胃肠道间叶性肿瘤2%-6%,占胃良性肿瘤4%,占胃肿瘤0.2%。GS临床预后良好,在消化道中胃是较为常见部位,其中以胃体最常见,约占半数,其次为胃窦和胃底,然后是贲门和幽门,其次是结直肠,小肠和食道及胆囊尤为罕见。Daimaru等在1988年首次描述GS,将其归类为间叶性或神经外胚层肿瘤,GS起源于胃肠道系统中Auerbach肌间神经丛。GS通常位于黏膜下层或固有肌层,目前术前确诊较为困难,需要依赖手术后病理学检查。笔者在最近外检工作中碰到一例GS,现将其临床特征,病理形态学特征及免疫表型,临床治疗及预后,复习国内外相关文献,汇报如下。
2 病例分享
女性患者,51岁,2年前无明显诱因出现左上腹疼痛不适,为阵发性隐痛,伴腹胀不适,无恶心呕吐,无反酸烧心,无腹泻和便血,无畏寒发热等。4月前因上述症状反复发作,遂于我院门诊就诊,门诊胃镜示胃体隆起伴多发溃疡,超声内镜示胃体固有肌层来源低回声病变(GIST),临床诊断:胃体隆起性质待查:间质瘤?平滑肌瘤?其他?随在全麻下行腹腔镜胃部分切除术。腹腔镜探查肿瘤位于胃大弯侧,大小约3cm×2cm,与周围组织无粘连,表面光滑,质硬。术后送检标本至病理科。
大体见灰白色结节一枚,体积3cm×2.5cm×2.5cm,切面灰白灰黄色,实性,质稍韧,有黏滑感。镜下肿瘤侵犯至胃黏膜,见特征性微小梁结构,主要由形态温和纤细或肥胖梭形细胞组成,胞质淡染或嗜伊红,局灶细胞核可见非典型性,核仁不明显,核分裂象偶见,间质血管丰富,伴黏液变性,可见外周淋巴细胞套伴生发中心形成(图1-3)。肿瘤细胞S-100(图4)、SDHB(图9)、SOX10(图5)、Vimentin阳性表达;肿瘤细胞Bcl-2、caldesmon(图7)、CD117、CD34、CD99(图8)、Desmin、DOG1(图6)、MDM2、Myogenin、P53和STAT6阴性;肿瘤细胞增殖指数Ki-67约2%。
最终诊断:胃神经源性肿瘤,考虑神经鞘瘤伴细胞增生活跃。
术后患者无不适,随访一个月,状态尚可。
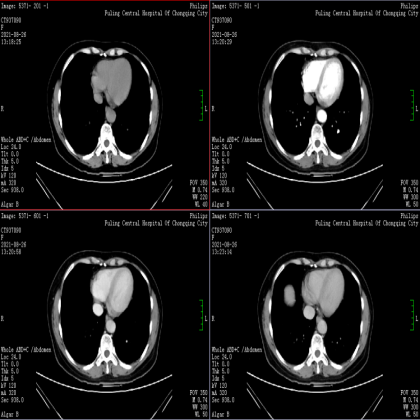
CT检查示胃大弯侧团状软组织影,与胃壁分界不清,考虑肿瘤性病变,胃间质瘤?其他?请结合临床。

图1低低倍镜下肿瘤外周可见淋巴细胞套;图2中倍镜下见特征性小梁结构,由形态温和纤细或肥胖梭形肿瘤细胞组成,间质血管丰富;图3肿瘤细胞胞质淡染或嗜伊红,局灶细胞核可见非典型性,核仁不明显,核分裂象偶见;图4肿瘤细胞S100弥漫强阳性;图5肿瘤细胞SOX10阳性;图6肿瘤细胞DOG1阴性;图7肿瘤细胞caldesmon阴性;图8肿瘤细胞CD99阴性;图9 肿瘤细胞SDHB阳性;
3讨论
3.1临床表现
GS好发于中老年人,发病年龄10-81岁,中位年龄52.6岁,女性稍多见。GS临床症状通常不典型,随瘤体的大小和部位不同而异,多为上腹部不适及腹痛、吞咽困难、胃肠道出血等,无症状于体检时偶然发现,文献亦有胃癌手术偶见GS报道。
影像学检查能够对GS鉴别提供一些线索。EUS常应用于胃肠隆起型病变诊断,通过超声信号判断肿瘤位于胃肠壁层次。GS内镜主要表现为光滑隆起性肿块,多数位于固有肌层,因此该肿瘤的术前确诊率非常低。CT表现为消化道壁内密度均匀、边界清晰、轻度至明显渐进性强化实性肿块,但与消化道其他间叶源性肿瘤征象有较多重叠之处,再加上临床症状也不特异性,可导致误诊。文献亦有超声内镜下活检诊断报道,但多数情况确诊必须依赖病理学检查及免疫组织化学。
3.2 病理形态特点
肿瘤巨检呈圆球状或结节状,常位于黏膜下或肌层,边界清楚,无真正纤维性包膜,切面呈实性,灰黄色或灰白色,质地中等或偏硬,一般无出血坏死及囊性变,有时溃疡形成。伍健等报道瘤体边界呈灶性浸润平滑肌,提示肿瘤生物学行为可能为侵袭性生长,多组研究均显示GS预后良好,所以研究认为这种现象可能是周围间质及平滑肌陷入瘤体的现象,而不应认为浸润。
软组织经典型神经鞘瘤呈AntoniA区和AntoniB区交替。AntoniA区也叫束状带,即排列有序细胞丰富的束状区,肿瘤细胞呈梭形,界限不清,排列呈编织状、栅栏状、旋涡状等,胞浆丰富,核分裂象罕见。当肿瘤细胞互相紧密平行排列呈栅栏状或旋涡状结构时,称作Verocay小体。AntoniB区也称网状区,即疏松黏液样的网状区域,该区域肿瘤细胞疏松、呈现星芒状,细胞核圆形或卵圆形,可伴有核内假包涵体。与软组织神经鞘瘤相比,GS组织形态学有自身特点,无典型Verocay小体及AntoniA区和B区。肿瘤实质由交叉条索状或梁状排列的长梭形肿瘤细胞组成,排列交叉束状、束状、带状、栅栏状及波浪状,胞浆淡红染,胞核呈长梭形或肥胖的梭形,两头尖,染色质细腻,核仁不明显,核分裂象偶见。肿瘤细胞间可见多少不等的胶原纤维,通常无玻璃样变血管。
镜下最突出特点是肿瘤周边出现淋巴细胞套,并可有生发中心,形成原因尚不明,而软组织神经鞘瘤无此现象,考虑可能与发生部位有关。研究统计中外文献报道提示肿瘤周边淋巴细胞套在GS病理诊断中有重要价值。有些肿瘤局部瘤细胞核可出现显著异型性,但核分裂少见或缺乏,核染色质分布也较均匀,该现象是一种退行性改变,并非其恶性变指征,一般无坏死及钙化,病理性核分裂象亦罕见。
免疫表型:肿瘤细胞表达Vimentin、S-100、SOX-10、GFAP及CD57等,有趣的是GFAP在经典型神经鞘瘤中常不表达。S-100蛋白参与细胞周期、细胞分化、细胞骨架膜的相互作用,广泛分布于中枢和外周神经系统。AntonniA区肿瘤细胞中S-100均匀分布于细胞核和细胞浆内,而AntonniB因细胞疏松,S-100染色也不规则。GS因为缺乏AntonniA、B区,因此S-100弥漫强阳性表达。GS不表达 CD117、DOG-1、CD34、SMA及desmin等。Ki-67阳性指数低,常小于3%,异型性肿瘤细胞核常为阴性,印证这种异型性是一种退行性改变。
分子遗传学上,部分GS有NF1突变,而无NF2突变,提GS与神经纤维瘤的关系较密切,这点与其他部位经典型神经鞘瘤不一样。基因测序检测未发现C-KIT及PDGFRA突变。
3.3 鉴别诊断
GS需与其他间叶源性肿瘤鉴别,包括GIST、平滑肌肿瘤(平滑肌瘤和平滑肌肉瘤)、炎性纤维性息肉( IFP)、神经纤维瘤等。
① GIST:胃肠道最常见的间叶源性肿瘤,GS与GIST鉴别非常重要,GIST具有不同生物学行为,约30%GIST临床表现为恶性。无论胃镜、超声内镜还是CT均无法鉴别二者。GIST大体境界清,常无包膜,切面灰白、灰红或灰褐,可有出血坏死囊性变,组织学主要由梭形细胞及上皮样细胞,无特征性淋巴细胞套,长梭形肿瘤细胞常呈束状、编席状或栅栏状结构, 胞质淡染或红染,胞核呈梭形,两头圆钝。上皮样肿瘤细胞大且不规则形或椭圆形,胞质丰富,嗜酸性或空亮,胞核圆形或椭圆形,深染。肿瘤细胞表达CD117、DOG1、CD34而S-100阴性。分子检测C-KIT或PDGFRA基因突变,SDH缺陷型免疫组化特征性SDHB表达缺失。
② 平滑肌肿瘤:包括平滑肌瘤和平滑肌肉瘤,胃肠道间叶源性肿瘤中第二常见的梭形细胞肿瘤,表现为单发边界清晰的类圆形结节,有或无纤维性包膜,切面灰白灰黄,实性,呈漩涡状或编织状,质地韧,可有出血囊性变、黏液变性及钙化。结节由梭形细胞呈束状、编织状、漩涡状排列,胞浆嗜酸性,胞核梭形,两端钝圆呈雪茄样,核分裂象可见但通常不多见;平滑肌肉瘤切面可为灰红鱼肉状,伴出血坏死及囊性变,瘤细胞出现明显异型及坏死和核分裂时要考虑平滑肌肉瘤,免疫组化肌源性标记(Desmin、Caldesmon和SMA等)弥漫强阳性表达,瘤体周边缺少淋巴细胞套。
③ 神经纤维瘤:十分罕见,二者都起源于外周神经,神经鞘瘤由施万细胞构成,而神经纤维瘤由多种外周神经成分混合构成,包括施万细胞、纤维母细胞和神经束衣细胞。该肿瘤境界清或不清,无包膜,可呈结节状,当肿瘤较大时可侵犯相邻正常组织,肿瘤细胞呈梭形或波纹状,胞核纤细呈两头尖的梭形,无Antonni A区和B区两种结构,无栅栏状结构,间质含有丰富的胶原纤维网,周边也无淋巴细胞套。免疫组化S-100阳性程度不如神经鞘瘤。与经典型神经鞘瘤常常有NF2基因突变不同,消化道神经鞘瘤常有NF1等位基因缺失,提示GS与神经纤维瘤关系比经典型神经鞘瘤更为密切。
④ 恶性外周神经鞘瘤:极其罕见,两者鉴别与发生于其他部位相似,肿瘤境界不清,切面灰白,鱼肉样,呈浸润性生长,超声检查可帮助观察肿瘤范围及与周围组织关系。一般肿瘤细胞有较大异型性,常表现为高度富于细胞的肉瘤样改变,胞核增大深染,核分裂象多见,常伴有出血及肿瘤性坏死。
⑤ 炎性肌纤维母细胞瘤:好发于儿童和年轻成人的肠系膜或腹膜后,肿瘤具多种成分,由梭形肌纤维母细胞和炎细胞以不同比例混合组成,伴有多少不等淋巴浆细胞浸润及嗜酸性粒细胞,可有淋巴滤泡,可见黏液样背景。肿瘤细胞呈梭形到上皮样,免疫组化肿瘤细胞常ALK阳性,SMA大多阳性而S-100阴性,分子检测有ALK基因重排。
⑥ IFP:现在普遍认为是由于胃肠道黏膜长期炎症刺激导致的一种息肉样肉芽肿,多数位于胃窦,少数位于小肠和食道。内镜表现为息肉样新生物凸向管腔,可伴有溃疡和蒂,病变主要位于黏膜下层。大体呈结节息肉样,境界清晰,但无包膜,切面灰白灰红,质地中等,形态以增生的梭形纤维细胞围绕血管形成洋葱皮样外观为特征,镜下肿瘤细胞梭形,胞浆嗜酸性,胞核梭形,无明显异型,间质疏松水肿,呈纤维胶原样或黏液样,有多量炎症细胞,如嗜酸性粒细胞、淋巴细胞、浆细胞、中性白细胞及组织细胞等浸润,免疫组化表达Vimentin、CD34、SMA等,而不表达S-100,证实肿瘤组织成分为纤维母细胞及肌纤维母细胞,能与神GS区分开。
⑦ 孤立性纤维性肿瘤:中间性肿瘤,该肿瘤生长速度缓慢,常见于皮下组织及四肢、胸壁、腹腔等深部软组织,而胃肠道少见,大体通常无包膜或有部分包膜,切面灰白色,质地中等偏硬,可有变性坏死,肿瘤细胞梭形,胞浆少,嗜酸或淡染,胞核梭形或卵圆形,染色质温和,可见空泡状核,无明显异型性,核分裂象罕见,肿瘤细胞排列稀疏或致密且交替出现,致密区肿瘤细胞丰富,间质少,分支状薄壁血管丰富,肿瘤细胞在血管周围排列,呈血管外周细胞瘤样结构,稀疏区肿瘤细胞间可见丰富的胶原纤维。当肿瘤细胞丰富、明显异型性、核分裂象>4/10HPF、伴有坏死、边缘呈浸润性生长时要考虑恶性可能。免疫组化SATA6、CD99、CD34、Bcl-2等阳性表达,而CD117、S-100、SOX10、GFAP等阴性。
3.4 临床治疗和预后
GS多为良性肿瘤,对于<2.0 cm良性无症状的黏膜下肿瘤,多建议内镜随访。而对于较大引起病人不适症状且具有恶变倾向肿瘤才建议切除。手术完整切除肿瘤是目前治疗该肿瘤唯一有效方法,对于粘膜下小肿块也可内镜下摘除,向腔外生长肿瘤可在腹腔镜下切除。GS术后预后良好,该病例术后未见复发或转移。
以往外科手术是GS首选治疗方式。近年来由于内镜诊疗技术的迅速发展,内镜黏膜下挖除术(endoscopic submucosal excavation,ESE)、经黏膜下隧道内镜肿瘤切除术(submucosal tunneling endoscopic resection,STER)、内镜全层切除术(endoscopic full-thickness resection,EFTR)等内镜治疗技术越来越多的被用于胃肠道黏膜下肿瘤治疗。
4 小结
GS是一种较少见良性的间叶来源的肿瘤,与经典型神经鞘瘤有所差异。诊断须与GIST鉴别,临床预后较好。诊断需结合术前检查、大体表现、镜下特点及免疫组化表型,S-100阳性是确诊有力依据。
参考文献:
[1]肖峰, 颜红柱, 邹珏,等. 多结节状胃梭形细胞肿瘤3例临床病理观察并文献复习[J]. 诊断病理学杂志, 28(1):5.
[2]阿依木克地斯•亚力孔, 李冰, 周平红,等. 内镜治疗上消化道神经鞘瘤52例临床分析[J]. 中国实用外科杂志, 41(5):6.
[3]Hu J , Liu X , Ge N , et al. Role of endoscopic ultrasound and endoscopic resection for the treatment of gastric schwannoma[J]. Medicine, 2017, 96(25):e7175.
[4]李岳美, 李从洋, 王佳佳,等. 胃Gardner纤维瘤2例并文献复习[J]. 临床与实验病理学杂志, 2019, 035(002):222-224.
[5]冯怡锟, 胡桂明, 蒋玉涵,等. 胃肠道神经鞘瘤27例临床病理分析[J]. 临床与实验病理学杂志, 2018, 034(010):1146-1148.
[6]Clinicopathologic Features of Gastric Schwannoma: 8-Year Experience at a Single Institution in China[J]. Medicine, 2015, 94(45):e1970.
[7]孙龙. 胃神经鞘瘤临床病理分析[J]. 中国现代医生, 2015, 53(29):109-111.
[8]苏琳茜, 郭乔楠, 唐雪峰. 消化道神经鞘瘤临床病理分析[J]. 局解手术学杂志, 2019, 028(003):204-207.
[9]赵习羽, 雷梓, 潘国庆,等. 消化道神经鞘瘤临床病理特征及鉴别诊断[J]. 国际病理科学与临床杂志, 2018, 038(007):1440-1445.
[10]王宏量, 曹智新, 徐嘉雯,等. 胃炎性肌纤维母细胞瘤的临床病理特点及治疗研究进展[J]. 山东医药, 2017, 23(v.57;No.1049):114-116.















共0条评论