1、概述
腺样囊性癌(adenoid cystic carcinoma,ACC)以涎腺最常见,还可发生在泪腺、外耳道、上呼吸道及肺、消化道、乳腺、皮肤、前列腺及女性生殖道等器官。乳腺原发性腺样囊性癌(Primary adenoid cystic carcinoma of the breast,PACCB)是一种临床罕见的特殊亚型乳腺癌,约占乳腺癌的0.1%。该肿瘤预后较好,极少发生区域淋巴结和远处转移。1946年Geschickter首次报道,并称其为腺样囊性基底细胞癌,由于其组织学态具有多样性,部分病例形态学不典型,且发生率低,故易被误诊,特别在术中冰冻检查及粗针穿刺诊断中常被误诊为其他类型肿瘤或良性病变。
2、临床特征
PACCB多发生于19-81岁女性,以50岁以上较为常见,也可发生于男性及儿童中,李娜等与王玉龙等各报道了1例男性患者,他们有前列腺癌病史,于服用抗雄激素药物治疗过程中发病,提示应高度关注男性患者的临床病史及相关用药史。Coate等分析了376例PACCB发病年龄为30-90岁,常见于50-60岁,与乳腺浸润性导管癌类似。文献报道平均发病年龄小于国外,符合中国女性乳腺癌发病年龄早于欧美国家的特点。临床最常见的表现为乳腺单发肿物,肿块以乳晕旁及外上象限多见,可触及边界清、质地韧、活动度较好的肿块,少有乳头溢液。由于大部分肿物位于乳头乳晕区,故乳头内陷也较常见。部分患者伴有疼痛,这可能与肿瘤侵犯神经相关。双侧均可发病,一侧罹患PACCB后,对侧或同侧乳腺均可发生其他类型癌;腋窝淋巴结转移不常见。
PACCB影像学表现报道较少,检查包括超声、钼靶、CT及MRI。乳腺X线上可表现为不规则形或分叶形肿块,密度较高,边界不清或部分清晰,也可表现为局限不对称致密,钙化罕见。超声检查表现为低回声或混杂回声,可为规整型或毛糙型肿块,后方可伴声影;无或少量彩色血流信号,以高回声为主的混合回声肿物是少见超声表现,可能因癌组织向邻近脂肪组织浸润导致脂肪层回声增强,需与脂肪坏死及炎症性病变相鉴别。这与PACCB惰性生长、转移少见及良好预后有一定的关联性,但确诊仍需依靠病理。
3、病理学特征
PACCB在大体上常为境界清楚的结节,外观呈粉红色、褐色或灰白色,可有微囊形成;质韧,类似纤维腺瘤。光镜下肿瘤细胞异型性较小,常见浸润性生长,少数肿瘤可见神经周围侵犯,脉管瘤栓极少见。腺上皮和肌上皮细胞排列成经典的筛状(腺样)、梁-管状和实体型构型。①筛状结构是最特征性的改变,有两种类型。一是假腺腔,肿瘤细胞包绕间质成分并和周围间质相通,衬覆基底样细胞,胞质少,核圆形或卵圆形,可见小核仁,基底样细胞周围有肌上皮分化细胞,胞质双嗜性或透明,核不规则。另一种为真腺腔,腔内常有黏液,衬覆立方状腺上皮细胞,胞质嗜酸性,核圆形,可有小核仁;外层为肌上皮细胞或基底样细胞;间质可见促维结缔组织增生,黏液样变或软骨样变甚至脂肪组织。②梁-管状型由基底样细胞构成上皮条索,易见假性腺腔和间质相通,真性腺腔也更明显,内层为腺上皮细胞,外层为基底样细胞/肌上皮。周围间质纤维化、透明变性,将小管挤压成小梁状。③实体型在光镜下缺乏微囊或管状结构,细胞可具有基底细胞样特征,肿瘤细胞绝大部分呈实性分布,细胞异型性较大,可见中重度异型性,大小较一致,胞质稀少,界限不清,胞核呈圆形或卵圆形,核染色质均匀,核仁不明显;核分裂象多见,常可见坏死。
上述3种结构常混合存在,特别是筛状型和梁-管状型常相伴存,大管腔内含有AB阳性的黏液,较小腺腔内含有PAS阳性物质,还可见皮脂腺化生、鳞状化生和腺鳞状化生,提示具有向皮肤附属器结构分化的潜能。PACCB常以2种或3种组织学结构存在于同一病例中,而以某一种组织学结构为主时,给粗针穿刺标本诊断造成了困扰,所以临床医师在诊治过程中需结合多种检查方式如B超、MRI及钼靶等,不可完全依赖粗针穿刺结果。PACCB预后与组织病理学类型相关,Arpino等将其分3级:即1级为管状结构为主伴有筛状结构而无实性结构者;2级为筛状结构或混合有实性结构比例约小于30%;3级为实性结构30%以上,且认为实体成分的多少与预后有较大关系,即实体成分越多预后越差。
4、免疫组化及分子学特征
文献报道免疫表型包括CD117、CK5/6、CK14、CK7、34βE12、AE1/AE3等常呈阳性,SMA、Calponin、p63、S100等可灶阳性,Ⅳ型胶原基膜样物阳性。一般认为乳腺癌 Ki67>14%与预后呈负相关,但Kleer等认为Ki67一般表达较低,对预后无影响。CD117为ACC相对特异的指标,PACCB中CD117呈高表达。PACCB诊断主要依靠组织形态学、特殊染色及免疫组化检测,其中病理检查和免疫组化是确诊的主要方法。此外肿瘤细胞均不表达ER、PR及HER2,但表达CK5/6提示其基因表达谱属于基底细胞样表型乳腺癌,但杨文涛等认为这种基底细胞样特征仅指细胞形态上具有基底细胞样特点,因为大部分报道PACCB生物学行为表现良好,预后较好,这提示该肿瘤是一组具有异质性的肿瘤,其组织学形态和预后差别较大。此外国内有文献报道EGFR蛋白在PACCB中常过表达。
分子遗传学特点:随着分子生物学和遗传学研究的深入,对于该肿瘤的研究也取得了相关进展。研究证实PACCB与涎腺ACC相同,存在t(6;9) (q22-23;p23-24)染色体异位,并形成MYBNFIB融合基因,有学者认为这种异位出现在90%以上病例中,是PACCB特异性生物学标记物。尽管不同部位的ACC表现相同的病理形态学、免疫学表型及分子遗传学特征,但其生物学行为完全不同,发生于涎腺具有侵袭性,而发生于乳腺则呈惰性。而PIK3CA、BRCA1在PACCB中的突变很少报道,而BRAF突变率约为15%,有文献PACCB还可出现SMARCA5、SF3B1、FBXW7、FGFR2、MTOR突变及NOTCH1点突变,因此PACCB分子遗传学机制有待更深入的分析。
对于PACCB的起源,不同学者有不同的看法。Shin和杨文涛等均报道在PACCB周围可见少量原位癌成分,且两者肿瘤细胞的组织学形态相同,免疫组化证实示肌上皮完整连续,故推测这种原位癌可能是肿瘤发生的早期阶段,而随着肌上皮消失及基底膜突破,可发展为浸润性癌。van Dorpe等报道提示与微腺性腺病(microglandular adenosis,MGA)和小管腺病(tubularadenosis,TA)共存,尤其MGA且两者间存在移行,在免疫表型中存在相似之处,故认为PACCB可能发生在MGA基础上并有不典型MGA向ACC的过渡,描述了MGA、非典型MGA(即原位ACC)和浸润性ACC在内的形态学谱系,建议对伴有不典型增生MGA患者需密切随访。Boecker等认为自我更新的乳腺干细胞具有分化成腺上皮细胞和肌上皮细胞的潜能,PACCB和恶性腺肌上皮瘤在形态学上具有相似性,所以在某种特定的环境下两者可共存并相互转化。McLaren等推测腺肌上皮瘤、低度恶性汗腺癌、ACC和低级别腺鳞癌这几种肿瘤细胞都由上皮与肌上皮细胞构成,说明这些上皮肌上皮来源肿瘤应归于乳腺化生性肿瘤谱系。
5、鉴别诊断
①胶原小体病:是一种罕见的良性病变,这是一种累及小叶和小导管的病变,大多为偶然发现。其形态学上表现为小叶腺泡和小导管腔形成不规则的筛状结构,充满透明变性状无定形物质,或筛孔中央见嗜酸性小球,呈同心圆、分层状或放射状排列,无黏液样物形成,该物质可用Ⅳ型胶原抗体标识。管腔周见增生的肌上皮和腺上皮细胞围绕,增生肌上皮表达SMA及p63等,而不表达 CD117。此外胶原小球病常和其他病变如硬化性乳腺病、放射状瘢痕等合并存在。
②浸润性筛状癌:常合并小管癌,预后较好,组织学形态类似于筛状PACCB,具有明显筛孔状结构,但筛状细胞巢更不规则,筛孔衬覆细胞缺乏基底样细胞和肌上皮表达,筛孔内是蛋白黏液性分泌物和坏死组织,较少出现玻变样物质,一般不与乳腺间质相通;间质中促纤维组织反应较为明显;细胞巢周围和筛孔内没有嗜酸性基膜样物。ER和PR常阳性,SMA、p63、CD117及Calponin等通常阴性。
③筛状导管原位癌:导管内病变出现筛状结构,癌细胞一致呈腺上皮特点,腺腔间缺乏肌上皮或基底样细胞,但导管周围均有较完整肌上皮包绕,部分筛孔内可见有坏死。免疫组化:导管内腺上皮ER、PR、HER2常为弥漫阳性,周边肌上皮p63、CK5/6、Calponin呈阳性。
④小细胞神经内分泌癌:不管原发性还是转移性,小细胞神经内分泌癌在乳腺罕见,肿瘤细胞大小较一致,异型性大,细胞挤压及坏死明显,胞质较少,核染色质较细腻,深染,核分裂象常见,免疫表型上表达神经内分泌标记物,此外TTF-1常阳性,Ki-67增殖指数常较高。
⑤基底细胞表型乳腺癌:两者的免疫表型一致,ER、PR及HER2均不表达,但基底细胞表型乳腺癌形态学缺乏筛状及管状-小梁状型,一般肿瘤细胞高度异型,核分裂象常见,可见浸润性生长及地图状坏死,且预后较差;需与实体型PACCB相鉴别。
⑥小管癌:小管卵圆形或圆形,部分呈角状,衬覆单层上皮,缺乏肌上皮,常有胞浆顶突,小管周围可见富含细胞的结缔组织增生性间质,而PACCB则由腺上皮及肌上皮两种细胞成分组成,周围见玻璃样间质,免疫组化有助于鉴别,ER及PR弥漫强阳性而CD117呈阴性。
⑦乳腺腺肌上皮瘤( adenomyoepithelioma,AME) :当肿瘤主要表现为小管或小梁状结构时,需要与同样含有腺上皮和肌上皮成分的AME鉴别。AME由腺上皮和肌上皮有序组成,缺乏基底样细胞及基膜样/黏液样物质,其组织学构象类似于导管内乳头状瘤,形态学较为单一。PACCB呈浸润性生长,组织结构具有异质性,在小管/小梁状结构为主的肿瘤中仔细寻找小灶的筛状结构以及基膜样/黏液样物质是诊断的重要线索。而乳腺恶性AME的恶性成分变异较大,其组织学变异、浸润性生长方式等均会导致鉴别困难。如肿瘤中出现经典的良性AME成分或既往AME病史,则更支持恶性AME诊断。
⑧乳腺圆柱瘤:类似皮肤圆柱瘤,肿瘤主要由上皮性小叶构成,周围常有厚的基膜样物,筛状结构内见基膜样物质,有导管上皮及基底样细胞,有研究显示乳腺ACC和圆柱瘤均可见MYB-NFIB融合基因,提示两者有某些内在联系,而圆柱瘤缺乏细胞异型性、核分裂象及坏死。免疫组化较难确定肿瘤的器官来源,所以需结合临床情况及病史排除其他部位转移。
⑨转移性ACC:免疫组化标记无法提供鉴别诊断ACC的具体原发器官,所以需结合临床病史和影像学。
6、临床治疗及预后
PACCB发病率低,目前尚无标准的治疗方案,关于其临床治疗方案尚存争议,采取的手术方式大多都参照乳腺浸润性导管癌。大部分外科医师主张行单纯乳腺切除或保乳手术,且不提倡行淋巴结清扫术。Coates等研究发现辅助放疗对预后有积极作用,有研究者建议对分级较高和伴有淋巴结转移或远处转移的患者行辅助化疗,但目前存在争议。由于常为三阴性,故内分泌治疗及赫赛汀靶向治疗报道较少,但其过表达EGFR和CD117,为今后靶向治疗提供理论依据。此外该肿瘤MYB和NFIB基因融合这一发现则有可能为靶向治疗提供一个新的思路。
PACCB患者预后好,5年、10年及15年生存率分别为98%、95%及91%,淋巴结转移率<8%,远处转移率<20%,当肿物<1.4cm 时几乎无腋窝淋巴结转移。Vranic等报道个别病例在术后发生全身转移,转移部位包括胃、肺、肝、大脑、肾等,其中最常见的转移部位是肺和骨,这提示胸部X线片及全身骨扫描的必要性。部分研究认为实体型淋巴结及远处转移存在较高风险,但并未得到随访数据的证实。
7、具有基底细胞样特征的乳腺实体型腺样囊性癌
2002 年Shin和 Rosen首次报道,国内2012年亦有文献报道。患者发病年龄38-83岁,平均61岁,多为绝经后妇女。临床表现为单个可触及的结节,无疼痛。影像学检查无特征性改变。镜下肿瘤细胞实性区域超过90%,部分癌巢周围细胞呈栅栏状排列。胞质稀少,呈中重度异型性,胞核圆形或椭圆形,染色质均匀,核仁不明显。真性腺腔和假性腺腔不易查见,真性腺腔内细胞胞质更丰富,呈嗜酸性;假腺腔内可见嗜酸性基膜样物质。肿瘤间质玻璃样变或黏液样变。文献研究中大部分具有基底细胞样特征的乳腺实体型腺样囊性癌为三阴型乳腺癌,导管腺上皮CK7、CK14和CK5/6均阳性,CD117呈不同程度阳性,p63 在实性区域细胞中不表达,提示基底样细胞为相对原始的前体细胞/中间型细胞,缺乏显著肌上皮分化,但具有向导管上皮/肌上皮分化的潜能。肿瘤细胞Ki-67增殖指数相对较高,提示患者的预后较差。以往文献报道存在MYB-NFIB融合基因。鉴别诊断包括基底细胞样型乳腺癌、原发或转移性神经内分泌癌、实性乳头状癌、浸润性筛状癌等。
与经典型PACCB相比,该肿瘤细胞异型性大,胞核增殖指数高,可发生腋窝淋巴结转移,预后较差,但与浸润性导管癌的预后较好。有作者提出建议将其归为高级别,两者的临床处理与预后应有所不同。具有基底细胞样特征的乳腺实体型腺样囊性癌是否需要腋窝淋巴结清扫、术后是否进行放、化疗及具体化疗方案,尚需积累更多的病例进行深入分析。
8、小结
PACCB是一种罕见的肿瘤,具有良好生物学行为的恶性肿瘤,目前仍以手术治疗为主,术后辅以放射治疗及化疗,虽然其预后相对较好,但治疗后存在局部复发和远处转移的风险。临床医师应掌握其临床特征及免疫表型,避免漏诊、误诊,并密切随访。诊断时需结合免疫表型,并需结合影像学及临床资料进行分析,以避免漏诊。
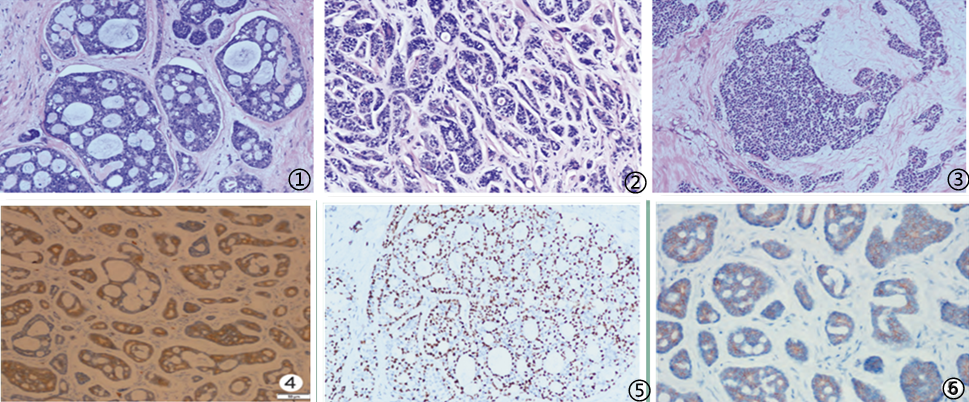
图1筛状型ACC;图2梁-管状型ACC;图3实体型ACC;图4肿瘤腺上皮CK7阳性,EnVision法;图5肿瘤肌上皮p63核阳性,EnVision法;图6肿瘤细胞CD117阳性,EnVision法
参考文献略。图片来源于网络。如有侵权,联系删除。














共0条评论