病例8 腺样囊性癌
(Adenoid Cystic Carcinoma,ACC)
【病例介绍】
患者,女,73岁,体检发现左乳2cm肿块。
【病理变化】
(1)巨检 左乳2cm肿块,灰红色,质硬,边界不清。
(2)镜检 低倍镜示肿物两个不同区域,即黏液样区域和纤维化玻璃样变性区域中散在上皮细胞深染的小管状结构或实性细胞巢,小管排列杂乱无章(图1A,图1B);两图均无显示肿瘤的具体边界。进一步放大显示部分小管管腔开放且管腔内可见絮状的嗜酸或嗜碱性分泌物,部分呈微囊性扩张,部分呈实性细胞巢(图1C);部分区域小管状结构累及到脂肪组织(图1D)。高倍镜示细胞的大小形态较一致,胞质稀少、弱嗜酸性;细胞核整体形态较温和,圆形或卵圆形,染色质较细腻,部分细胞可见明显核仁;可见核分裂象。
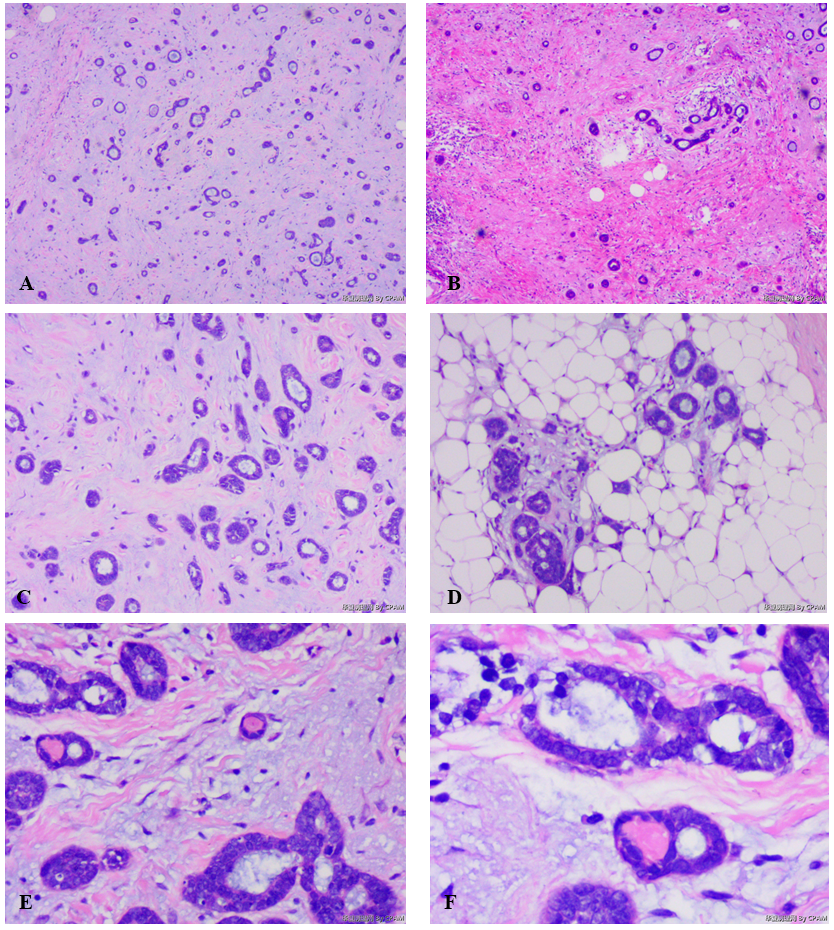 图1 乳腺腺样囊性癌。图A示黏液样区域;图B示纤维化玻璃样变区域;图C示小管状结构及实性细胞巢杂乱无章排列;图D示小管状结构累及到脂肪组织;图E、图F示小管内可见嗜酸性或黏液样分泌物,部分区域上皮似呈筛状,可见肌上皮细胞。
图1 乳腺腺样囊性癌。图A示黏液样区域;图B示纤维化玻璃样变区域;图C示小管状结构及实性细胞巢杂乱无章排列;图D示小管状结构累及到脂肪组织;图E、图F示小管内可见嗜酸性或黏液样分泌物,部分区域上皮似呈筛状,可见肌上皮细胞。
(3)免疫组化 ER(-), PR(-) ,HER2阴性(1+), EGFR(-);肌上皮标记肿瘤细胞表达情况:SMA(-), p63(少数+) , calponin(少数+), CK5/6(部分+),S100(部分+),EMA(+) ,CK18(+);CD117(+)。
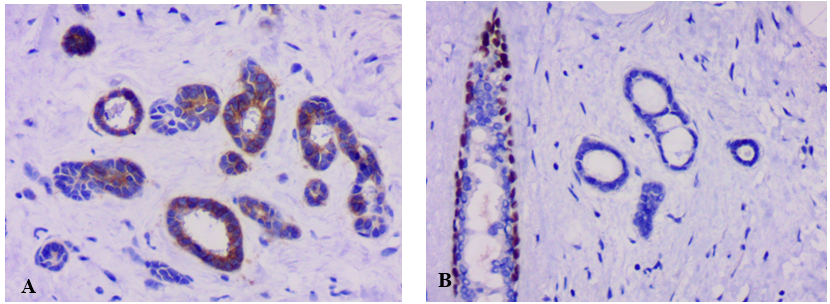 图2 乳腺腺样囊性癌IHC。A示CD117(+);B示 p63(少数+)。
图2 乳腺腺样囊性癌IHC。A示CD117(+);B示 p63(少数+)。
【讨论】
腺样囊性癌(Adenoid Cystic Carcinoma,ACC)是一种少见的肿瘤,又称癌性腺样囊肿病、腺囊性基底细胞癌、圆柱瘤样癌等,多发生于唾液腺以及头颈部相关区域,外耳道、上呼吸道、肺、消化道、皮肤、前列腺以及女性生殖器官等相继都有文献报道。
乳腺腺样囊性癌是浸润性乳腺癌的一种罕见亚型,占浸润性乳腺癌不足0.1%。2012年《WHO乳腺肿瘤分类》将其定义为:一种具有低度恶性潜能的癌,组织学类似涎腺同名肿瘤,ICD-O编码为8200/3[1]。
ACC患者多为成年女性,年龄29-80岁,平均53.9岁,罕有儿童和男性乳腺腺样囊性癌的报道[2]。两侧乳腺的任一象限均可发生,50%的肿块位于乳晕下或乳晕周围,常可触及孤立性界限清楚的肿块,肿块质地较软、呈囊性,可伴有疼痛或触痛[3]。超声检查显示界限清楚、不规则、异质性或低回声肿块。X线检查无特异性,在没有组织学证实的情况下对ACC做出正确诊断富有挑战性[6]。
ACC界限清楚,呈结节状,直径0.7-12cm,平均3cm,切面灰白灰褐色,实性,质中偏硬,亦可见微囊性改变[2,4,6]。有研究显示伴有实性生长成分的肿瘤比无实性成分的肿瘤要大,并且易于复发。
乳腺ACC的镜下特征与唾液腺、皮肤、肺等部位发生的同名肿瘤相似。ACC可见多种细胞形态,但通常主要由三种细胞构成,即腺上皮细胞、肌上皮细胞、基底样细胞,此外可有鳞状细胞化生及皮脂腺细胞分化。肿瘤生长方式主要有筛状、小管/小梁状以及实性三种构型,三种结构常混合存在呈腺囊性改变,也可呈实性片状排列。肿瘤细胞围绕形成两种形态腺腔结构,即真腺腔和假腺腔。真腺腔在病变中较少出现,为真性分泌性腺腔,腺腔通常较小;腔面衬覆立方状腺上皮细胞,细胞质较多、嗜酸性,核圆形,可有小核仁;外层为p63阳性细胞(肌上皮或基底样细胞);腺腔内常含有嗜酸/嗜碱性分泌物,PAS阳性。假腺腔由内陷的间质(间质腔)构成,可以与周围的间质相通;衬覆假腺腔的细胞为基底样细胞,细胞质少,核圆形或卵圆形,有小核仁;基底样细胞周围有肌上皮分化细胞,细胞质呈双嗜性或透明,细胞核可不规则;这些假腺腔形状不一,大多圆形,腺腔内可以是嗜酸性基底膜样物,也可以是含有毛细血管的胶原,或是黏液样变间质。间质可出现促纤维结缔组织增生性反应、黏液样变、软骨样改变以及脂肪组织。病变中很少见到坏死。部分病例有周围神经浸润,但罕见脉管内浸润。ACC可伴有腺肌上皮瘤、低度恶性腺鳞癌、微腺性腺病及不典型微腺性腺病等[1,3,5]。
该例乳腺ACC以小管状结构为主,肿瘤细胞围绕小的囊性腔隙。假性腺腔内可见基底膜样物质或黏液样间质;真性腺腔内衬腺上皮细胞,外层为肌上皮细胞。小管周围包绕胶原化玻璃样变纤维结缔组织。该型易与乳腺其他小管状病变相混淆。
与唾液腺ACC相似,乳腺ACC也是根据实性生长部分来进行分级:以筛状或管/梁状成分为主而无实性成分的ACC为I级;实性成分≤30%的ACC为II级;实性成分>30%的ACC为III级。最近,美国癌症分期联合委员会手册(第7版)推荐将Nottingham组织学分级一致的应用于所有乳腺癌。基于这一分级方案,绝大多数的ACC属于组织学1级或2级[6]。
IHC腺上皮细胞通常CD117、CK8/18、EMA、S-100蛋白和E-cadherin等阳性,ER、PR、Her-2少有阳性;鳞状/基底样细胞及肌上皮细胞CK5/6、CK14、CK34βE12、SMA、S-100、p63各有阳性;基底膜样物质表达collagen IV和laminin。Ki-67指数一般不高(没有预后意义)[5]。
与涎腺ACC 相似,乳腺ACC表现为染色体频发易位t(6,9)(q22-23,p23-24)。超过90% 的病例产生涉及MYB和NFIB的融合转录。在一例原发ACC和肾转移灶中发现PIK3CA 和PTEN 体细胞突变[1]。
ACC主要与以下疾病相鉴别[3,5]:
(1)胶原小球病:胶原小球病常为镜下伴发病变,位于终末导管小叶单位的腺管内;ACC为肉眼肿物,为独立的浸润性病变。另外,胶原小球病内的小体有特殊的结构特点,呈细丝状、放射状、线团状;而ACC中无此结构。
(2)小管癌:小管癌常伴发于平坦上皮不典型增生、低级别导管原位癌或浸润性筛状癌,常为成角的 “泪滴”状开放小管结构,衬覆单层上皮,常有胞突,ER、PR阳性,无肌上皮。
(3)高级别浸润性导管癌:细胞多形性和异型性更加明显,有显著泡状核和丰富细胞质,缺乏肌上皮,细胞外黏液不明显。
(4)低度恶性腺鳞癌:缺乏腺样囊性癌两种小管的特点,常有逗点、泪滴状小管,小管周围是富于细胞的间质,常呈洋葱皮样。
(5)浸润性筛状癌:浸润性筛状癌具有明显的筛状结构,但筛状细胞巢更不规则,筛孔衬覆细胞缺乏基底样细胞和肌上皮表达,筛孔内不是间质成分,细胞巢及筛孔内没有嗜酸性基底膜样物质。免疫组化也有助于鉴别。
乳腺ACC是一种低度恶性肿瘤,单纯乳腺切除即可治愈。最近有研究显示,辅助性放疗对于ACC患者的总体生存期具有很大的帮助。另外,乳腺保守手术后手术切缘的阳性率较高,其也可受益于辅助性放疗。虽然一些临床医师对高级别病变或腋窝淋巴结转移/远处转移患者推荐系统性辅助性化疗,但是化疗在乳腺ACC中所起的作用仍然存在争议。随着靶向治疗的发展,MYB-NFIB融合基因可能为乳腺ACC的治疗提供新的治疗途径[6]。
与其他“三阴”、基底细胞样乳腺癌以及唾液腺ACC相比,乳腺ACC具有极好的预后,5年和10年生存率分别是>95%和90%,并且很少经淋巴系统扩散以及远处转移。
【回帖精选】
1、www810910(5楼)回复:
(1)患者,女,73岁,体检发现左乳2cm肿块;
(2)左乳2cm肿块,灰红色,质硬,边界不清;
(3)镜下特征:
1)低倍镜示肿物的两个不同的区域,其一为管周型纤维腺瘤样区域,间质呈淡蓝色、黏液样,其间散在一些上皮细胞深染的小管状结构或实性细胞巢(图1);另一区域显示纤维化玻璃样变性区域中散在上皮细胞深染的小管状结构或实性细胞巢(图2),局部可见部分散在的炎细胞浸润;两图可见散在的脂肪空泡,均无小叶状结构,均无显示肿瘤的具体边界。
2)图3、图4进一步放大显示小管状结构或实性细胞巢的特征,小管排列杂乱无章,部分小管管腔开放且管腔内可见絮状的嗜酸或嗜碱性分泌物,部分呈微囊性扩张,部分呈实性细胞巢(考虑为切面原因);间质依然为黏液样或纤维化玻璃样变性;图5示小管状结构累及到脂肪组织。
3)高倍镜示小管型上皮细胞的具体特征,通观图6-图10,并没有十分典型的双层上皮结构,但图10中可以看到一些胞质内空泡的上皮细胞,提示可能为肌上皮。再看整体的上皮细胞的特点,细胞的大小形态较一致,为圆形、卵圆形、立方状,胞质弱嗜酸性;细胞核整体形态较温和,圆形或卵圆形,染色质较细腻,部分细胞可见明显核仁;未见明确的核分裂象。
通过患者的临床病史、大体观察及镜下观察,本例的诊断方向个人主要考虑为乳腺的小管性疾病,主要考虑为小管型腺病或小管癌。本例双层上皮特征不是很明显,但是图10的提示不可忽视,再者小管状结构周围的间质为纤维性硬化性间质而不是促纤维组织增生性间质,单就组织学个人还是倾向于小管型腺病的诊断。当然这样的病例免疫组化不可缺少,肌上皮标记(p63、SMA等)固然很重要,另外ER、PR、Her-2等有助于诊断。
以上纯属己见,恳请各位老师、同行批评指正!!
2、96928(9楼)回复:
诊 断:乳腺腺样囊性癌
诊断依据:肿瘤腺体看上去像涎腺的ACC,管状结构为主,一些提示周围玻变/粘液变,管腔有东东,还有一些腺体接近筛状。
鉴别诊断:小管癌、低度恶性汗腺癌等。IHC除了已提供的,CD117也常用。
3、janpathology (14楼)回复:
(1)患者,女,73岁,体检发现左乳2cm肿块;
(2)左乳2cm肿块,灰红色,质硬,边界不清;
(3)镜下特征:
1)4x镜示,图1大部分小管状结构,个别实性巢结构在间质呈淡蓝色、黏液样背景中。图2小管状结构纤维化玻璃样背景中,图5.小管状结构在间质呈淡蓝色、黏液样背景中,并浸润在脂肪中(提示浸润,恶性征)。未见乳腺小叶结构,未见肿瘤的具体边界。
2)10倍显示小管状结构开放。腔同时具有分泌嗜酸或嗜碱性分泌物。(乳腺肿瘤中同时分泌两种的物质少见,可见于腺样囊性癌和汗腺)。
3)20倍镜示小管型双层上皮结构,但图7中可以看到一些胞质内空泡的上皮细胞,提示为肌上皮。图6 图7见明确的核分裂象(少)。图7见一小管胞质红染明显。
淡蓝的粘液样背景应为癌性背景。
小管结构在乳腺的疾病包括乳腺原发(乳腺浸润癌导管癌,乳腺小管癌,乳腺微腺腺病,乳头浸润性汗管瘤性腺瘤,管状腺瘤,腺样囊性癌),汗腺来源(汗腺癌)。
浸润性导管癌,无分泌,癌性间质纤维化,无双向分泌。ER PR 阳性 ,p63-
小管癌,小管为单层,间质纤维化,开放小管,无肌上皮,泪滴样结构。无分泌,无细胞异型性。ER PR 阳性 ,p63-
微腺腺病,开放的小管加胶样分泌物,单层的上皮,而不是复层,无肌上皮。无细胞异型性。致密的胶原背景。
管状腺瘤,无细胞异型性,无癌性纤维背景。
乳头浸润性汗管瘤样腺瘤,位置没有提供。
腺样囊性癌,小管状结构,缺乏筛孔状结构的典型,但依然具有,高倍下,有双层结构(腺样和基底),提示腺样囊性癌,IHC:ER PR阳性,CK7阳性,P63基底细胞阳性,CD117 阳性,IHC支持腺样囊性癌。只是这例小管结构确实迷惑人。
【提供者单位及姓名】华夏病理网(粉蓝医疗)病理部 薛德彬(abin)
【专家点评-薛德彬老师】
答案:乳腺腺样囊性癌。9楼96298获奖。主要鉴别诊断:低级别腺鳞癌,小管癌。
小管样结构为主的腺样囊性癌比较少见。如果注意到两种腺腔(真腺腔和假腺腔,腺腔内分泌物的颜色不同),基本上可以排除腺鳞癌。
小管样结构为主,所以也要排除小管癌。
免疫组化:肿瘤细胞p63和CK5/6部分阳性,可见于腺样囊性癌和腺鳞癌,排除小管癌。CD117阳性支持腺样囊性癌。calponin小管周围没有一层一层包围的阳性梭形细胞,不支持胚鳞癌。
另,ER-/PR-,也不支持小管癌。
感谢华夏病理网(粉蓝医疗)病理部薛德彬老师提供病例,个人查阅文献整理相关内容,仅供参考学习!不当之处敬请批评指正!
【参考文献】
[1]Lakhani SR, Ellis LO, Schnitt SJ, Tan PH, van de Vijver MJ. World Health Organization Classification of tumours of the breast[M]. Lyon: IARC Press, 2012:56-57.
[2]徐炼, 魏兵, 步宏, 等. 乳腺腺样囊性癌18例临床病理分析[J]. 临床与实验病理学杂志, 2012, 28(7): 717-721.
[3]龚西騟, 丁华野. 乳腺病理学[M]. 北京: 人民卫生出版社, 2009: 357-360.
[4]杨文涛, 张廷璆, 沈铭昌, 等. 乳腺腺样囊性癌临床病理特点及文献复习[J]. 临床与实验病理学杂志, 2005, 21(1): 10-13.
[5]丁华野. 乳腺病理诊断和鉴别诊断[M]. 北京: 人民卫生出版社, 2014: 3324-326.
[6]Miyai K, Schwartz MR, Divatia MK, et al. Adenoid cystic carcinoma of breast: Recent advances[J]. World J Clin Cases, 2014, 2(12): 732–741.





 图1 乳腺腺样囊性癌。图A示黏液样区域;图B示纤维化玻璃样变区域;图C示小管状结构及实性细胞巢杂乱无章排列;图D示小管状结构累及到脂肪组织;图E、图F示小管内可见嗜酸性或黏液样分泌物,部分区域上皮似呈筛状,可见肌上皮细胞。
图1 乳腺腺样囊性癌。图A示黏液样区域;图B示纤维化玻璃样变区域;图C示小管状结构及实性细胞巢杂乱无章排列;图D示小管状结构累及到脂肪组织;图E、图F示小管内可见嗜酸性或黏液样分泌物,部分区域上皮似呈筛状,可见肌上皮细胞。 图2 乳腺腺样囊性癌IHC。A示CD117(+);B示 p63(少数+)。
图2 乳腺腺样囊性癌IHC。A示CD117(+);B示 p63(少数+)。







共0条评论