[导读] 来源:中国医学论坛报今日肿瘤
2019年12月19日,美国国立综合癌症网络(NCCN)更新了结肠癌&直肠癌临床实践指南,分别从2019.V4 & 2019.V3到2020.V1,指南中对病理检查原则(COL-B) & (REC-B)做了详细更新,同时特别邀请了复旦大学附属肿瘤医院的盛伟琪教授和南京大学医学院附属鼓楼医院的樊祥山教授对NCCN指南中的病理更新要点进行了解读。

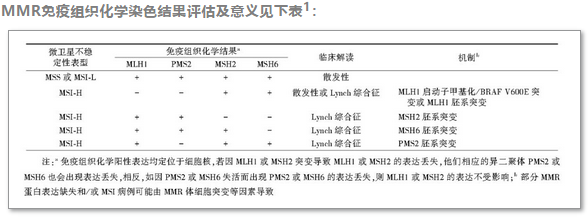
MSI/MMR检测在肠癌筛查、预后分层和疗效预测等方面都有明确指导意义。检测方法也较成熟,MSI一般采用PCR方法检测美国国家癌症研究院(NCI)推荐的5个微卫星(MS)位点(BAT25,BAT26,D5S346,D2S123和D17S250)。有条件的情况下可以检测更多位点。MMR蛋白的免疫组织化学检测,需同时检测4个常见MMR蛋白(MLH1、MSH2、MSH6和PMS2)的表达,免疫组织化学检测的质量控制对其结果的准确性非常重要。
目前在结直肠癌中尚无权威机构获批的HER2相关伴随诊断方法和判读标准,NCCN结肠癌&直肠癌临床实践指南2020.V1中提出的HER2阳性定义是来自于一项开放性随机对照II期临床研究入组标准,我们仍需要更多临床数据来支持和验证结直肠癌HER2的检测方法和判读标准。NGS检测方法其优势在于基因突变检测,基因拷贝数变异(CNV)需要通过特定算法进行HER2扩增的判断。NGS可作为HER2扩增的筛查方法,尚不能替代HER2基因扩增检测的金标准—FISH。
在结直肠癌中NTRK融合基因虽然罕见,但仍给标准治疗失败的患者提供了一个额外的治疗机会。FDA和CE批准了免疫组织化学染色Pan-TRK作为一种经济的方法进行TRK蛋白过表达初筛,对NTRK融合基因需使用FISH或NGS方法进行验证。但需注意的是建议使用获得批准的检测试剂盒进行检测。

虽然新的NCCN指南仅把TBs但暂时并没有将PDCs纳入病理报告系统当中,但PDCs的临床意义与TBs相似。PDCs是指肿瘤浸润灶边缘出现≥5个细胞组成的缺乏腺管分化的癌细胞团,PDCs分级如下:200倍镜下计数最丰富区一个视野内PDC数目——0级无PDCs、1级1-4个、2级5-9个、3级≥10个;0级和1级为低级别,2级和3级为高级别。
MSI/MMR的检测在结直肠癌中的临床意义明确,检测标准化及规范化仍然是需要临床和病理关注的重要影响因素,免疫组化蛋白检测是MSI检测非常有效的筛查手段,但精准化检测的前提是必须对其检测和评估两方面都要注重室内外质控和人员培训,并且MMR的准确性检测离不开标本的规范化前期处理,如及时剖开固定等。
MSI检测一般按NCI工作组推荐的5个位点进行检测,5个位点中有2个或2个以上为高度不稳定性,就定义为MSI-H,1个位点不稳定则为低度不稳定性。NGS可以检测更多位点,且准确性高,但价格较昂贵,可以需要根据临床需求进行方法选择。
病理检查原则(COL-B)&(REC-B)中更新内容如下1. 病理学检查原则病理分期章节中,新增了一项“肿瘤出芽”第一处修改为:对于所有新诊断的结直肠癌的患者对于所有存在结肠癌或直肠癌个人史的患者,都建议常规检测MMRa或MSIa。
第二处修改为:MSI检测可采用PCR或经验证的二代基因组测序(NGS)方法,NGS特别适用于需要同时进行RAS和BRAF基因分型的转移性结直肠癌患者。
第三处修改为:免疫组织化学(IHC)检测发现MLH1表达异常后,应对肿瘤进行BRAF V600E突变检测。BRAF V600E突变一般见于散发性结直肠。但如果患者有明显家族史,依据BRAF V600E突变检测来筛查胚系突变的患者,需非常谨慎。然而,约有1%的MLH-1缺失的林奇综合征患者可表达BRAF V600E突变。
脚注a更新为:IHC检测MMR蛋白和DNA分析检测MSI是不同的检测手段,反映由MMR基因功能缺陷引起的不同生物学效应同一生物学效应。
HER2检测
检测方法有IHC、荧光原位杂交(FISH)和NGS。
IHC检测HER2阳性定义为:大于50%的肿瘤细胞呈现3+阳性着色,即细胞膜的基底和侧边或侧边或整个胞膜呈强阳性着色。HER2评分为2+的患者应通过FISH检测进一步明确HER2基因状态。HER2基因扩增的阳性定义为大于50%的肿瘤细胞HER2/CEP17比值≥2.011-13。NGS是检测HER2扩增的另一种可选方法14。
抗HER2治疗仅适用于HER2扩增且RAS和BRAF野生型的肿瘤。
NTRK融合
NTRK融合在结直肠癌中非常罕见15。在2314例结直肠癌队列中,NTRK融合总发生率约为0.35%,仅限于RAS和BRAF泛野生型的结直肠癌。在一项8例携NTRK融合的结直肠癌患者的研究中发现,在这个亚群中有7例表现为dMMR(MLH-1)/MSI-H16。这些研究结果支持应对KRAS/NRAS/BRAF野生型、且伴有MMR缺陷(dMMR)/MSI-H的结直肠癌患者进行NTRK融合检测16。
NTRK抑制剂仅对携带NTRK融合的患者有效,对NTRK突变的患者无效。
检测NTRK融合的方法有IHC17、FISH、基于DNA的NGS和基于RNA的NGS15,18。一项研究显示,与基于RNA的测序相比,基于DNA的测序检测NTRK融合的总体敏感性和特异性分别为81.1%和99.9%,IHC总体敏感性和特异性分别为87.9%和81.1%。由于IHC方法判断为NTRK融合的肿瘤中5个约有1个为假阳性,因此IHC检测阳性的肿瘤应通过RNA NGS法进行验证。该研究还指出,基于RNA的测序方法似乎是检测NTRK融合的最佳方法,因为内含子的剪接简化了对覆盖率有要求一定的技术难度,而且在RNA水平发现融合为功能性转录提供了直接证据18。但是,选择哪种合适的NTRK融合检测方法取决于肿瘤的类型、涉及的基因和其它因素的考虑,例如可用的材料、获取各种临床检测方法的条件以及是否需要同时进行全面的基因组检测18。
参考文献:
1. 《结直肠癌分子生物标志物检测专家共识》编写组, 中华病理学杂志, 2018年4月第47卷第4期, Chin J Pathol, April 2018, Vol.47, No.4.
2. Lugli A, Kirsch R, Ajioka Y, et al. Recommendations for reporting tumor budding in colorectal cancer based on the International Tumor Budding Consensus Conference (ITBCC) 2016. Mod Pathol 2017;30:1299-1311.
3. Lee VWK, Chan KF. Tumor budding and poorly-differentiated cluster in prognostication in Stage II colon cancer. Pathol Res Pract 2018;214:402-407.
4. Romiti A, Roberto M, Marchetti P, et al. Study of histopathologic parameters to define the prognosis of stage II colon cancer. Int J Colorectal Dis 2019;34:905-913.
5. Costas-Chavarri A, Nandakumar G, Temin S, et al. Treatment of patients with early-stage colorectal cancer: ASCO Resource-Stratified Guideline. J Glob Oncol 2019;5:1-19.
6. Koelzer VH, Zlobec I, Lugli A. Tumor budding in colrectal cancer – ready for diagnostic practice? Hum Pathol 2016;47:4-19.
7. Bosch SL, Teerenstra S, de Wilt JH, et al. Predicting lymph node metastasis in pT1 colorectal cancer: a systematic review of risk factors providing rationale for therapy decisions. Endoscopy 2013;45:827-834.
8. Brown IS, Bettington ML, Bettington A, et al. Adverse histological features in malignant colorectal polyps: a contemporary series of 239 cases. J Clin Pathol 2016;69:292-299.
9. Backes Y, Elias SG, Groen JN, et al. Histologic factors associated with need for surgery in patients with pedunculated T1 colorectal carcinomas. Gastroenterology 2018;154:1647-1659.
10. Pai RK, Chen YW, Jakubowski MA, et al. Colorectal carcinomas with submucosal invasion (pT1): analysis of histopathological and molecular factors predicting lymph node metastasis. Mod Pathol 2017;30:113-122.
11. Valtorta E, Martino C, Sartore-Bianchi A, et al. Assessment of a HER2 scoring system for colorectal cancer: results from a validation study. Mod Pathol 2015;28:1481-1491.
12. Evaluation of Trastuzumab in Combination With Lapatinib or Pertuzumab in Combination With Trastuzumab-Emtansine to Treat Patients With HER2-positive Metastatic Colorectal Cancer (HERACLES). https://clinicaltrials.gov/ct2/show/NCT03225937
13. Sartore-Bianchi A, Trusolino L, Martino C, et al. Dual-targeted therapy with trastuzumab and lapatinib in treatment-refractory, KRAS codon 12/13 wild-type, HER2- positive metastatic colorectal cancer (HERACLES): a proof-of-concept, multicentre, open-label, phase 2 trial. Lancet Oncol 2016;17:738-746.
14. Cenaj O, Ligon AH, Hornick JL, et al. Detection of ERBB2 amplification by next-generation sequencing predicts HER2 expression in colorectal carcinoma. Am J Clin Pathol 2019;152:97-108.
15. Solomon J, Hechtman JF. Detection of NTRK fusions: Merits and limitations of current diagnostic platforms. Cancer Res 2019;79:3163-3168.
16. Cocco E, Benhamida J, Middha S, et al. Colorectal carcinomas containing hypermethylated MLH1 promotor and wild-type BRAF/KRAS are enriched for targetable kinase fusions. Cancer Res 2019;79:1047-1053.
17. Hechtman JF, Benayed R, Hyman DM, et al. Pan-Trk immunohistochemistry is an efficient and reliable screen for the detection of NTRK fusions. Am J Surg Pathol 2017;41:1547-1551.
18. Solomon JP, Linkov I, Rosado A, et al. NTRK fusion detection across multiple assays and 33,997 cases: diagnostic implications and pitfalls. Mod Pathol 2019 [Epub ahead of print].
















共0条评论