[导读] 编译整理:强子
随着分子遗传学研究的进展,目前临床病理实践中分子相关检测的应用已越来越广泛。作为病理医师角度来说,如果能从形态学层面发现分子遗传学改变的“蛛丝马迹”,将为后续分子遗传学检测、乃至临床诊疗方案的制定提供极大帮助。本期我们选择印度全印医学科学院(All India Institute of Medical Sciences)病理专家等在美国病理学家协会(College of American Pathologists,CAP)官方期刊《Archives of Pathology & Laboratory Medicine》就SMARCA4/BRG1缺失非小细胞肺癌所撰写的文章进行编译,希望有助于各位病理同仁对该病变的了解和掌握。
前言
哺乳动物switch/蔗糖非发酵复合体(mammalian switch/sucrose non-fermenting complex,mSWI/SNF)是一个高度保守的ATP酶依赖性染色质重塑单位,涉及多种生化功能。该复合物构成两个互斥催化亚基中的一个,分别是由SMARCA2编码的Brahma(BRM)、由SMARCA4编码的Brahma相关基因1(Brahma-related gene 1,BRG1);同时涉及诸多总称为Brg1/Brm相关因子(Brg1/Brm-associated factor,BRF)的核心亚基。mSWI/SNF单个成员之一的突变,是最常见遗传学改变之一。约20%的人类癌症中可见mSWI/SNF单个成员之一突变,其中最著名的应属BAF47或INI-1亚基编码的SMARCB2胚系突变。该突变会导致横纹肌样肿瘤易感综合征(rhabdoid tumor predisposition syndrome),其特点为发生具有高度侵袭性的婴儿恶性横纹肌样肿瘤,免疫组化中具有INI-1的缺失。不过,SMARCB4的胚系突变也会导致免疫组化BRG1阴性(而不是INI-1阴性)恶性横纹肌样肿瘤的发生,而临床和组织学上与横纹肌样肿瘤易感综合征无法区别。SMARCB4的突变也是卵巢高钙血症型小细胞癌的单一驱动性异常。这种侵袭性肿瘤多见于年轻女性,病理方面表现为小细胞、横纹肌样形态,且免疫组化BRG1阴性。
2015年,Loarer等报道了一组高度侵袭性的胸部肉瘤,这组病例发生于成人男性,多具有横纹肌样形态,且均有体细胞性SMARCA4突变和免疫组化BRG1缺失。该组肿瘤类似恶性横纹肌样肿瘤、卵巢高钙血症型小细胞癌,但却有本质的不同,比如该肿瘤遗传学不稳定性增强、常见TP53突变、肿瘤突变负荷更高、并无SMARCA4的胚系异常。该组肿瘤常表达CD34、SALL4、SOX2,对常规治疗无效,常在数月内死亡。
除肉瘤外,SMARCA4/BRG1缺失在部分成人低分化/未分化癌中的报道也越来越多,相关病变部位也很宽泛,比如肺部等。尽管近二十年来,文献中已有非小细胞肺癌细胞系、非小细胞肺癌肿瘤标本中SMARCA4体细胞性突变和/或BRG1免疫组化阴性的相关报道,但直至近些年才将SMARCA4缺失型非小细胞肺癌视为一种特殊的非小细胞肺癌亚型。已有部分作者提出,这组肿瘤可能对免疫治疗有效。不过,目前对于这组肿瘤的形态学描述甚少;有两组研究报道这部分肿瘤免疫组化一般不表达TTF-1,常表达CK7、Hep Par1。尽管最近有研究基于分子遗传学证据提出SMARCA4缺失型胸部肉瘤是SMARCA4缺失型非小细胞肺癌中的未分化类型,但准确鉴别两者还是有显著意义,因为前者的预后更差。
有鉴于此,本文详细描述了4例SMARCA4缺失型非小细胞肺癌的形态学特征及免疫组化表现,希望有助于我们对该肿瘤类型的认识。
研究内容及结果
该研究选择作者所在单位最近6年内诊断的非小细胞肺癌病理,复阅切片并按照最新版世界卫生组织肿瘤分类进行重新诊断。对相关病例进行免疫组化BRG1、BRM检测,其中BRG1阴性病例再进行TTF-1、p40、Hep Par1、CK7、CK20、CD34、SALL4、SOX2、CgA、Syn、INI-1、cyclin D1、p53、ALK、ROS1免疫组化检测。相关抗体信息及分子遗传学检测信息,详见原文。同时,本文还纳入了一例SMARCA4缺失型胸部肉瘤病例供对比。相关临床信息等均来自相关病案。
研究结果
总计进行BRG1、BRM免疫组化的非小细胞肺癌病例100例,患者确诊时年龄平均为58岁,男女之比为5.5:1。相关病例主要为肺切除(n=96),其余颈部淋巴结切除活检2例,楔形活检2例。组织形态学诊断具体为:鳞癌48例,腺癌38例,腺鳞癌5例,大细胞癌5例,非特殊类型非小细胞癌4例。
上述病例中,仅有4例为BRG1免疫组化阴性(4%),且均为完全阴性。这4个病例均为男性患者,2例有吸烟病史;3例为无法切除/转移性病变。
组织学方面,病例1和2均为相对均一的大而多边形肿瘤细胞,胞质透明,呈片状及巢状排列;病例3和4的肿瘤细胞多形性更为明显,有显著核仁。所有病例均多见核分裂、常见坏死。病例1和3中炎症表现显著。所有病例组织学表现均相对单一,并无显著的形态学异质性、无分化较好的病灶。
免疫组化方面,这4个病例的BRM表达均有所降低,其中病例3和4为完全阴性,而病例1中肿瘤细胞的表达强度相比正常细胞(血管内皮细胞、炎症细胞)来说要显著降低,病例2中的表达具有异质性,背景肿瘤细胞阳性表达而部分肿瘤细胞表达缺失。
其余免疫组化指标方面,4例SMARCA4缺失型非小细胞肺癌均不表达TTF-1(病例4中个别肿瘤细胞阳性)、p40(病例3中个别肿瘤细胞阳性)、CgA、Syn、CK20、cyclin D1、ALK、ROS1,INI-1仍均为阳性。CK7表达结果不一,病例1和2为弥漫强阳性,而病例3和4为局灶阳性。Hep Par1在病例1中有个别肿瘤细胞阳性,病例3中为局灶阳性。干细胞标记(CD34、SALL4、SOX2)中除SALL4外均为阴性,而SALL在病例3和3中为弥漫、弱阳性。P53在病例3和4中为弥漫强阳性,在病例1中为全阴性,而在病例2中为野生型表达。
其余信息方面,所有4个病例均未测出EGFR的热点区突变。1例II期患者根治性切除后并未进行辅助治疗,术后12个月随访仍无病生存(病例1);而1例在活检后2周内即死亡(病例4),可能死于肿瘤相关并发症,不过该例患者家属并未同意进行尸检。另外两例的预后信息未知。
文中所涉及的1例SMARCA4缺失型胸部肉瘤患者表现为胸部肿物而无肺部肿物。组织学上表现为形态单一的较大肿瘤细胞,局灶有横纹肌样表型。核分裂、坏死多见,但炎症并不明显。免疫组化BRG1和BRM均为完全阴性。其余免疫组化指标表达和SMARCA4缺失型非小细胞肺癌相似,但干细胞标记SOX2、CD34、SALL4均为弥漫强阳性。该例患者活检后病情平稳出院,但数天后在家期间晕倒并很快死亡。
有趣的是,21例非小细胞肺癌中发现有BRM的免疫组化阴性或表达降低而BRG1仍为阳性的情况。有15例为BRM完全阴性,其中8例为腺癌,5例为鳞癌,1例为腺鳞癌,1例为大细胞癌。有6例为BRM表达降低,其中3例为腺癌,2例为腺鳞癌,1例为鳞癌。大部分(8/11)BRM缺失型腺癌为腺泡或乳头状结构为主,仅3例为实性结构为主。
图例赏析
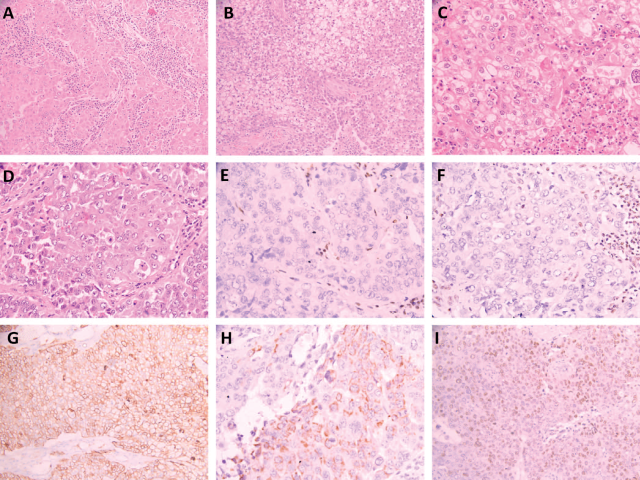
图1. SMARCA4缺失型非小细胞肺癌形态学及免疫组化表现。病例1中肿瘤细胞呈片状、小叶状排列,且分隔内伴显著淋巴-浆细胞浸润(A);病例1(B)和2(C)中可见大而多边形肿瘤细胞,胞质透明,细胞分界清晰;病例3中(D)可见大而多形性的肿瘤细胞成片排列,有显著的嗜酸性核仁。免疫组化肿瘤细胞BRG1阴性(E)、BRM阴性(F),内皮细胞及炎性细胞可作为内对照。病例1中CK7为弥漫阳性(G);病例3中Hep Par1局灶表达(H),且SALL4为细胞核弥漫、弱阳性(I)。
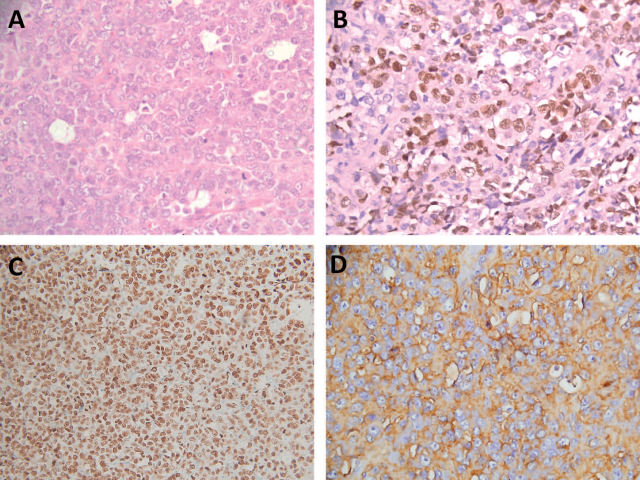
图2. SMARCA4缺失型胸部肉瘤形态学及免疫组化特点。肿瘤细胞形态单一,相对较大,排列呈片状,常见坏死(A);免疫组化弥漫强阳性表达SALL4(B)、SOX2(C)、CD34(D)。
参考文献
Nambirajan A,Singh V,Bhardwaj N,et al.SMARCA4/BRG1-Deficient Non-Small Cell Lung Carcinomas: A Case Series and Review of the Literature[J].Archives of pathology & laboratory medicine,2020.
DOI:10.5858/arpa.2019-0633-OA
美国病理学家协会(College of American Pathologists,CAP)官方期刊《Archives of Pathology & Laboratory Medicine》















共0条评论