[导读] 作者:张波;来源:江苏省人民医院肾内科
C3肾炎
C3GN是由于获得性或遗传性原因导致补体替代途径(APC)替代途径过度活化,导致C3沉积占优势的肾炎。APC过度激活的最常见机制是产生针对C3转化酶的自身抗体,称为C3肾炎因子(C3NeF),它可稳定转化酶并导致通路过度激活。C3NeF也通常存在于DDD(以前为MPGN II型)中。相反,有些患者可能存在APC调节蛋白(例如CFH,CFI,MCP/CD46和CFHR)突变。这些突变会在非典型溶血性尿毒症综合征中引起补体调节异常。最后,在造血肿瘤(最常见的是浆细胞发育不良)的情况下,单克隆免疫球蛋白可以激活APC。APC的过度激活导致C3在肾小球中沉积,诱发炎症反应并导致肾小球损伤。在许多患者中,C3GN的发展都伴随着补体放大病症(如感染)的发生。有趣的是,已经注意到一些感染后的肾小球肾炎患者表现出持续的C3沉积而不是完全恢复,并且这种所谓的“缓解/非典型”感染后肾小球肾炎被认为诱发了APC异常患者C3GN的发生。
C3GN患者出现的年龄取决于其潜在的发病机理。由APC异常引起的C3GN通常出现在儿童期或成年期,而单克隆球蛋白病引起的C3GN通常出现在成年晚期。在大多数情况下,表现为血尿和轻度到大量蛋白尿。感染史并不罕见。活检中表现出膜增生性特征的病例通常伴有更严重的蛋白尿。慢性肾功能衰竭的存在提示肾组织存在不可逆的纤维化。补体C3水平通常会降低,但正常C3水平并不排除C3GN。C4水平通常是正常的。大约50%的病例中存在C3NeF。遗传检测可能会发现补体替代途径的组成部分(例如CFH,CFI,MCP / CD46和CFHR)中的突变。在老年人中,对于已有造血系统恶性肿瘤的病史,但是没有单克隆球蛋白病病史的患者,应建议通过蛋白质电泳和/或轻链分析进行检查。这些患者的治疗应围绕解决潜在的单克隆球蛋白病。对于补体异常导致的C3GN,目前已尝试了多种治疗方法,抗C5治疗抑制补体在部分患者中有效,血浆置换术则用于自身抗体介导的疾病。多达50%的病例中最终发展为终末期肾脏疾病,同种异体移植容易复发。
光镜
大多数患者表现为以肾小球系膜细胞增生为特征的膜增生性病变。其中部分患者表现为毛细血管内增生,包括毛细血管袢内的嗜中性粒细胞浸润,类似于感染后肾小球性肾炎的渗出性变化。毛细血管内增生的患者通常伴有新月体形成。另一部分患者表现出系膜增生和基底膜双轨,伴或不伴毛细血管内增生和新月体。小管间质则为不同程度的纤维化和萎缩。血栓性微血管病很少出现在C3GN患者中,可能与APC失调的共同病理生理通路相关。
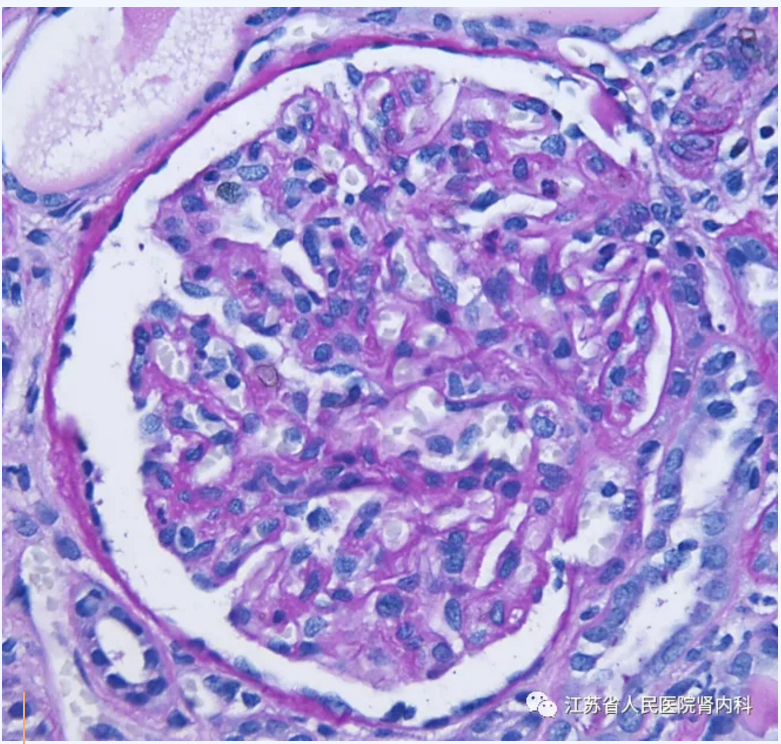
图1 PAS 系膜增生不伴毛细血管内增生及新月体
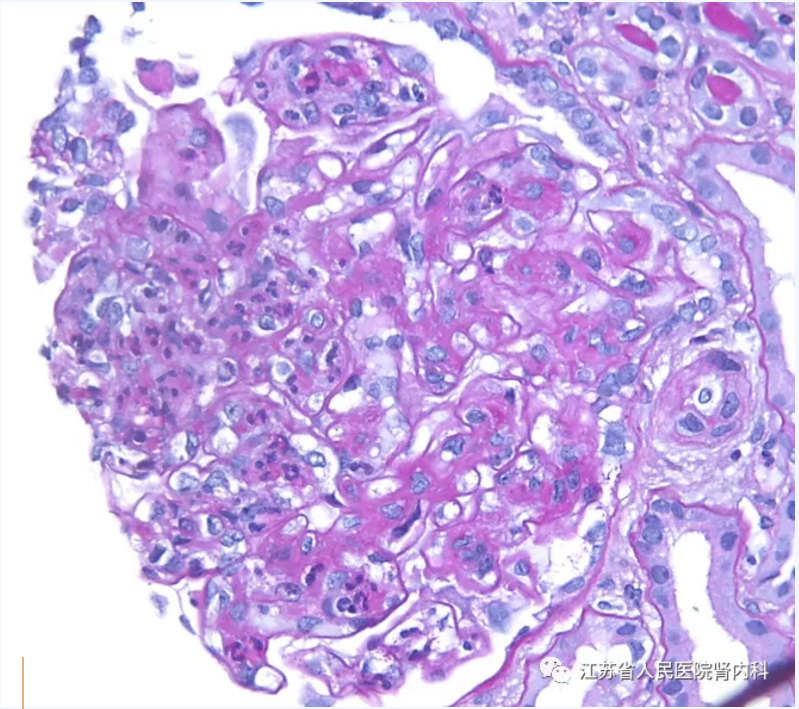
图2 毛细血管内增生伴中性粒细胞浸润

图3 新月体,上皮细胞增生伴基底膜破裂
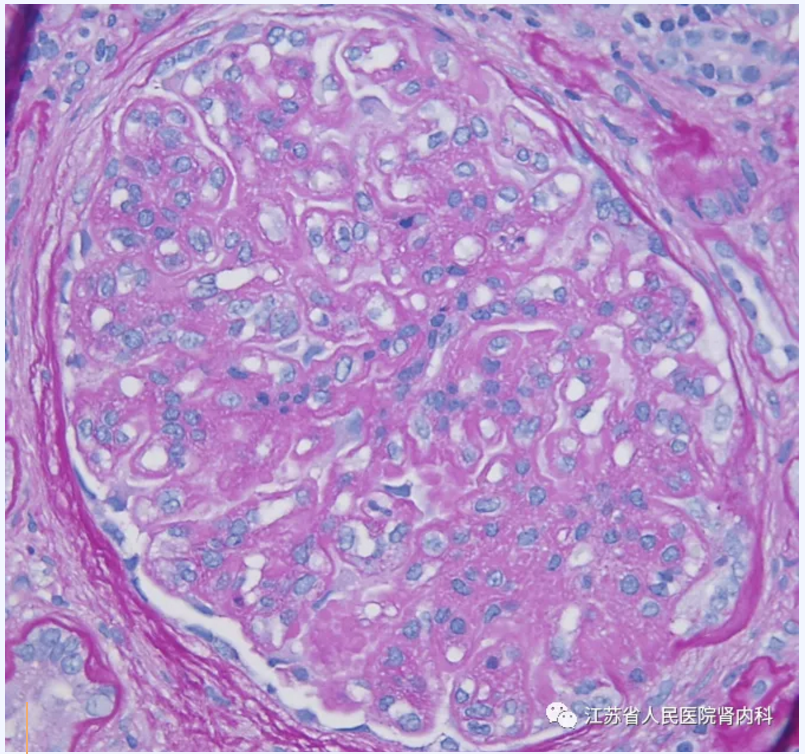
图4 膜增生性病变(系膜增生、毛细血管内增生、基底膜双轨)
免疫荧光
C3GN定义为肾小球中C3沉积为主。大多数病例表现为C3强阳性,而免疫球蛋白的沉积无或很少。但是,只要C3沉积强度至少强2级(例如:C3:3 +,IgG:1+),就可以考虑C3GN的诊断。颗粒状C3沉积的模式通常与光镜表现相关。系膜增生型C3GN可见典型的系膜C3沉积,系膜加毛细管壁的C3沉积通常与C3GN的毛细血管内增生或膜增生改变相关。C4d通常为阴性或显示弱阳性,在某些情况下可用于区分C3GN和感染后的肾小球肾炎。
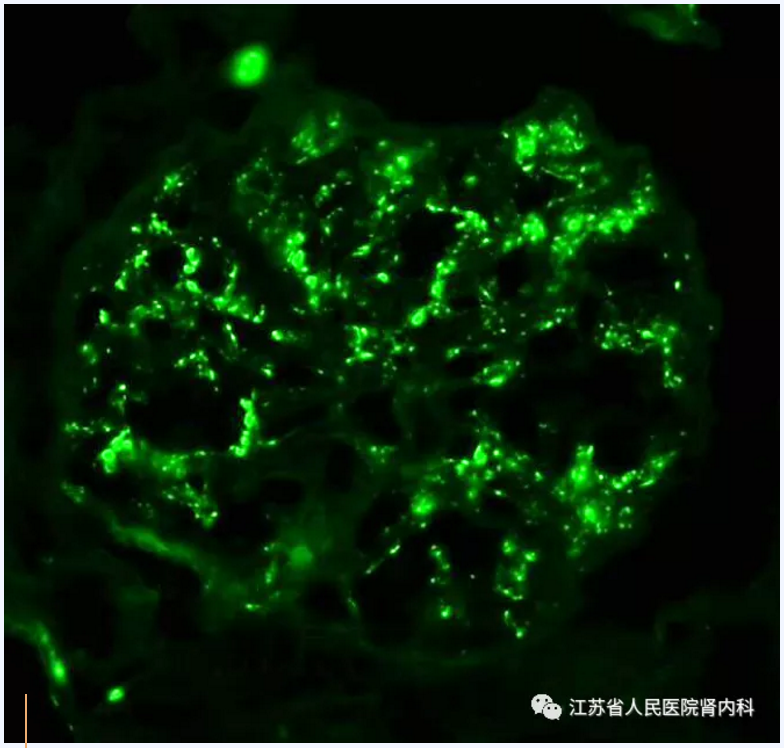
图5 系膜区颗粒状C3沉积
电镜
系膜无定形电子致密沉积物沉积通常见于系膜增生型C3GN中。额外的内皮下沉积物通常是提示毛细血管内细胞增生。偶尔也可能存在上皮下或膜内沉积物。尽管C3GN的沉积物是电子致密的,但不存在融合的高致密沉积物,因此可以区别于DDD。
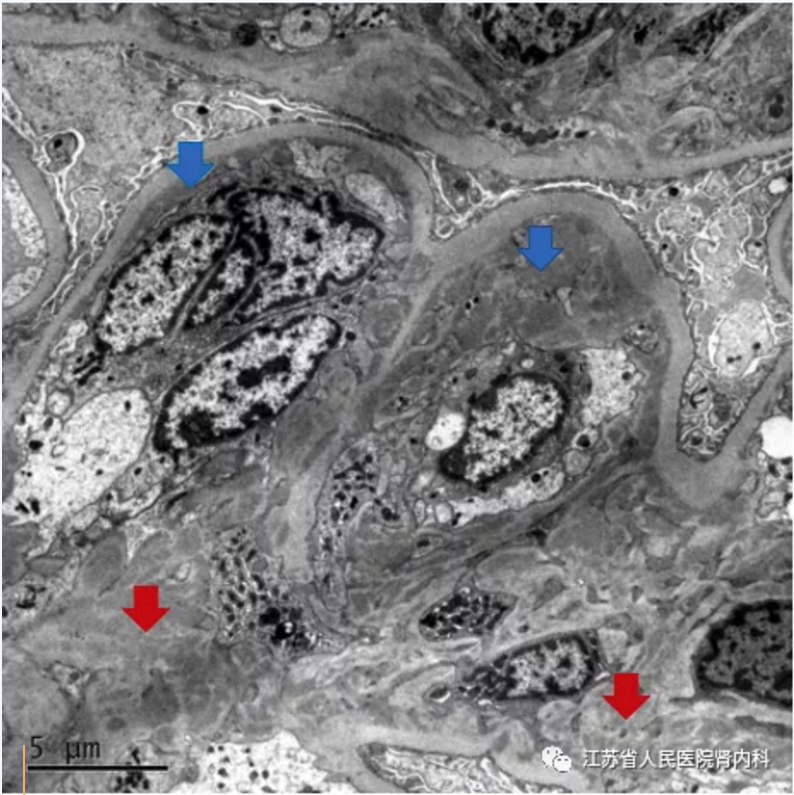
图6 大量的肾小球系膜(红色箭头)和内皮下(蓝色箭头)电子密集沉积物



















共0条评论