[导读] 来源:BREASTPATHOL;作者:张璋; 审阅:李新军 魏兵
尽管多数乳腺病变能通过仔细的镜下评估进行诊断;一些乳腺病变由于其不典型的病理特征或不同病变之间的形态学重叠性,导致了一定程度的诊断困难。对于这些病例,免疫组织化学染色(Immunohistochemistry,IHC)是非常有用的辅助工具。但是,IHC不能取代组织形态学诊断,它们只能是在结合临床和形态学的基础上,协助病理医生做出正确的诊断。免疫组化在乳腺病理中的应用范围主要有以下情况。
一、 鉴别原位癌和浸润性乳腺癌:
原位癌和浸润癌的根本区别在于癌细胞是否已经穿越肌上皮细胞和基底膜,进入周围间质组织。在这方面,肌上皮细胞标记,如P63、Calponin、SMMHC、SMA、CK5、CK14、CK17等都非常有帮助。因为它们在肌上皮细胞中的表达,所以可以用于证实肌上皮细胞是否存在。基底膜IHC标记,如胶原蛋白Ⅳ或Laminin,也有同样的功能,但它们的特异性不如肌上皮标记,而且它们常常在原位癌中表达减弱。对于微浸润乳腺癌,ADH-5(CK5/CK 14/p63/CK7/CK18抗体的组合)可以更好的找出单个细胞或小灶的浸润性癌的存在。
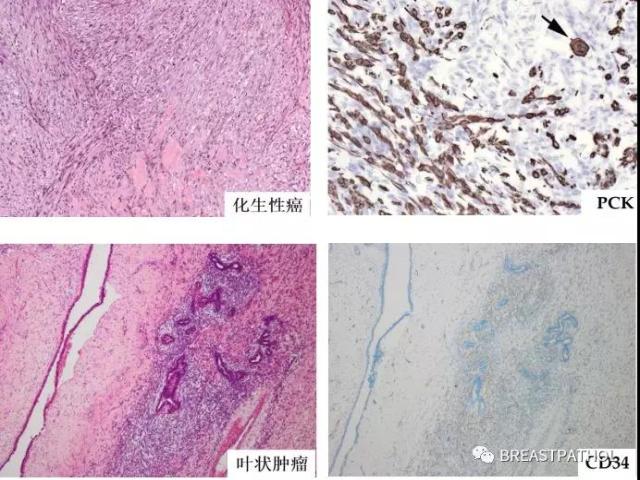
例外情况:1)腺样囊性癌(Adenoid Cystic Carcinoma, ACC)和化生性癌(Metaplastic Carcinoma),都是浸润性癌,但它们都能表达肌上皮细胞,注意这些细胞的具体分布情况在鉴别诊断中至关重要。2)微腺腺病(Microglandular adenosis, MGA),是良性非浸润性病变。但它没有肌上皮存在,也不表达雌激素受体(Estrogen receptor, ER),孕激素受体(Progesterone Receptor,PR),却表达S-100,需要与小管癌鉴别。
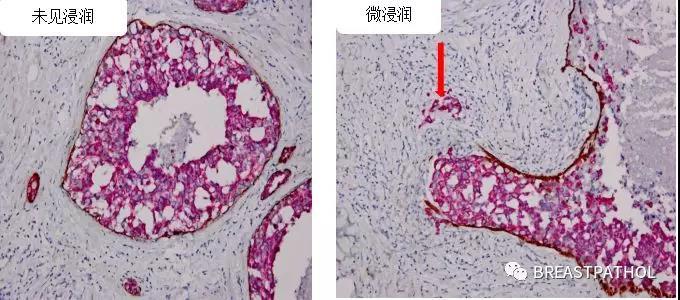
ADH-5免疫组化抗体示微浸润癌肌上皮消失
二、鉴别导管原位癌和小叶原位癌
由于导管原位癌(Ductal carcinoma in situ, DCIS)和小叶原位癌(Lobular carcinoma in situ,LCIS)有不同临床表现和临床意义,它们的临床处理包括影像检测,临床随访以及外科治疗都很不一样,所以对它们的鉴别诊断十分重要。在多数情况下,仔细评估HE切片就能给出明确的诊断,然而两种小叶原位癌的变形:旺炽性小叶原位癌(Florid LCIS)和多形性小叶原位癌(Plemorphic LCIS)跟低级别或高级别导管原位癌伴中央坏死,有时候很难区别。这个时候,几个IHC标记物可以帮助它们的鉴别诊断:1)E-cadherin:是细胞黏附蛋白,它在多数小叶癌中缺乏表达,但有时候它也可以有不完全缺失,表现为变异的表达。2)P120-catenin:在小叶病变中,P120缺乏膜表达,而只有细胞浆表达,因此可以用于小叶癌的辅助诊断。3)β-catenin:在小叶病变中,β-catenin失去膜表达,也可以辅助小叶癌的诊断,特别是E-cadherin/ P120-catenin有变异表达时。
例外情况:约10%的小叶癌有不同程度的E-cadherin的表达,这时加入P120和β-catenin,再结合临床病变形态学,可以帮助正确诊断。
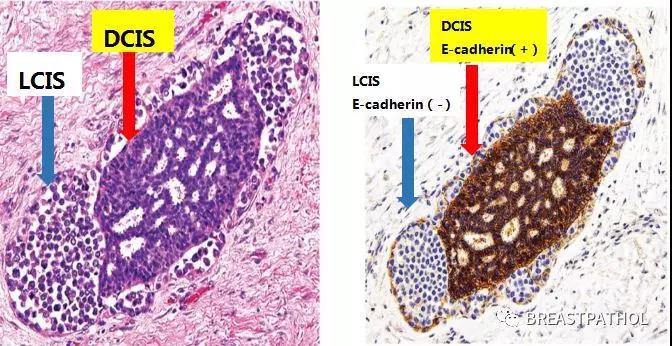
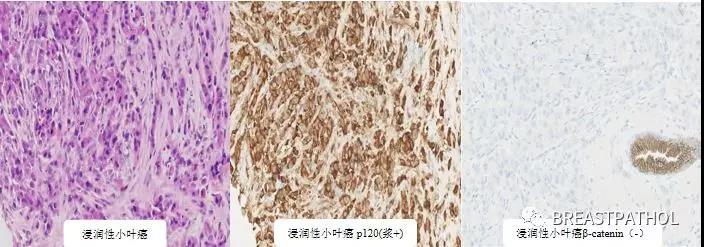
摘自《Rosen’s Breast Pathology》
三、鉴别普通型导管增生和非典型导管上皮增生/低级别DCIS
普通型导管增生(Usual dutal hyperplasia,UDH)是一种混合细胞的导管内增生,包括腺腔上皮,肌上皮细胞,以及化生性上皮细胞,它不是癌前病变,也不具有特别的分子学特征。非典型导管上皮增生/低级别DCIS (Atypical dutal hyperplasia,ADH/low grade DCIS,LG-DCIS)是单一的腺腔上皮细胞增生,是克隆性生长,属于癌前病变。它的病变细胞一般较小,有较高的一致性。最常用于鉴别诊断的IHC是CK5。在UDH, 由于是多种细胞的同时增生,CK5着色应该是阳性阴性细胞混合存在;在ADH,由于只是单一的腺腔细胞的增生,CK5着色为阴性的,只在周围的肌上皮细胞中有表达。
例外情况:高级别DCIS(High grade DCIS,HG-DCIS),如基底样型DCIS,CK5可以强阳性;这时必须与UDH鉴别,它的细胞一般是高核级,常见核分裂,伴有中央坏死,ER,PR常阴性。

四、鉴别各类乳头状病变
多数情况下,乳头状病变的诊断不需要IHC辅助,但如果存在硬化性改变,或旺炽性增生,正确诊断乳头状病变可能非常困难,这时,IHC标记很有帮助。导管内乳头状瘤(Intraductal papilloma, IP)的纤维血管轴心衬覆肌上皮细胞,如果有ADH/DCIS区域存在,纤维血管轴心局部消失,被筛状或实性的低级别的肿瘤细胞取代。导管内乳头状癌(Intraductal pallilary carcinoma, IPC):纤维血管轴心上肌上皮细胞消失,但周围管壁的肌上皮仍然存在,通常为低级别的肿瘤细胞。实性乳头状癌(Solid papillary carcinoma, SPC):它通常以单个较大的肿瘤或多个小肿瘤巢组成,它的细胞通常为低级别,或梭形或浆细胞样,常常有粘液存在;另一大特点是纤维血管轴心不明显,60-70%的SPC有不同程度的神经内分泌标记的表达。它的周围管壁肌上皮可以存在,也可以消失。只要它的癌巢周围的管壁依然是光滑的,它就仍然属于原位癌。包裹性乳头状癌(Encapsulated papillary carcinoma, EPC):纤维血管轴心和周围管壁的肌上皮细胞同时消失、病变周围有一层很厚的纤维囊壁。
例外情况:腺肌上皮肿瘤:是肌上皮围绕腺上皮细胞生长的肿瘤,可以成乳头状生长,这时很难与乳头状瘤区分开来,肌上皮IHC能显示肌上皮多于腺上皮。如果核分裂增加或坏死存在,要鉴别恶性肌上皮瘤,它常有淋巴结转移。

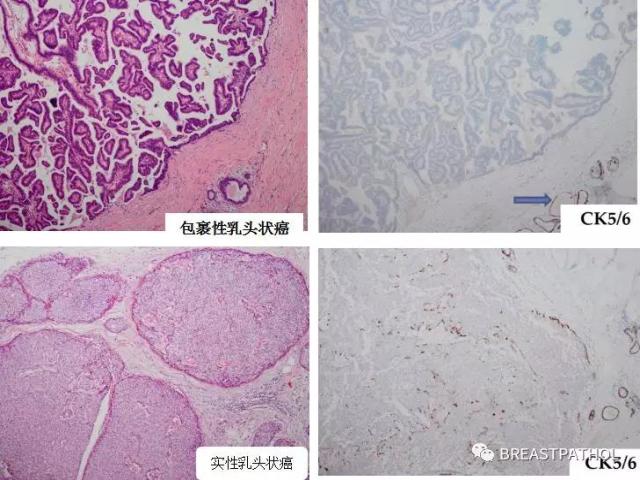
五、鉴别梭形细胞病变
尽管乳腺的梭形细胞病变很多,但是临床上最重要的梭形细胞病变只有两个,化生性癌和叶状肿瘤。1)化生性癌:这些癌细胞可以看似非常温和,它包括一大组形态各异的肿瘤,它们的共同特点就是ER、PR和HER2阴性。高分子量蛋白(CK5、CK14、CK17、AE1/AE3、34βE12)和P63不同程度的阳性,请注意这些标记物的阳性可以是非常局部的弱阳性表达。2)叶状肿瘤:它是上皮细胞和间质细胞同时生长的肿瘤。根据间质细胞的细胞密度,核分裂象,细胞异型性等,可分为良性,交界性和恶性叶状肿瘤。良性叶状肿瘤的间质为CD34和Bcl-2阳性,上皮细胞标记一般来说为阴性。但恶性叶状肿瘤CD34和Bcl-2的表达可以消失。
例外情况:最近有报道叶状肿瘤的间质细胞可以有局部的P63和上皮标记物阳性表达。
六、乳腺的特异性标记物
这些IHC标记物对鉴别转移性乳腺肿瘤特别有帮助,但需要注意到它们的特异性和敏感性各不相同,所以运用时最好是采用几个标记物。不过,如果有原发癌可以比较,IHC往往可以不需要。1)GATA3:在乳腺癌和膀胱癌为高表达,它在非三阴性的乳腺癌中为100%表达,但在三阴性乳腺癌只有60-70%的表达。注意除膀胱癌外,GATA3目前发现可以在很多上皮性肿瘤中表达,例如皮肤附件肿瘤、间皮瘤、涎腺肿瘤及胰腺癌等,应用时需要注意密切结合临床情况综合分析。2)Mammaglobin:在50%的乳腺癌中表达。它的表达可以是很局部的。有报道说它在非三阴性肿瘤中比GCDFP-15更敏感一些。3)GCDFP-15:它的敏感性大约50%左右,但它的特异性超过90%,特别是在小叶病变和大汗腺化生的病变中。4)ER:它在70-80%的乳腺肿瘤中有表达。它的表达与肿瘤的分化程度成正相关;所以,如果一个分化很好的转移癌ER阴性,那来自乳腺的可能极小。

七、 IHC在腋窝淋巴结的鉴别诊断
一般来说,对淋巴结转移癌的诊断,IHC是不需要的。但是以下几种情况IHC标记物的分析还是很有帮助:1)浸润性小叶癌(Invasive lobular carcinoma,ILC):Pan-CK标记单个转移的小叶癌细胞。2)孤立性肿瘤细胞(Isolated tumor cell,ITC):Pan-CK找出微小或单个的肿瘤细胞转移。3)良性腺样包涵体:肌上皮细胞标记(P63或Calponin)可以证实这些腺体为非转移性的良性腺体。4)良性蓝痣细胞:S-100和Pan-CK可以帮助鉴别诊断是蓝痣还是转移癌。
八、ER、PR、HER2伴随诊断
临床对这些伴随诊断的准确性要求非常高。因为它的准确性直接影响了病人的临床治疗方案。很多因素如冷缺血时间(<60min),固定时间(6-72h),固定液(中性福尔马林)和病理医生的判读能力等等,都可能直接影响到检测结果的准确性。1)ER,PR:所有的导管原位癌和浸润癌都需要检测ER,PR。最好的报告形式应该包括百分比和染色强度。它们的表达程度与癌细胞的分化成正比,对低级别乳腺癌但ER,PR阴性的病例,建议重新检测,因为这种可能性非常小。小叶癌,小管癌,乳头状瘤和低级别浸润性癌(NOS)ER和PR多为阳性表达。2)HER2:所有浸润性癌,包括微浸润癌和复发的乳腺癌都必须检测HER2。病理报告应该用阴性(0,1+)、临界性(2+)和阳性(3+),IHC 2+病例需要进一步FISH检测。如发现HER2在低级别的乳腺癌中过表达,一定要复查之后再发报告。
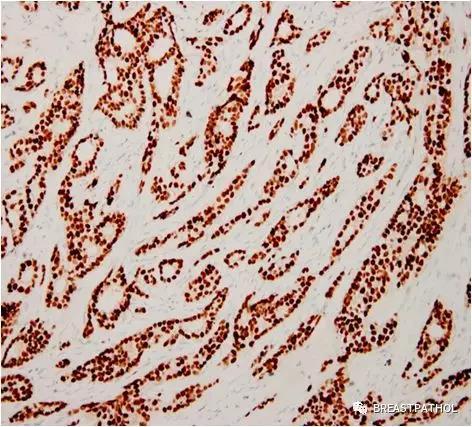
ER(+,强阳性,>90%)
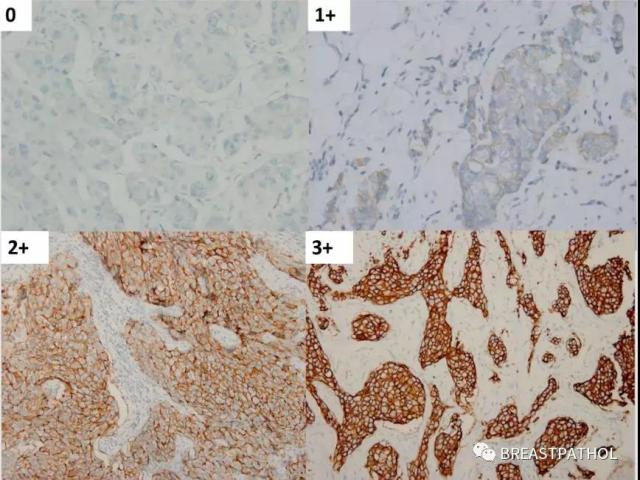
HER2免疫组化染色0,1+,2+,3+
作者:张璋 审阅:李新军 魏兵
作者简介

























共0条评论