[导读] 作者:程元甲,陈晶晶,张虹,张爽,叶京明,徐玲,段学宁,李 挺,刘荫华;来源:中国实用外科杂志,2019,39(12):1326-1330
摘要
目的 探讨早期乳腺癌保乳手术标本病理切缘评价的临床价值。方法 回顾性分析2013-01-01—2017-12-31北京大学第一医院乳腺疾病中心接受保乳手术的早期乳腺癌病人资料,探讨病理切缘范围与预后的关系,以及术中冰冻病理与术后石蜡病理对于保乳手术切缘评价的一致性。结果 共474例保乳病例纳入研究,总体复发转移发生率为3.4%,局部复发率(LRR)1.5%,5年无病存活率(DFS)95.7%,5年总存活率(OS)96.8%。术后石蜡与术中冰冻病理学检查对于保乳切缘评价的符合率为100%,首次切缘阳性与阴性相比,局部复发率差异无统计学意义(χ2=1.371,P=0.242)。切缘阴性病人不同切缘宽度的无病存活率和总存活率差异均无统计学意义(χ2=0.123,P=0.726;χ2=0.077,P=0.781),局部复发率差异也无统计学意义(χ2=1.808,P=0.613)。结论 术中冰冻与术后石蜡病理学检查评价保乳手术切缘符合率高,不同宽度阴性切缘病人的无病存活率和局部复发率差异无统计学意义。
针对具有适应证的早期乳腺癌病人实施保乳手术已经获得广泛共识[1],但有关保乳手术切缘病理评价的安全性问题始终备受关注。本研究针对2013年1月至2017年12月北京大学第一医院乳腺疾病中心接受保乳手术病人的临床病理资料进行分析,探讨病理切缘范围与预后的关系,以及术中冰冻病理与术后石蜡病理学检查对于切缘评价的符合率,报告如下。
1.资料与方法
1.1 一般资料 2013-01-01—2017-12-31北京大学第一医院乳腺疾病中心共收治新发早期乳腺癌1859例。全部入组病人术前均接受空芯针穿刺,组织病理学检查确诊为乳腺癌,并根据不同临床分期及分子分型实施全身综合治疗。其中,515例病人接受保乳手术,占全部手术病例27.7%,末次随访失访率2.1%。排除30例切除活检术后的保乳病例和11例失访病例,共474例病人纳入本研究(表1)。全部病人均为女性,中位年龄50[四分位距(IQR)43~60]岁,中位随访时间41(IQR 25~53)个月。
1.2 研究方法
1.2.1 保乳手术 术前根据乳腺B超、X线摄片或MRI确定乳腺肿物部位及范围(新辅助治疗病人于治疗开始前以美蓝皮内标记肿瘤边缘)。乳房上象限采用弧形切口,下象限采用放射状切口。分离皮瓣并沿触诊边界>1 cm切除肿瘤及周围部分乳腺腺体,深方包括胸大肌筋膜。残留腺体实施肿瘤整复修饰缝合。切除标本标记上、下、内、外、表面及基底 6 个方位切缘,送病理科进行冰冻病理学检查(图1、2)。
1.2.2 病理组织学检查 参照美国病理协会标准[2],送检标本按规定顺序取材行冰冻病理学检查评估切缘,再将标本按石蜡切片程序固定、脱水、石蜡包埋、切片和HE染色,行进一步检查。
1.2.3 随访 采用电话及信件方式随访,每年随访1次,本次随访截至2019年8月。
1.2.4 统计学方法 采用SPSS 24.0软件进行统计学分析,无病生存时间定义为无远处转移病例自手术至发生局部复发或远隔转移时间,总体生存时间定义为确诊乳腺癌至死亡时间。生存分析采用Kaplan-Meier曲线,组间比较采用Log-rank检验,以P<0.05为差异有统计学意义。
2.结果
2.1 手术及随访情况 474例病人中,399例(84.2%)直接接受保乳手术,75例(15.8%)为新辅助治疗后行保乳手术。全部病人5年无病存活率(disease free survival,DFS)95.7%,5年总存活率(overall survival,OS)96.8%。
16例病人出现复发转移,其中4例(0.8%)仅局部复发,9例(1.9%)仅远处转移,3例(0.6%)局部复发伴远处转移。总体复发转移发生率为3.4%,局部复发率(local recurrence rate,LRR)1.5%。11例(2.3%)病人死亡,其中9例(1.9%)为乳腺癌相关的死亡。
7例出现局部复发的病人中,1例为原位癌,6例为非特殊类型的浸润癌;切缘情况:3例切缘>1 cm,1例切缘9 mm,2例切缘3 mm,1例首次切缘阳性经补切保乳成功;分子学分型情况:1例为原位癌未做分子学分型,3例为三阴型乳癌,1例为Luminal B(HER2阴性)型,2例为Luminal A型;分期情况:1例为0期,2例为IA期,1例为IIA期,3例为IIB期;术前治疗情况,2例行阿霉素联合紫杉醇(TA)方案新辅助化疗:1例行新辅助内分泌治疗,4例未行术前治疗;术后治疗情况,1例行术后阿霉素联合环磷酰胺序贯紫杉醇(AC-T)方案辅助化疗,化疗结束后序贯内分泌治疗,6例直接行辅助内分泌治疗。
75例接受新辅助治疗的病人中,2例(2.7%)仅局部复发,3例(4%)仅远处转移,1例(1.3%)局部复发伴远处转移。新辅助病人的总体复发转移发生率为8%,LRR为4%。
2.2 保乳手术切缘情况 474例保乳手术共有5688份冰冻切片,采用按病理号+序号标记的方法,未出现标本差错现象。冰冻切片的组织结构清晰、完整,与石蜡切片相比组织结构及细胞形态均基本相同,各切缘的冰冻-石蜡符合率100%。
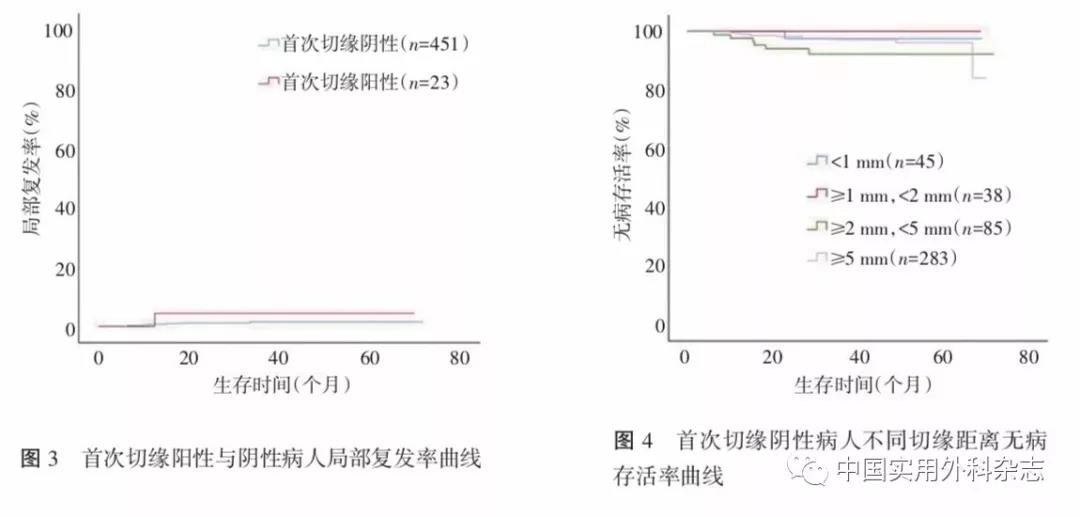
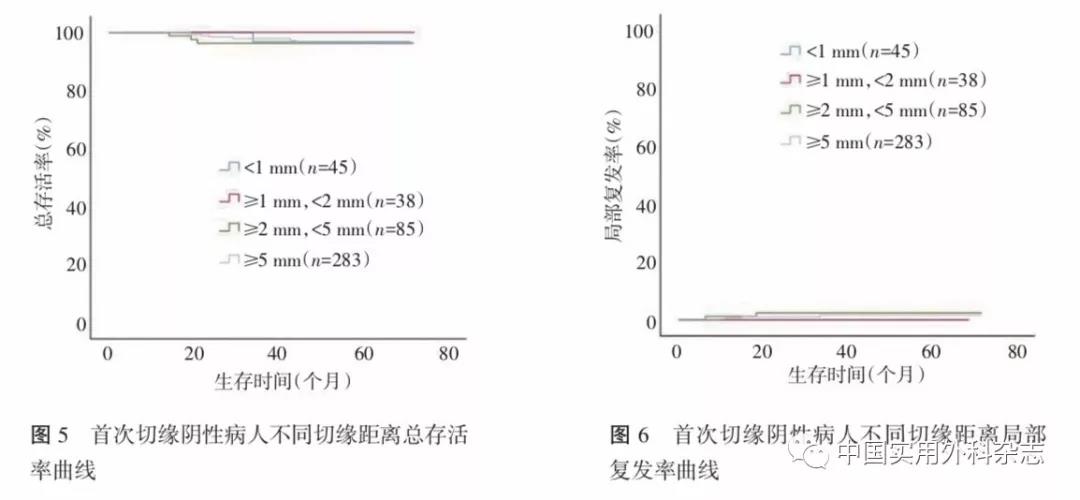
474例行保乳手术病人中451例(95.1%)手术首次切缘阴性(表2)。23例(4.9%)首次切缘阳性经补切后保乳成功,首次切缘阳性与阴性相比,LRR差异无统计学意义(χ2=1.371,P=0.242,图3)。首次切缘阴性病人4组不同切缘距离间的DFS和OS差异无统计学意义(χ2=0.123,P=0.726,图4;χ2=0.077,P=0.781,图5),LRR差异也无统计学意义(χ2=1.808,P=0.613,图6)。原位癌不同切缘间的局部复发率差异无统计学意义(χ2=0.429,P=0.934,图7)。

3.讨论
1990年国际癌症协会提出对大多数Ⅰ、Ⅱ期乳腺癌而言,保乳手术是一种适宜的治疗方法[3]。后续多项多中心前瞻性研究证实了保乳手术的可行性和良好的远期效果[4-5]。本研究中,保乳手术占同期全部乳腺癌手术的27.7%。与国内文献报道一致。接受保乳手术病人5年DFS 95.7%,5年OS 96.8%,也与文献[6-7]报道相符。
近年来,保乳手术关注的焦点多集中于“切缘安全距离”问题。笔者认为,保乳手术切缘安全的基本要求是原发肿瘤R0切除,但是,大范围切除乳腺腺体必然影响保乳手术的美容效果。同时,由于肿瘤不规则生长的特性,组织病理学检查应该严谨地作出肿瘤边缘与手术外侧边缘间的真实距离的判断。切缘过大会对病人造成额外的组织损伤并影响保乳的美容效果,切缘过小又可能增加局部复发的风险。目前针对保乳手术的研究多为非前瞻的随机对照研究,因此,切缘问题尚无定论。
2014年外科肿瘤学会和美国放射肿瘤学会(ASCO/SSO)发布指南[8],提出“切缘无肿瘤累及(No ink on tumor)”可作为Ⅰ、Ⅱ期浸润性乳腺癌的安全手术切缘标准,临床上通常采用的比无瘤切缘更广泛的切缘并无必要。2015年St Gallen会议发布共识认为这一切缘标准也适用于原位癌[9]。2015年英国乳腺外科协会(ABS)发布的指南建议乳腺浸润癌及原位癌的最小切缘宽度均为1 mm[10]。2016年ASCO/SSO指南提出,为了避免再次手术标本中残留病灶的增加,建议将原位癌保乳手术的安全切缘增加到2 mm[11]。有观点认为,因为原位癌复发多出现在原活检或切除的部位,手术时应遵循个体化原则,保证足够的切缘距离[12]。
本研究显示,对于首次切缘阴性的保乳病人,不同切缘宽度的DFS和OS差异并无统计学意义,LRR差异也无统计学意义,支持切缘无瘤这一标准。首次切缘阳性的病人,再次补切达到阴性切缘后并未增加局部复发的风险。对于原位癌病例,切缘无瘤的标准同样适用,不同切缘的原位癌病人LRR差异并无统计学意义。
研究中有7例病人出现局部复发,由于数目过少,难以行统计学分析以评价其局部复发的高危因素,但就已有的病历资料而言,在具体分布上并未观察到有明显的聚集倾向,需要在将来的研究中进一步扩大样本量进行讨论。本研究中有75例病人术前行新辅助治疗,在治疗开始前均用美蓝标记肿物边缘,并在手术时以此为依据行扩大切除,行新辅助治疗病人的总体复发转移发生率为8%,LRR为4%,均高于全部入组病人的总体水平。已有研究证实,新辅助化疗后的保乳手术与常规保乳术后局部复发率间差异无统计学意义[13],但选择行新辅助治疗的病人,因其本身便存在淋巴结转移、肿瘤分期晚、分型不良等复发转移的高危因素,而本研究中出现局部复发或转移的病人,其术后病理评价均未达到病理学完全缓解(pathologic complete response,pCR),这可能是其预后不佳的原因之一[14]。
有观点认为,虽然切缘无瘤这一标准可能是安全的,但仅仅切缘无瘤应该作为底线,而不是盲目追求的目标[15]。因为外科医生难以设计前瞻性研究,而且并非所有医疗机构均能提供术中冰冻病理学检查以在术中准确地评估切缘宽度。
一项Meta分析的结果显示,术中冰冻切缘评估的敏感度和特异度分别为 86% 和 96%[16]。文献[17]报道称术中冰冻可以使二次手术率下降34%。笔者中心术中冰冻和石蜡病理学检查的一致率为100%,也提示了冰冻切缘诊断技术的可靠性和安全性。因此,建议二次手术率高的中心考虑使用术中冰冻切片行病理学诊断评估。然而冰冻组织学检查也有自身的缺点,因为脂肪组织在冰冻切片过程中存在冻融现象,可能造成部分组织缺失或折叠而影响阅片,要求在很短的时间内做出诊断,须由丰富经验的医生来完成。因此,在具备经验丰富的病理科医生和稳定成熟的冰冻诊断技术之前,医疗机构不宜仅以切缘无瘤这一标准开展保乳手术,以保证手术治疗的安全性。
合适的保乳阴性切缘,不仅可以为乳腺癌病人提供良好的美容效果和较高的生活质量,也是乳腺癌综合治疗中重要的一环。本研究中,冰冻与石蜡切缘组织学检查的一致率为100%,能良好地满足肿瘤治疗的安全需要,对降低二次手术率有重要意义。在具备准确的冰冻病理评估切缘手段的前提下,切缘无瘤这一标准并未增加局部复发,能够同时满足保乳的安全性和美观性的要求。
参考文献
[1]中华医学会外科学分会乳腺外科学组.早期乳腺癌保留乳房手术中国专家共识(2019版)[J].中华外科杂志,2019,57(2):81-84.
[2]Fitzgibbons PL,Connolly JL,Page DL,et al.Breast: Protocol applies to all invasive carcinomas of the breast[C].Northfield,IL: College of American Pathologists,2005.
[3]Hurd TC,Edge SB,Kahlenberg MS,et al.Treatment of early-stage breast cancer[J].Curr Probl Cancer,1999,23(4):149-228.
[4]Veronesi U,Cascinelli N,Mariani L,et al.Twenty-year follow-up of a randomized study comparing breast-conserving surgery with radical mastectomy for early breast cancer[J].N Engl J Med,2002,347(16):1227-1232.
[5]Litiere S,Werutsky G,Fentiman IS,et al.Breast conserving therapy versus mastectomy for stage I-II breast cancer: 20 year follow-up of the EORTC 10801 phase 3 randomised trial[J].Lancet Oncol,2012,13(4):412-419.
[6]Yue D,Yang Y,Zhao L,et al.Efficacy analysis of accelerated partial breast irradiation versus whole breast irradiation with simultaneous integrated boost after breast-conserving surgery for early-stage breast cancer[J].Chinese J Radi Med Protec,2018,38(9):664.
[7]Winters ZE,Horsnell J,Elvers KT,et al.Systematic review of the impact of breast-conserving surgery on cancer outcomes of multiple ipsilateral breast cancers[J].BMJ Open,2018,2(4):162-174.
[8]Buchholz TA,Somerfield MR,Griggs JJ,et al.Margins for breast-conserving surgery with whole-breast irradiation in stage I and II invasive breast cancer: American Society of Clinical Oncology endorsement of the Society of Surgical Oncology/American Society for Radiation Oncology consensus guideline[J].J Clin Oncol,2014,32(14):1502-1506.
[9]Esposito A,Criscitiello C,Curigliano G.Highlights from the 14(th)St Gallen International Breast Cancer Conference 2015 in Vienna: Dealing with classification,prognostication,and prediction refinement to personalize the treatment of patients with early breast cancer[J].Ecancermedicalscience,2015,(9):518.
[10]De Koning SG,Peeters MJ,Jozwiak K,et al.Tumor resection margin definitions in breast-conserving surgery: systematic review and meta-analysis of the current literature[J].Clin Breast Cancer,2018,18(4):595-600.
[11]Morrow M,Van Zee KJ,Solin LJ,et al.Society of surgical oncology-American society for radiation oncology-american society of clinical oncology consensus guideline on margins for breast-conserving surgery with whole-breast irradiation in ductal carcinoma in situ[J].J Clin Oncol,2016,34(33):4040-4046.
[12]李志伟,郑新宇.乳腺导管原位癌治疗的争议与共识[J].中国实用外科杂志,2018,38(11):1265-1270.
[13]姚凡,金锋.《中国临床肿瘤学会乳腺癌诊疗指南2018.V1》外科问题解读[J].中国实用外科杂志,2018,38(11):1281-1284.
[14]高国璇,张岩,张虹,等.乳腺癌新辅助治疗病理完全缓解影响因素及预后分析[J].中国实用外科杂志,2016,36(11):1205-1210.
[15]段学宁.乳腺癌手术治疗百年历史回顾与启示[J].中国实用外科杂志,2018,38(11):1227-1231.
[16]St John ER,Al-Khudairi R,Ashrafian H,et al.Diagnostic accuracy of intraoperative techniques for margin assessment in breast cancer surgery[J].Ann Surg,2017,265(2):300-310.
[17]Jorns JM,Daignault S,Sabel MS,et al.Frozen sections in patients undergoing breast conserving surgery at a single ambulatory surgical center: 5 year experience[J].Eur J Surg Oncol,2017,43(7):1273.
(2019-10-11收稿2019-11-14修回)



















共0条评论