[导读] 编译整理:强子
软组织病理诊断新进展(一)
软组织病理诊断新进展(二)
软组织病理诊断新进展(四)
五.圆细胞肉瘤新亚型
小圆细胞肉瘤包括一组异质性病变,其特点为低分化、细胞核深染、胞质稀少的小圆形细胞呈片状分布,其中也包括经典的Ewing肉瘤。Ewing肉瘤大部分病例具有涉及EWSR1基因的重排,其中t(11;22)(q24;q12)导致的EWSR1-FLI融合最为常见(约占所有病例的90%)。大部分病例中,Ewing肉瘤为细胞核圆形、核仁不明显的细胞呈片状排列,伴程度不等的坏死。不过,也可出现其他形态学表现。免疫组化一般CD99为弥漫、细胞膜强阳性,而细胞核表达转录因子NKX2.2。

图8. Ewing肉瘤,一般为形态单一、黏附性差的小圆细胞构成,胞质稀少,免疫组化细胞膜弥漫、强阳性表达CD99(中),细胞核表达NKX2.2(右)。
1.伴CIC重排的圆细胞肉瘤
2012年,研究发现一组无EWSR1重排、好发于年轻成人男性躯干及四肢软组织的圆细胞肉瘤具有CIC重排,即t(4;19)(q35;q13)或t(10;19)(q26;q13)、最常见导致CIC-DUX4融合。组织学上这组肿瘤表现为原始的圆形至卵圆形,有时出现梭形,细胞核呈不规则、空泡状,染色质粗糙,可见显著核仁,局灶有坏死,常见核分裂。
与Ewing肉瘤不同的是,伴CIC重排的圆细胞肉瘤形态学异质性更高,核仁显著,胞质更丰富、且常淡染,仅少数细胞表达CD99(但也有20%左右的病例为弥漫阳性)。此外,细胞核弥漫、强阳性表达WT1(90%以上的病例)和ETV4(90%的病例),这一点有助于和Ewing肉瘤、BCOR重排圆细胞肉瘤的鉴别。也曾有报道称少部分病例(5%)表达NKX2.2。

图9. CIC重排圆细胞肉瘤一例,瘤细胞相比Ewing肉瘤来说胞质稍丰富、嗜双色性,免疫组化CD99仅少数细胞表达(中),细胞核表达ETV4(右)。
伴CIC重排的圆细胞肉瘤具有侵袭性生物学行为,相比Ewing肉瘤来说总生存更低(二者分别为43%、76%)。尽管二者临床治疗方案近似,但该肿瘤对于已证实在Ewing肉瘤有效的治疗方案常出现耐药,因此需开发新的治疗策略。
2.伴BCOR重排的圆细胞肉瘤
2012年,有报道称一组无EWSR1或CIC重排的小圆细胞肉瘤具有inv(X)(p11)所致的BCOR-CCNB3融合。该组肿瘤好发于男性儿童的骨及软组织,后续研究表明其基因表达谱与其他肉瘤、尤其Ewing肉瘤不同。除与CCNB3融合外,罕见情况下重排还可涉及MAML3、ZC3H7B基因等。
组织学上,该组肿瘤特点为形态单一、原始表现的圆形至卵圆形细胞,偶见梭形,呈相互交错的筋膜炎样排列,或无序排列。
后续研究已证实,对于所有BCOR重排肉瘤来说,免疫组化表达BCOR可以可靠的预测该蛋白的过表达,也可用于伴BCOR遗传学改变的其他肿瘤检测。该组肿瘤的CD99表达结果不一,不表达NKX2.2、ETV4、WT1,因此可以和Ewing肉瘤、CIC重排肉瘤鉴别开来。此外,具报道,部分其他肿瘤类型如骨化性纤维黏液样肿瘤(ossifying fibromyxoid tumour)、部分高级别子宫内膜间质肉瘤也有ZC3H7B-BCOR融合。

图10. 伴BCOR-CCNB3重排的圆细胞肉瘤一例,胞质中等,免疫组化不表达CD99(中),但细胞核弥漫表达BCOR(右)。
BCOR重排肉瘤生物学行为具有侵袭性,但其侵袭性可能弱于CIC重排的肉瘤,前者5年总生存率约为77%。不过,具体仍需大规模、长时间随访证实。
六.梭形细胞型/硬化性横纹肌肉瘤中的MYOD1突变
部分横纹肌肉瘤中发现MYOD1突变,扩展了横纹肌肉瘤的谱系;而横纹肌肉瘤则包括了常见导致RAS信号通路活化突变的胚胎性横纹肌肉瘤,一般具有PAX3-FOXO1或PAX7-FOXO1融合的腺泡状横纹肌肉瘤,以及多形性横纹肌肉瘤。
梭形细胞型横纹肌肉瘤此前被视为胚胎性横纹肌肉瘤亚型之一,最常发生于儿童附睾部位,此时生物学行为相对惰性;发生于成人时则好发部位为头颈部,临床病程更具侵袭性。组织学上,梭形细胞型横纹肌肉瘤具有两种细胞类型:主要为梭形细胞,形成长的相互交织的束状,细胞核卵圆形至拉长,胞质淡染;少部分细胞为横纹肌母细胞,细胞核深染、具有偏位核仁,胞质丰富、嗜酸性。
硬化性横纹肌肉瘤可以发生于儿童及成人,一般瘤细胞为卵圆形至圆形,胞质量少,常呈巢状排列,间质为致密硬化性。不过,同一肿瘤的不同区域可分别出现梭形细胞型和硬化性表现,隐藏目前认为这是一个组织学谱系的两端,但2013年世界卫生组织分类中仍是二者单独列出的。与胚胎性、腺泡性、多形性横纹肌肉瘤一样,梭形细胞型/硬化性横纹肌肉瘤可表达desmin、myogenin、MyoD1,后者呈特征性弥漫强阳性。
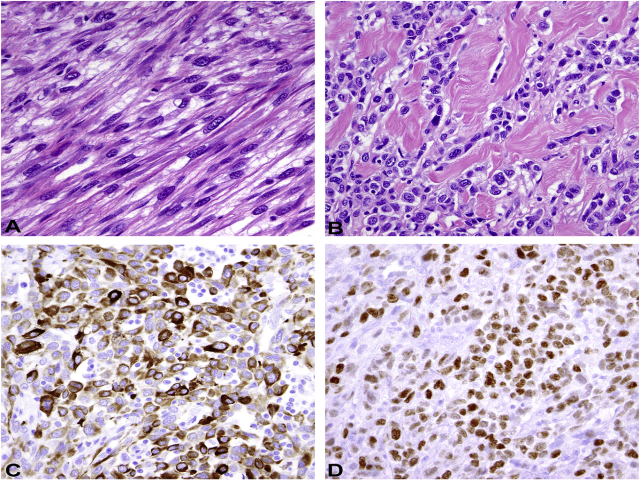
图11. 梭形细胞型/硬化性横纹肌肉瘤,其形态学谱系可自相互交织排列的梭形细胞(左上)、直至卵圆形、圆形细胞不等(右上),少量胞质,背景为致密硬化性间质;免疫组化多灶表达desmin(左下),细胞核弥漫表达MYOD1(右下)。
2013年,有人报道称一小组发生于新生儿和婴儿的梭形细胞横纹肌肉瘤具有NCOA2基因重排。2014年则发现梭形细胞型和硬化性横纹肌肉瘤中均有MYOD1遗传学异常。MYOD1中的p.L122R活性突变导致MYC样转录程序活化,并启动分化、增生,组织学表现为梭形细胞形态、并有一定程度肉瘤样分化;后续在很多成人及儿童梭形细胞型、硬化性横纹肌肉瘤中均发现了这一突变。后续还发现MYOD1突变与PIK3CA突变、PTEN缺失有关,因此可导致PI3K-AKT通路的改变。
对分子遗传学异常的了解,可能不管患者年龄如何,均可考虑将相同遗传学异常者归为一类,同时有助于将梭形细胞型/硬化性横纹肌肉瘤和前述胚胎性、腺泡性、多形性横纹肌肉瘤区别开来。
点击下载英文文献
参考文献
Schaefer IM, Fletcher C.D.M. Recent advances in the diagnosis of soft tissue tumours[J].Pathology,2018,50(1):37-48.
DOI:10.1016/j.pathol.2017.07.007

















共0条评论