[导读] 作者:赵琳琳 孙悦 王聪 曹箭 郭会芹 赵焕 张智慧 ;来源:中华肿瘤杂志, 2019,41(5) : 326-330.
目的
探讨纤维支气管镜刷检液基薄片细胞学联合免疫细胞化学(ICC)检测进行肺癌病理分型的可行性。
方法
将171例肺部病变患者的纤维支气管镜刷检标本制成液基薄片,在细胞形态学诊断的同时使用全自动免疫组化仪进行ICC检测,其结果与组织病理学诊断结果进行比较。
结果
171例患者中,单独细胞形态学诊断可分型130例(76.0%),其中诊断鳞癌31例,腺癌44例,小细胞癌55例;细胞形态学联合ICC诊断可分型162例(94.7%),其中诊断鳞癌38例,腺癌61例,小细胞癌63例,差异有统计学意义(P<0.001)。以组织病理学诊断结果为金标准,细胞形态学联合ICC的诊断分型符合率高于单独细胞形态学诊断分型的符合率,其中鳞癌由85.2%提高至97.1%(P=0.093),腺癌由92.5%提高至98.0%(P<0.001),小细胞癌由96.1%提高至98.3%(P=0.465)。
结论
液基薄片细胞学与全自动免疫组化仪检测相结合,能够有效提高纤维支气管镜刷检标本诊断病理分型的准确性,为临床治疗提供更加客观的诊断结果。
近年来,肿瘤的临床治疗技术不断发展。肺癌的治疗越来越精细化,要求病理医师在治疗前对患者做出准确的病理分型。纤维支气管镜刷检取材是临床诊断肺癌的重要方法之一,刷检细胞学的阳性率在60%以上[1,2,3]。其中部分患者由于细胞分化差,仅通过细胞形态学不能进行病理分型,需要行免疫细胞化学(immunocytochemistry, ICC)检测辅助诊断。但在纤维支气管镜直视下,不易或者不适合取活检而仅适合刷检的患者,由于细胞的标本量少无法制成细胞块,只能通过细胞学涂片或者液基薄片进行诊断和病理分型。液基薄片能否在全自动免疫组化仪上进行ICC检测,其结果的可靠性如何?国内外鲜有相关研究的报道。因此,我们将纤维支气管镜刷检物制备成液基薄片,行细胞诊断的同时,使用全自动免疫组化仪进行ICC检测,将诊断结果与组织病理学诊断结果进行比较,探讨了这种诊断方法的可行性,以提高肺癌病理分型的准确率。
资料与方法
一、研究对象
选取2016年1—12月在我院行纤维支气管镜刷检获取细胞学标本,并同时行液基薄片细胞诊断和全自动ICC检测的肺部病变患者171例,均有组织病理学诊断结果。其中男126例,女45例,年龄33~78岁,中位年龄61岁。
二、液基薄片制备
将纤维支气管镜刷检细胞学标本,采用Thinprep2000(美国豪洛捷公司)制片,每例患者2~6张,以95%乙醇固定15 min。1张液基薄片行巴氏染色,用于细胞形态学诊断,其他液基薄片,根据所发现癌细胞的形态特征选择相应抗体进行ICC检测。
三、ICC检测
1.试剂与仪器:
一抗均为即用型,包括p63、p40、NapsinA、TTF-1、Syn、CD56,为丹麦Dako公司产品。二抗为罗氏OptiView DAB Detect kit显色系统。缓冲液、清洗液、免疫组化抗原修复液、苏木素染色液和返蓝染色液均为罗氏全自动免疫组化仪的配套产品。BenchMark GX全自动免疫组化仪为美国罗氏公司产品。
2.染色方法:
将所需检测试剂和辅助试剂放置在全自动免疫组化仪试剂架上。将固定后的液基薄片自然晾干。根据不同一抗的修复时间、孵育时间及温度等在电脑中设定相应的染色方案。通过电脑输入一抗名称,Ebar条码打印机打出标签,分别贴在相应玻片上。将玻片放入罗氏BenchMark GX全自动免疫组化仪的相应位置,按照电脑程序提示滴加一抗。其余步骤均由机器自动操作。染色完成后取出玻片,用清洗液洗去缓冲液,经95%乙醇和二甲苯脱水透明,封片。
3.结果判读:
无着色为阴性细胞,细胞质和(或)细胞膜、细胞核呈棕黄色颗粒为阳性细胞。根据阳性细胞占全部肿瘤细胞的百分比进行判定:<5%为+,5%~25%为++,26%~50%为+++,>50%为++++[4]。
四、统计学方法
应用SPSS 19.0软件进行统计分析。计数资料采用卡方检验或Fisher确切概率法,检验水准α=0.05。
结 果
1.细胞形态学诊断:
171例患者中,单独细胞形态学诊断可分型130例(76.0%),其中诊断鳞癌31例(图1),腺癌44例(图2),小细胞癌55例(图3)。与组织病理学诊断结果比较,细胞学诊断鳞癌、腺癌和小细胞癌的符合率分别为85.2%、92.5%和96.1%(表1)。
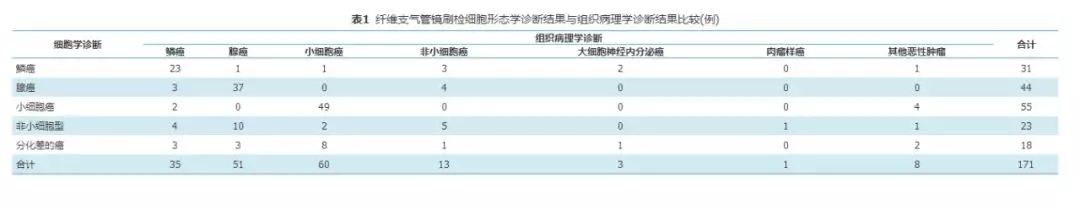 表1
表1
纤维支气管镜刷检细胞形态学诊断结果与组织病理学诊断结果比较(例)
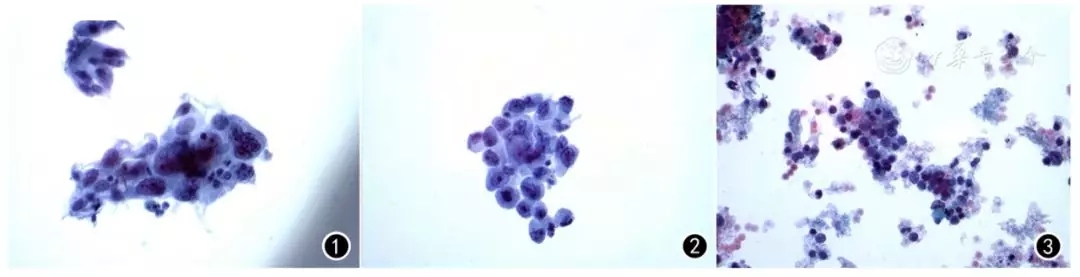
图1
镜下肺鳞癌细胞 巴氏染色 ×400
图2
镜下肺腺癌细胞 巴氏染色 ×400
图3
镜下小细胞肺癌细胞 巴氏染色 ×400
2.细胞形态学联合全自动免疫组化仪ICC检测:
171例患者中,细胞形态学联合ICC诊断可分型162例(94.7%),其中诊断鳞癌38例,腺癌61例,小细胞癌63例。与组织病理学诊断结果比较,细胞形态学联合ICC诊断鳞癌、腺癌和小细胞癌的符合率分别为97.1%、98.0%和98.3%(表2)。
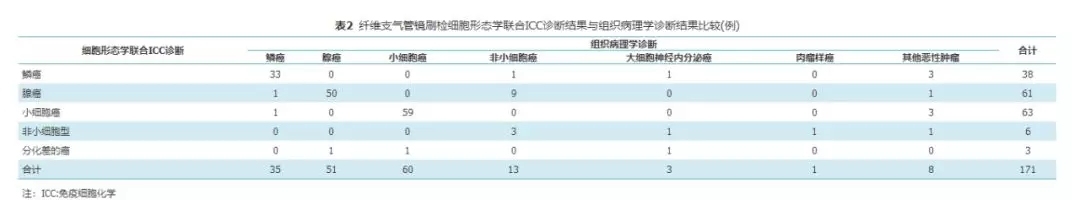
表2
纤维支气管镜刷检细胞形态学联合ICC诊断结果与组织病理学诊断结果比较(例)
ICC和组织病理学均诊断为鳞癌的33例患者中,p63的阳性表达率为100%(33/33),p40的阳性表达率为90.9%(30/33,图4);均诊断为腺癌的50例患者中,TTF1的阳性表达率为96.0%(48/50),NapsinA的阳性表达率为82.0%(41/50,图5);均诊断为小细胞癌的59例患者中,CD56的阳性表达率为100%(59/59),Syn的阳性表达率为93.2%(55/59,图6)。
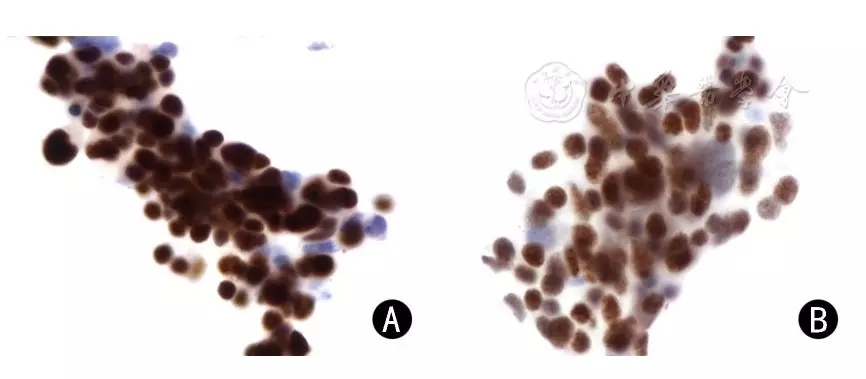
图4
肺鳞癌常见抗体的表达 免疫组化染色 ×400 A: p63阳性; B: p40阳性

图5
肺腺癌常见抗体的表达 免疫组化染色 ×400 A: TTF1阳性; B: NapsinA阳性
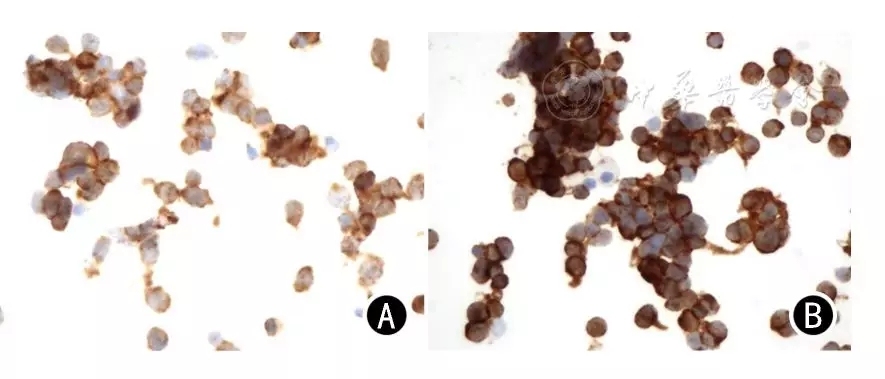
图6
小细胞肺癌常见抗体的表达 免疫组化染色 ×400 A: CD56阳性; B: Syn阳性
3.细胞形态学联合ICC诊断结果与单独细胞形态学诊断结果比较:
171例患者中,单独细胞形态学诊断可分型130例(76.0%),细胞形态学联合ICC诊断可分型162例(94.7%),差异有统计学意义(χ2=23.99,P<0.001)。41例单独细胞形态学不能分型的患者,经ICC检测,32例获得分型,其中鳞癌7例,腺癌17例,小细胞癌8例。
以组织病理学诊断结果作为金标准,细胞形态学联合ICC的诊断分型符合率比单独细胞形态学诊断分型的符合率增高,其中鳞癌由85.2%提高至97.1%(χ2=2.82,P=0.093),腺癌由92.5%提高至98.0%(χ2=22.41,P<0.001),小细胞癌由96.1%提高至98.3%(χ2=0.53,P=0.465)。
讨 论
纤维支气管镜检查是诊断肺部占位病变的重要方法之一,纤维支气管镜刷检细胞学检查对纤维支气管镜下见不到肿物、黏膜容易出血等原因导致无法取到活检患者的明确诊断很有帮助[1,4],2004年世界卫生组织已将细胞学诊断列为肺癌病理分型诊断的重要证据之一[5]。
液基细胞学检测是近年来应用于细胞学诊断的一项新技术,具有细胞形态保存完好、背景干净、细胞结构清晰等特点,细胞形态学诊断后的剩余标本还可以保存12个月,用于ICC和分子检测等其他辅助检查[6,7,8]。纤维支气管镜刷检液基细胞学制片技术克服了传统涂片血多、黏液多、细胞退变、涂片薄厚不均、细胞结构不清晰等缺点,有效提高了纤维支气管镜刷检的阳性率[3,9]。
由于腺癌和鳞癌部分细胞形态的叠加,如均出现明显核仁、排列平铺、染色质增粗、细胞核型不规则等,使部分患者从细胞形态学上难以区分。分化差的癌细胞均表现为细胞核异型明显,常可见大核仁,胞浆少,因此细胞分化差时小细胞癌与非小细胞癌仅靠形态学特征不易区分。这些仅靠形态学难以分型的患者,需要借助免疫组织化学技术进一步诊断。免疫组织化学技术在组织病理学领域的应用已经成熟,在细胞块的应用也有很多报道[10,11]。但是临床上部分患者无法取到组织学标本,如早期病变患者未形成肿块,仅能进行刷检。部分患者刷检时细胞量少无法制成细胞块,仅有细胞学刷片标本或者液基薄片标本,主要依靠细胞学做出最终诊断和分型。所以探讨细胞学涂片或液基薄片标本的ICC诊断具有临床实际意义。目前,细胞学涂片或者液基薄片均采用传统的手工操作方法进行ICC染色,容易受到人为因素、外界温差以及环境的影响,使染色结果出现非特异性染色、假阳性和假阴性,并且工作效率低,耗时长,客观性差。在本研究中,我们使用罗氏BenchMark GX全自动免疫组化仪进行ICC染色,使ICC检测更加标准化,减少了检测结果的主观性。
有研究显示,纤维支气管镜刷检细胞形态学分型与组织病理学分型的符合率,鳞癌为68.8%~95.6%,腺癌为84.9%~95.6%,小细胞癌为70.7%~100%[4,12,13]。本研究结果显示,171例肺癌患者中,76.0%能够由单独细胞形态学进行明确病理分型,分型结果与组织病理学分型结果的符合率,鳞癌为85.2%,腺癌为92.5%,小细胞癌为96.1%,与文献报道相符。纤维支气管镜刷检液基薄片ICC检测可以为疑难病例的分型诊断提供强有力的证据。液基薄片行ICC多为手工操作,我们自2015年10月开始采用全自动免疫组化仪进行ICC检测,通过不断完善制片要求,改进操作方法和实验步骤,现已成功应用于支气管镜刷检标本的诊断和分型。与单独细胞形态学相比,支气管镜刷检标本液基细胞学联合全自动免疫组化仪ICC进行病理分型的比例提高了18.7个百分点。同时,还有部分患者的病理分型结果经过ICC得到纠正,使这部分患者能够得到正确的临床治疗。
已有的研究显示,肺鳞癌p63的阳性表达率>90%,p40的阳性表达率>95%;肺腺癌NapsinA的阳性表达率在70%~90%之间,TTF1的阳性表达率在70%~80%之间;小细胞癌Syn的阳性表达率在75%~81%之间,CD56的阳性表达率在86%~92%之间[14,15,16]。本研究结果显示,肺鳞癌p63和p40的阳性表达率分别为100%和90.9%,肺腺癌NapsinA和TTF1的阳性表达率分别为96.0%和82.0%,小细胞癌中Syn和CD56的阳性表达率分别为93.2%和100%,与文献报道一致。
纤维支气管镜刷检液基薄片联合全自动免疫组化仪进行ICC检测有以下优势:(1)液基标本采用湿固定,标本离体后即刻固定,细胞抗原保存完好。(2)液基细胞学制片原理是利用负压吸引作用使细胞吸附在过滤膜上,再利用正压将膜上的细胞转移至经正电荷处理过的玻片上,细胞单层平铺且在全自动免疫组化仪中进行加温修复,使细胞在冲洗过程中不容易脱落。(3)液基薄片细胞学的消化液可以去除标本中的血及黏液,滤过膜滤过了标本中的杂质,并能够最大限度地收集细胞成分,使薄片背景干净,ICC结果不容易产生非特异性着色。(4)全自动免疫组化仪自动化程度比较高,所有操作均自动完成,通过激光条码扫描功能可自动识别滴加抗体,避免了手工操作带来的实验误差。(5)罗氏BenchMark GX全自动免疫组化仪配备单独加热片独立控温,保证每例标本片受热均匀,减少了手工修复过程中产生的脱片、假阴性以及着色不均匀现象。另一方面,纤维支气管镜刷检液基细胞学联合ICC尚有以下不足:(1)试剂使用量大,成本较高。(2)每张玻片只能标记1种抗体,对于标本量少且需要标记多种抗体的情况,操作的灵活性不如手工。
液基薄片全自动免疫组化仪ICC检测的操作过程中要注意以下技术要点:(1)在一抗孵育前加入血清原液进行封闭,可避免部分坏死及炎性细胞较多的标本片出现较强的背景着色。(2)二抗选择罗氏OptiView DAB Detect kit显色系统进行显色,其中的和抗体相共价连接的专利性半抗原可放大抗原抗体结合信号,在不增加背景的情况下能使显色更清晰,结果更容易判读。(3)使用全自动免疫组化仪染色时,每例标本仅能标记1种抗体,因此液基薄片制备前,要根据选择抗体的数量平均分配剩余标本,以保证待标记细胞平均分布至每张玻片上。
总之,通过不断摸索、总结,液基薄片细胞学与ICC检测相结合,能够有效提高纤维支气管镜刷检标本诊断病理分型的准确性,为临床治疗提供更加客观的诊断结果。





 表1
表1












共0条评论