[导读] 来源:中华病理学杂志,2015,44(7):476-479;作者:《常规免疫组织化学初筛ALK阳性非小细胞肺癌专家共识》专家组
肺癌是全球范围内发病率和病死率最高的恶性肿瘤,其中非小细胞肺癌(NSCLC)约占80%。间变性淋巴瘤激酶(ALK)阳性NSCLC是肺癌的一个特定分子亚型,约占全部NSCLC的3%~7% 。临床研究显示,ALK抑制剂克唑替尼(crizotinib)能显著延长晚期ALK阳性NSCLC患者的无进展生存期(PFS),一线、二线单药治疗患者的中位PFS分别为10.9个月和7.7个月。2013年1月中国食品和药品管理局(CFDA)批准克唑替尼用于治疗局部晚期或转移性ALK阳性NSCLC患者。
准确地检测ALK融合状态是ALK阳性NSCLC患者靶向治疗的前提。此外,有研究表明NSCLC中ALK状态可能与患者的预后密切相关。因此,无论患者是否接受靶向治疗,了解NSCLC患者中的ALK状态都有重要的意义。目前,CFDA已经批准的用于诊断ALK阳性NSCLC的方法包括Vysis ALK Break Apart荧光原位杂交(FISH)分离探针试
剂盒、荧光定量PCR(RT-PCR)试剂盒(EML4-ALK融合基因检测试剂盒)和全自动ALK免疫组织化学试剂盒(Ventana IHC),三者的符合率很高。这三种检测方法各有优缺点,其中前两者对样本及操作规范要求较高,价格昂贵,且RT-PCR只能检测出有限的已知ALK 融合基因, 存在假阴性结果。Ventana IHC操作简便易行,价格相对便宜,但需要具备Ventana全自动染色仪BenchMark XT或者BenchMark GX,在我国相当多的检测实验室并不具备。因此有必要建立一套既准确简便、又易于普及的ALK阳性NSCLC的初筛体系,适用于不具备
Ventana全自动染色仪的病理科。常规免疫组织化学(IHC)技术简便易行、价格便宜且操作成熟,具备作为筛查方法的特性。有文献显示常规(指手工/半自动)IHC检测ALK与FISH检测存在高度的一致性 。但不同的文献报道常规ALK IHC操作方法和判读标准不一致,实验结果的准确性也不同,亟需规范ALK常规IHC的操作和判读标准。目前国外已有多家机构正在试验ALK常规IHC操作和判读的规范,以提高临床初筛ALK阳性NSCLC 的准确性和有效性。为推动我国ALK阳性NSCLC的初筛工作,中国抗癌协会肿瘤病理专业委员会组织国内多位在该领域经验丰富的临床和病理学专家,结合多中心的实验数据和国内外已报道的研究成果,讨论适合我国国情的ALK阳性NSCLC常规IHC初筛的操作流程和判读标准,并达成以下专家共识。本共识将对常规IHC检测ALK状态的操作流程和判读标准进行详细说明,以供开展常规IHC初筛ALK阳性NSCLC的实验室参考,规范各实验室的操作程序和结果判读,从而提高初筛的准确性和可重复性。初筛ALK阳性的NSCLC病例需进一步使用经国家批准的诊断试剂盒进行验证,若阳性,则定义为临床ALK阳性NSCLC患者,作为接受克唑替尼治疗的适应人群。
一、初筛ALK阳性NSCLC的适宜范围
所有晚期NSCLC腺癌或者含腺癌成分的肺癌,应在组织病理诊断的同时进行常规ALK检测;对于所有NSCLC的小活检标本建议进行ALK初筛。对于不能开展Ventana IHC诊断检测ALK的实验室,建议采用常规IHC进行ALK的初筛。
二、组织标本的前期处理
1.标本类型:包括手术切除标本、活检组织标本和细胞蜡块标本。建议活检标本尽量多取,以获得足够的癌组织,保证足够组织病理诊断和分子分型。
2.标本固定:离体后应尽快固定(30min 内),手术切除大标本肿物应每隔5~10mm切开固定。采用新鲜配制的4%中性缓冲甲醛固定液;固定液量与所浸泡组织的比例应足够;标本的固定时间为6~48h为宜。常规组织脱水和包埋。
3.制片:(1)切片厚度以3-5um为宜;(2)切片应尽快进行ALK检测,未染色的切片置于室温不宜超过6周,以防抗原丢失。
三、ALK常规IHC检测应当在有条件的实验室进行,实验室经过严格的内部和外部质量控制程序验证,建立完善的标准操作程序(SOP),并与权威机构批准的检测试剂盒进行比对,以保证检测结果的可靠性。实验室技术人员具备相关资质及经过培训合格。
1.常规IHC方法:检测方法根据实验室条件可以选择手工染色或使用免疫组织化学机染色。
2.建议可采用的手工染色方法:(1)抗原修复:目前手工IHC常用的抗原修复方法主要有高温高压修复和微波修复方法两种,使用的修复液以弱酸性和碱性修复液为主。专家组对国内外研究文献和国内常用修复方法进行讨论,建议使用煮沸热修复方法,具体可以采用如下方法之一对抗原进行修复:①0.01mol/L柠檬酸缓冲液(pH6.0),修复10min;②EDTA缓冲液(pH8.0)修复5min;③EDTA 缓冲液(pH9.0)修复3min,修复维持时间和冷却方式各实验室可以根据各自成熟的方法酌情使用。(2)过氧化物酶灭活:建议使用3%H2O2 孵育10min 以灭活内源性过氧化物酶。(3)抗体:共有三种抗体被报道过用于ALK IHC,它们分别是ALK1(Dako公司),D5F3(Cell Signaling公司) 和5A4(Abcam公司)。研究结果显示,在NSCLC中D5F3抗体和5A4抗体检测ALK融合蛋白的敏感性和特异性较高,ALK1抗体的敏感性较低。结合研究报道和专家组成员的使用经验,建议使用D5F3抗体(Cat#3633)和5A4抗体(Cat#ab17127)用于ALK的初筛,建议使用的抗体稀释度为:D5F3抗体,1:(100~250)稀释;5A4 抗体,1:(50-100)稀释(具体的抗体稀释度,可以根据各批次抗体的预实验结果确定)。抗体孵育常温1h,或者4℃过夜。抗体孵育后使用pH7.4 PBS洗涤3次,每次5min以确保充分洗涤,始终保持切片潮湿。小样本实验显示新抗体1A4(OriGene, Cat#TA801287)的检测特异性敏感性均高于其他抗体,但目前该抗体的研究文献还很少。(4)二抗和后续染色过程:建议根据各实验室常规使用的二抗的稀释比率和孵育时间进行操作。使用非生物素化试剂盒和高质量的二氨基联苯胺(DAB)显色液染色。
3.使用免疫组织化学机染色:除了Ventana ALK检测试剂盒和免疫组织化学染色设备外,其他类型的免疫组织化学机染设备基本上都有配套的染色和洗脱试剂,使用这些设备进行ALK IHC染色,一抗可以参考手工IHC一抗相关事宜,其余操作建议严格按照所用染色仪器的优化程序和SOP执行。
4.对照:无论采用何种IHC方法和抗体进行染色,建议每批次检测设立阳性对照、阴性对照和空白对照。有条件的最好采用一对一的阳性对照。阳性对照可采用已被证实IHC检测ALK阳性,且IHC3+的NSCLC组织;阴性对照,被检测切片上癌旁组织中正常的肺组织是很好的阴性内对照;以PBS代替一抗,作为空白对照。
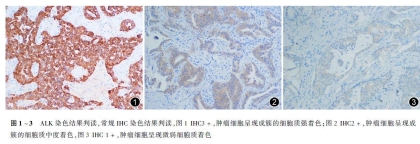
5.结果判读和评分:(1)观察程序:先在低倍镜下观察整张切片,判断染色是否满意。然后在较高倍数下观察着色部位。观察胞质着色癌细胞的比例和着色强度。研究表明,在大多数ALK阳性病例中,阳性信号都是均匀分布,在整个肿瘤中有着一致的强度。在少数病例中,信号在染色强度上存在较大的异质性。(2)结果判读标准:目前,关于ALK染色结果的判读,多数研究采用0到3+的评分系统,但具体的判读细则还未统一。综合国内外的研究结果和专家组的经验,考虑到本共识主要用于ALK的初筛,专家组建议采用已有文献研究结
果、且在国内多家机构使用、检测结果确诊比较高的判读标准,具体如下:IHC3+:>5%的肿瘤细胞呈现细胞质强着色(图2);IHC2+:>5%的肿瘤细胞呈现中度细胞质着色(图2);IHC1+:>5%的肿瘤细胞呈现微弱或模糊的细胞质着色或≤5%的肿瘤细胞有任何程度的着色(图3);IHC 0:肿瘤细胞无明显着色。(3)注意事项:IHC判读和评分时需要注意,在正常黏膜上皮、肺泡巨噬细胞、肿瘤坏死组织、分泌黏液、淋巴细胞和神经组织中也会观察到一些强的背景染色,这种染色在ALK判读时应当排除。
四、ALK 阳性NSCLC的初筛和确诊流程
对于不能开展CFDA 批准的ALK阳性NSCLC检测的实验室,应选用常规IHC法筛查ALK融合蛋白水平,具体的筛查和确诊流程见图4。需要特别
注意以下几点:
1.对于无条件行Ventana IHC检测的医疗机构或中心,常规ALK IHC可作为初筛方法。
2.所有含腺癌成分的NSCLC,应在诊断时常规进行ALK融合蛋白免疫组织化学检测。
3.ALK抗体使用推荐:常规IHC建议使用D5F3抗体和5A4抗体。
4.常规IHC染色结果3+,2+,1+的样本,均需要使用CFDA批准的FISH、Ventana IHC或RT-PCR技术三种方法中的一种进行确诊。
五、ALK常规IHC检测报告包含的内容信息:见表1。
六、筛查的质控
ALK常规IHC筛查应在内、外部质量控制良好和有能力的病理实验室进行,以确保筛查结果的稳定性。
1.ALK常规IHC 必须在标本的采集、处理过程、IHC检测和评判标准诸方面严格按照SOP要求执行。以保证结果可靠。
2.不具备ALK 检测条件的单位应妥善处理和准备标本,提供给有质量保证的病理实验室进行检测。
3.实验室内部质控、室间质评和实验室标准操作流程的主要要求:(1)拟开展筛查的实验室应选择1,2家已开展且有质量保证的实验室进行25~50例标本的比对验证(应至少包含5例ALK阳性标本),阳性和阴性结果的一致性应达到90%以上。(2)实验室应积极参加有关外部质量控制活动,外部质控每年应进行1,2次。(3)实验室应建立完善的SOP文件,并做好每次检测情况的记录和存档工作。(4)任何改变操作程序和试剂的行为均应重新进行严格的验证。(5)内部质控应包括同一组织不同批次染色结果的重复性分析。每次染色
应设置阳性和阴性对照。(6)定期总结和分析ALK阳性率等数据情况,及时发现可能的质量问题。(7)检测相关的仪器和设备需定期维护、校验。关于IHC质控问题,目前尚存在较大问题,没有质控全程的质
控品及措施, 尽快建立对每一次ALK IHC检测过程的检测质量监测,以实现ALK IHC检测的全程质控,包括质控品制作、切实可行的质控流程建立等。
对于初次开展ALK检测的实验室,建议在当地大医院借用阳性片、阴性片做对照,参照共识中的SOP,结合自己的实验条件摸索自己的最适时间、浓度等等条件建立自己的SOP,进行常规开展。
七、小结
本共识在国内外大量研究结果的基础上,结合我国临床检测的实际情况,提出了合理的ALK常规IHC初筛的规范化操作和判读流程。希望各检测实验室能根据各自实际情况,合理开展ALK阳性NSCLC患者的筛查。对于初筛阳性的患者,应迅速、及时地开展FISH或RT-PCR或Ventana IHC检测确诊,并力争优化确诊流程,缩短确诊时间。
本专家共识将根据实际情况,定期更新,期望能为未来进一步优化ALK筛查提供指导
常规免疫组织化学初筛ALK阳性 非小细胞肺癌专家共识——摘自(中华病理学杂志2015年第7期)

常规免疫组织化学初筛ALK阳性 非小细胞肺癌专家共识——摘自(中华病理学杂志2015年第7期)

常规免疫组织化学初筛ALK阳性 非小细胞肺癌专家共识——摘自(中华病理学杂志2015年第7期)
















共0条评论