美国宫颈癌筛查的争辩焦点之一:联合筛查对HPV单独筛查
作者:赵澄泉
单位:美国匹兹堡大学医学中心
编译:王巍伟 山东省诸城市妇幼保健院
审校:李 娟 山东省济南市妇幼保健院
赵澄泉 美国匹兹堡大学医学中学
宫颈癌筛查
美国宫颈癌筛查很多相关学会都有自己的指南,但2011年美国癌症学会、美国阴道镜病理学会、美国临床病理学会的指南是最为重要的。这个指南的制定由包括3个发起学会(ACS/ASCCP/ASCP)在内的25个学会或组织参入,检索所有有关文献,共选择了726篇发表文章作为参考,分为6个工作小组,各研究讨论一个专题,初步指南在网上广泛征求意见,最后参入定稿会议的专家逐条投票表达,2/3以上通过才会被采纳。2011年ACS/ASCCP/ASCP的修改指南,被美国其它大多数有关学会所采纳,广泛用于美国临床上宫颈癌筛查。
美国预防服务工作组(US Preventive Service Task Force,USPSTF)是由美国卫生部资助的,一个独立的在疾病预防和循证医学的国家专家小组,为政府策略负责和建议。所以其指南对美国国家老年人医疗保险制度(Medicare)和医疗补助计划(Medicaid)和商业保险公司报销补助计划有一定影响。2012年USPSTF宫颈癌筛查指南与ACS/ASCCP/ASCP的指南基本一致,2017年USPSTF宫颈癌筛查指南开始修改,在网上提出建议供大家公开评议。原建议是30岁及以上女性可以进行细胞学筛查3年一次,或者仅用HPV筛查5年一次,即用HPV单独筛查代替目前宫颈细胞学和HPV双筛5年一次的选项。美国众多的学会ASCCP、ASC、CAP和广大的妇科医生、病理医生等网上提议反对用HPV单筛代替联合筛查。2018年8月20日USPSTF在JAMA发布了其最终修改指南,采取了折中方案,既保留了联合筛查,也增加了HPV单独筛查。现在USPSTF指南是:A: 21-29岁女性妇科细胞学筛查3年一次;B:30岁及以上至65岁女性有3个选择:1)细胞学3年一次;2)HPV单独筛查5年一次;3)细胞学和HPV联合筛查5年一次。虽然2014年美国FDA批准罗氏HPV检查可用于25岁及以上妇女宫颈癌单独筛查,但USPSTF的最新指南是第一次HPV单独筛查出现在美国宫颈癌筛查的正式指南中。估计美国有关学会也会修改其宫颈癌筛查指南。HPV单独筛查取代细胞学和HPV共同筛查的证据主要来自于加州凯撒医疗集团(KPNC)自2003年以来,120多万30岁及以上妇女进行联合筛查(传统涂片和HC2)的结果。623例子宫颈癌和5369例CIN3/AIS有联合筛查史,其分析结果表明,联合筛查比HPV单查提高检出癌的敏感性作用极小。特别强调一点是KPNC医疗集团实验室在2009年之前一直用传统宫颈细胞学检查,而这不代表美国大多数实验室。UPMC Magee妇产医院是一个大型的大学妇女医学中心,Austin教授为主总结了我们实验室近13年宫颈癌筛查结果并且与KPNC结果相比较,表明用液基细胞学和HPV共同检查可明显提高对子宫颈癌和CIN3/AIS的检出率。我们的文章由美国临床病理学会核心期刊AJCP接收并于8月20号在线上提前全文公开发表 (https://doi.org/10.1093/ajcp/aqy114)。
美国疾控中心8月24号发布美国1999-2015年HPV相关癌症发病趋势(Van Dyne EA, Henley SJ, Saraiya M, Thomas CC, Markowitz LE, Benard VB. Trends in Human Papillomavirus Associated Cancers - United States, 1999-2015. MMWR Morb Mortal Wkly Rep. 2018;67:918-924)。下图显示美国1999-2015年校正年龄后女性子宫颈癌和男性咽喉部鳞状细胞癌的数据,实线代表子宫颈癌发生率。 总体来说,子宫颈癌发生率呈下降趋势,然而2013-2015年下降停止且呈稍微上升趋势。美国2009年开始逐渐延长宫颈细胞学筛查间期,从原来1年改为2-3年筛查一次,或联合筛查3年一次。2011年ACS/ASCCP/ASCP宫颈癌筛查共识指南建议细胞学筛查3年一次,或细胞学-HPV联合筛查(30岁及以上)5年一次。结合筛查间期延长和子宫颈癌下降趋势停止的变化,可能有许多因素,但我个人认为筛查间隔的延长有可能与子宫颈癌下降趋势停止有关。虽然有些临床试验显示适当筛查周期可能不影响子宫颈癌的筛查,但是真实情况只有历史才能给出准确结论。在美国相当多的病理医生、妇科医生对于筛查周期延长持保守态度,更不要说HPV单独检出5年一次的方案了。
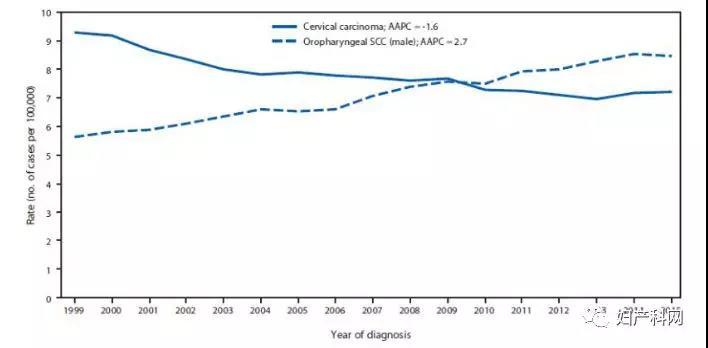
总之,子宫颈癌的筛查还是存在很多争议,所以我们全文翻译UPMC Magee妇女医院的下面这篇文章以供大家参考。主要希望中国广大医生及政策制定者了解到,美国2个大实验室临床临床回顾资料统计结果因诸多因素可以得出很不一致的结论,所以中国可以参照国外的相应指南,但是应有自己的研究资料、实验室数据以建立适合中国国情的科学指南。
液基细胞学在联合筛查中的正确使用可明显增加子宫颈癌和癌前病变检出率
R. Marshall Austin,【1】 Agnieszka Onisko,【1】,【2】赵澄泉【1】
1匹兹堡大学医学中心病理科,2波兰比亚韦斯托克理工大学计算机科学学院
American Journal of Clinical Pathology, Published: 20 August 2018
摘要
目的: 宫颈癌筛查是为预防宫颈癌(CxCa),最大程度减少其发生率和致死率。大多数发表的关于美国对30岁及以上女性细胞学和HPV联合筛查研究是来自同一个实验室,它自2003-2009年使用的是传统细胞学检查。 方法: 自从2005年,在Magee妇产医院有300800例次联合筛查,分析组织学诊断为宫颈癌和CIN3/AIS前联合筛查状况,用以评估细胞学和HPV检测的作用。联合筛查使用FDA认证的新柏氏液基和HPV检测,且来源同一取样标本。 结果: 液基细胞学比HPV实验检测出更多宫颈癌和CIN3/AIS。13.1%宫颈癌和7.2%CIN3/AIS有HPV阴性/细胞学阳性的历史。 结论: 结合液基细胞学的联合筛查比传统细胞学的联合筛查能明显增加检测宫颈癌和CIN3/AIS的敏感性。
美国癌症学会(American Cancer Society)、美国阴道镜和宫颈病理学学会(American Society for Colposcopy and Cervical Pathology)、美国临床病理学会(American Society for Clinical Pathology)及美国妇产科学会[1,2](American College of Obstetricians and Gynecologists)已达成共识指南,人类乳头状瘤病毒(HPV)和宫颈细胞学(Pap)联合筛查是当前≥30岁女性子宫颈癌筛查的首选方法。已经发表的一些非常大的美国临床数据对常规子宫颈癌筛查中联合筛查的作用和对筛查女性组织病理学随访诊断为宫颈高级别上皮内病变(HSIL)及浸润性宫颈癌(CxCa)的风险进行了评估[3-6]。这些大规模的分析数据几乎均来自同一大的实验室,即Kaiser Permanente Northern California(KPNC)。在KPNC实验室,自2003年以来,120多万≥30岁女性进行了每3年一次的子宫颈癌联合筛查。但是,该实验室所采取的一些子宫颈癌筛查方法在美国并不常见。首先,2009年之前,KPNC完全采用传统宫颈细胞学涂片,因此,该实验室可能是最后一个采用液基细胞学(LBC)的美国大型实验室[7]。据我们所知,目前只有美国监狱系统仍然主要采用传统宫颈细胞学涂片。此外,KPNC将宫颈细胞学和HPV样本作为两种单独的样本进行收集,而不是按照食品和药品监督管理局(FDA)临床试验所推荐的从宫颈细胞学同一取样标本中吸取样本进行HPV检测[6,8]。除KPNC的报告外,全国范围内只有一项来自Quest Diagnostics数据库关于860万患者的联合筛查结果,该研究采用FDA批准的液基细胞学方法并对同一瓶样本进行细胞学和HPV检测[4]。由于KPNC的研究数据[6]使得我们对细胞学在联合筛查宫颈癌和癌前病变中的作用产生了质疑,因此,我们决定分析我们自己(一所大型学术性妇女医院实验室)更加丰富的联合筛查临床经验。我们采用最为普遍使用的FDA批准的宫颈液基细胞学检测方法和FDA批准的同一瓶样本取样进行HPV检测的联合筛查方法。
一、材料和方法(Magee妇女医院数据) 该研究分析了从2005年1月至2017年8月美国匹兹堡大学医学中心(UPMC)Magee妇女医院(MWH)近13年收集的子宫颈癌筛查数据。该数据库显示了子宫颈癌筛查结果,子宫颈癌筛查均普遍采用经FDA批准的方法,包括:新柏氏宫颈液基细胞学检测[9](Hologic Corp, Bedford, MA)、新柏氏计算机辅助液基细胞学成像系统[10](Hologic Corp, Bedford, MA)以及收集瓶保存液内样本高危型HPV(hrHPV)检测,而高危型HPV检测方法包括:Digene杂交捕获二代HPV检测[11](开始至2013年5月)(Qiagen Corp, Gaithersburg, MD)、Cervista高危型HPV检测[12](2013年6月至2015年5月)、Aptima HPV检测[13](2015年6月至今)(Hologic/Gen-Probe, San Diego, CA)。细胞学结果采用2001 TBS报告系统[14]。在资料分析中,宫颈细胞学报告为ASC-US及以上的细胞学异常均定义为细胞学检查阳性。 Magee妇女医院数据库中有270263例≥30岁女性所进行的748947例次液基细胞学检测结果,其中300800例次(40.2%)液基细胞学样本进行了高危型HPV检测。其中大约8.8%(66045例)有液基细胞学检测结果的女性有宫颈组织病理随访结果。Magee妇女医院数据库中还包括一些临床信息,例如:感染病史、癌、使用避孕方法、月经史、以及HPV疫苗注射情况。该研究中,我们分析的重点是≥30岁女性中至少进行过一次宫颈液基细胞学和HPV联合筛查的女性。186000名女性有300800例次的联合筛查结果,129例浸润性宫颈癌和632例CIN3或原位腺癌(AIS)女性在组织学诊断之前有联合筛查结果。为了便于比较,本文所采用的分析报告方式与KPNC最近发布的最大、最新的联合筛查数据报告方式相似[6]。 Magee妇女医院子宫颈癌筛查联合筛查数据分析同时采用了匹兹堡子宫颈癌筛查模型[15-18](PCCSM)。该模型是一种动态Bayesian网络,由GeNIe和SMILE(结构建模、推理和学习工具)构成,这是匹兹堡大学决策系统实验室开发的用于图解概率模型的创建和推理的开发平台(http://www. bayesfusion.com)。PCCSM是建立在专家共识和MWH-UPMC 13年多实践经验中持续的后续数据收集基础之上。持续更新的模型包括:宫颈癌筛查结果、避孕史、月经史、人口统计资料以及妇产科手术治疗结果。基于MWH-UPMC系统数据,PCCSM模型考虑到了不同随访时间内患者进展为具有明确诊断标准病变(例如:活检证实为子宫颈癌前病变或子宫颈浸润性癌)的定量风险分层。
二、结果 1、诊断为宫颈浸润性癌和癌前病变之前的联合筛查数据 我们首先分析了诊断为浸润性宫颈癌和CIN3/AIS之前的联合筛查数据。表1示所有诊断为浸润性宫颈癌之前的HPV和细胞学联合筛查结果,根据肿瘤组织病理学特征(鳞癌、腺癌或腺鳞癌及其他子宫颈癌)对其总体和分布情况进行分析。129例女性诊断为宫颈癌之前有198例次联合筛查结果;这些之前的联合筛查结果中,HPV阳性率为76.3%,细胞学阳性率(ASC-US阳性)为83.3%;诊断为宫颈癌之前,89.4%女性为HPV阳性或细胞学阳性。
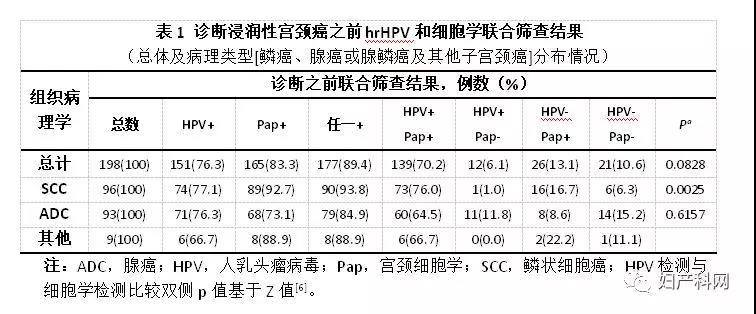
表2示所有诊断为癌前病变(CIN3和/或AIS)之前的HPV和细胞学联合筛查结果,根据组织病理学特征(CIN3和AIS)对其总体和分布情况进行了分析。632例诊断为CIN3 / AIS之前有1000例次联合筛查结果;这些之前的联合筛查结果中,HPV阳性率为86.7%,细胞学阳性率(ASC-US阳性)为91.0%;诊断为CIN3 / AIS之前,93.3%女性为HPV阳性或细胞学阳性。 表3对组织病理学诊断为浸润性宫颈癌或宫颈癌前病变(CIN3/AIS)之前12个月内及12个月以上的HPV和细胞学联合筛查结果宫颈癌进行了比较。与组织病理学诊断为浸润性宫颈癌或宫颈癌前病变(CIN3/AIS)之前≥12个月的HPV和细胞学联合筛查结果相比,12个月内HPV和细胞学联合筛查结果更可能为阳性(HPV阳性和/或细胞学阳性)。若为组织病理学诊断浸润性宫颈癌(90.8% vs 84.4%)或宫颈癌前病变(CIN3/AIS)(97.9% vs 95.9%)之前12个月内进行HPV和细胞学联合筛查,异常细胞学结果较HPV阳性结果更有可能出现。若组织病理学诊断浸润性宫颈癌(74.2%vs 66.3%)或宫颈癌前病变(CIN3/AIS)(81.3% vs 73.8%)之前≥12个月进行HPV和细胞学联合筛查,同样为异常细胞学结果较HPV阳性结果更有可能出现。
2、宫颈浸润性癌和癌前病变诊断之前联合筛查结果的时间分布 图1示组织病理学诊断为浸润性宫颈癌或宫颈癌前病变(CIN3/AIS)之前联合筛查的时间分布,0-0.5年(6个月)0.5-1年、1-2年、3-4年、4-5年、5-6年以及6年以上。先前的联合筛查结果显示为HPV+/Pap+(红色)、HPV+/Pap-(橘色)、HPV-/Pap+(绿色)或HPV-/Pap-(蓝色)。 图2示PCCSM推测与MWH联合筛查结果相关宫颈癌的 5年累计风险,包括每个单独TBS细胞学分类所示HPV阳性(红色)或HPV阴性(蓝色)的联合筛查结果。HPV阴性/细胞学阳性病例发生宫颈癌的风险仅能从联合筛查中细胞学检查得以体现。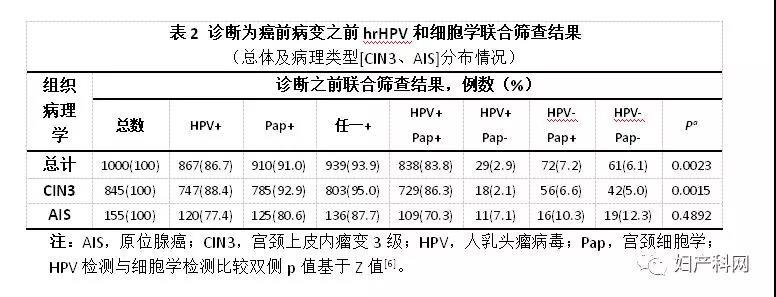
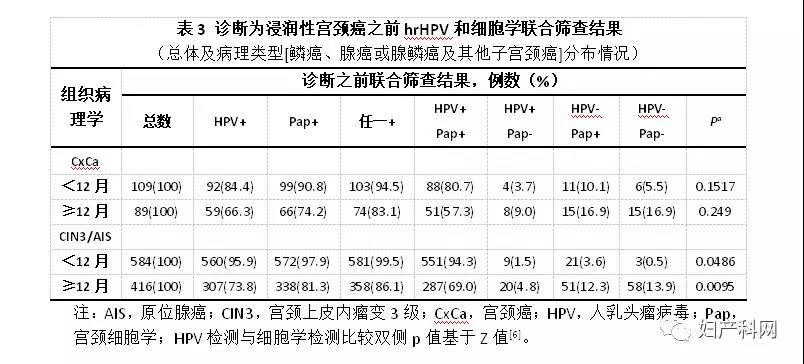
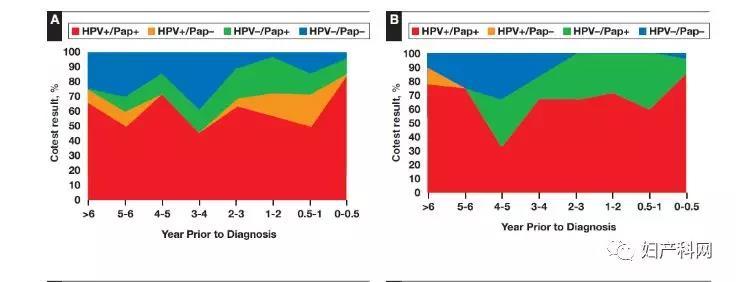
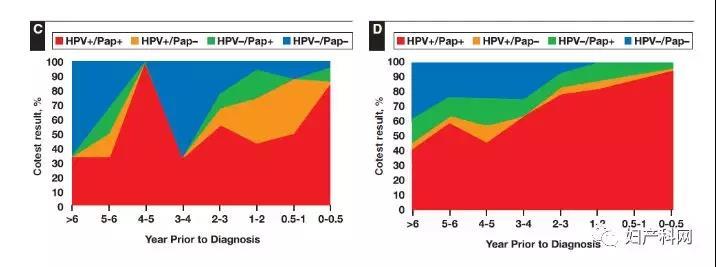
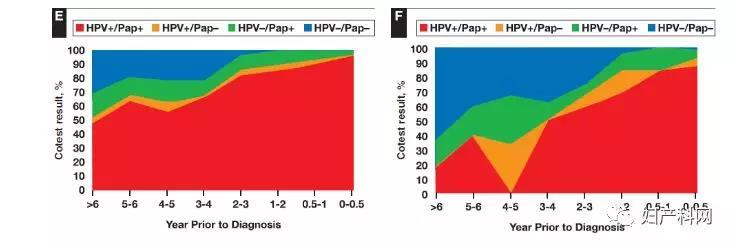
图1 病理学诊断为浸润性宫颈癌或宫颈癌前病变(CIN3/AIS)前联合筛查时间分布图。A示所有宫颈癌;B示鳞状细胞癌;C示腺癌;D示所有宫颈癌前病变;E示CIN3;F示AIS。HPV,人乳头瘤病毒;Pap,宫颈细胞学
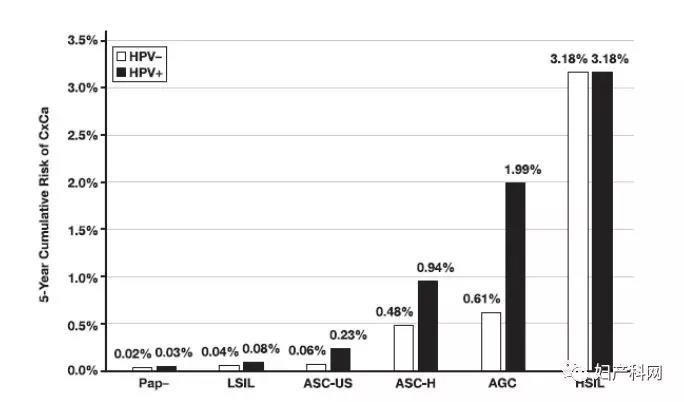
图2 匹兹堡宫颈癌筛查模型(PCCSM)风险评估。AGC:非典型腺细胞;ASC-H:非典型鳞状上皮细胞,不除外高级别鳞状上皮内病变;ASC-US:非典型鳞状上皮细胞,意义不明确;CxCa:宫颈癌;HPV:人乳头瘤病毒;HSIL:高级别鳞状上皮内病变;LSIL:低级别鳞状上皮内病变;Pap,宫颈细胞学。
三、讨论 该研究与KPNC大型联合筛查研究报告[3,5-7]细胞学结果有显著差异。我们研究显示,在≥30岁联合筛查女性中,与FDA批准液基细胞同一取样标本进行HPV检测相比,液基细胞学对于宫颈癌和 CIN3/AIS的检出更具有优势;然而,KPNC研究显示,HPV联合筛查随着传统宫颈细胞学涂片的大规模使用使得后期诊断为宫颈癌和癌前病变的女性更多[6]。如上所述,KPNC采用了一些在美国并不常见的子宫颈癌筛查方法,这可能与我们在联合筛查女性中的不同发现有关。我们认为,2003年至2009年间[7],KPNC独家所采用的传统宫颈细胞学涂片方法最值得关注。许多大型数据对液基细胞学和传统宫颈细胞学涂片两种方法中高级别鳞状上皮内病变和宫颈癌检出率进行了比较,结果一致显示液基细胞学对于明显异常细胞的检出率较高[19-23]。液基细胞学异常细胞检出率的提高,主要是由于宫颈细胞收集装置获取细胞数量的增加以及即刻湿性固定[24]带来的判读优势,同时还有机会利用液基细胞瓶中剩余液体进行辅助性分子检测。虽然有一部分研究者仍然质疑液基细胞学的优势,他们所依据的是两家实验室的国际性试验,但是相对来讲,这两家实验室并无液基细胞学方法的使用经验,而且没有记录液基细胞学判读资质[25,26],在质量控制更为严格的英国子宫颈癌筛查系统所进行的临床试验表明,与传统宫颈细胞学涂片相比,液基细胞学可以显著提高子宫颈癌筛查的作用[27]。英国Artistic临床试验同样显示了液基细胞学可以更好的预防子宫颈癌的发生;Artistic临床试验中,在实验开始2.5年到8年后,所有子宫颈癌都发生在HPV筛查组中,而同期在细胞学筛查组中没有检查到子宫颈癌。欧洲一些国家(荷兰、意大利、瑞典)使用传统宫颈细胞学涂片进行临床试验结果与之相反,即与传统宫颈细胞学涂片相比,HPV检测可以更多的预防宫颈癌的发生[28]。 本研究还强调了诊断宫颈癌和CIN3/AIS之前时间长短在子宫颈癌筛查检测作用下降中的重要性(图1)。虽然关于延长筛查间隔的安全性一直存在争议[29],但是当前指南对于大多数宫颈细胞学和HPV联合筛查结果均为阴性女性仍然推荐5年筛查间期[1,2]。本研究和KPNC研究均发现[6],当宫颈癌和CIN3/AIS诊断之前12个月以上的检测,细胞学和HPV检出率均大幅下降,这部分人群中KNPC和MWH的HPV阳性率基本相似,分别为62.8%[6]和66.3%(表3),而细胞学阳性率明显不同,KNPC和MWH分别为28.7%[6]和74.2%(表3)。距离宫颈癌诊断之前时间的越久HPV检出率就越低[30],最可能是由于病变较小以及病变细胞取样困难的增加。欧洲临床试验中,开始筛查后2.5-8年发展为宫颈癌女性HPV阴性基准率增长为42%[28]。这些很少得到承认的数据并不能让人安心,一些项目现在采用的是延长5-10年的筛查间期[31]。甚至KPNC和国家癌症研究所(National Cancer Institute)共同研究者最近承认,日常工作中采用HPV检测的障碍之一就是缺乏长期、纵向的安全性数据来支持[32]。 该研究数据证实,不同实验室的细胞学检查表现可以显著影响细胞学对联合筛查和严重宫颈病变检测的作用。除了先前所述液基细胞学较传统宫颈细胞学涂片的优点外,还需要承认很多实验室液基细胞学检测也可能未达到最佳标准。我们之前报道过液基细胞学用于检测组织病理学CIN2/3/AIS/CxCa病变验证偏倚校正(VBA)的敏感性高达93%[33] 。与之相比,参加Cobas HPV检测ATHENA试验的四家大型实验室的细胞学表现明显低于最佳标准,VBA CIN3阳性年龄分层敏感性仅为27% -42%[30] 。甚至,在这四个实验室中,VBA校正敏感性出现了显著变化[34]。Magee妇女医院长期以来一直采用的子宫颈癌筛查方法,我们将其称为“学习基础上的子宫颈癌筛查(Cervical Cancer Audit-Based Screening)”[35,36],例如异常不成熟化生鳞状上皮细胞和非典型腺细胞是前瞻性筛查被特别强调的内容之一,而在宫颈癌病例的回顾性学习中,这些异常通常仅在少数病例中出现。细胞学技术员保守的低容量筛查(每日筛查相对较少量片子)以及集中持续的进行人员培训是这一方法的重要组成部分[33,35]。 该研究数据还与联合筛查在检测难以预防性宫颈腺癌中的作用相关[37] 。KPNC数据强调了HPV阳性/细胞学阴性结果在检测宫颈腺癌中的重要性[38],在KPNC发表的最大联合筛查资料显示36.1%(160/443)宫颈腺癌女性有既往HPV阳性/细胞学阴性联合筛查结果[6]。与之相反,Magee妇女医院既往联合筛查结果显示HPV阳性/细胞学阴性的宫颈腺癌女性仅为11.8%(11/93)(表1)。KPNC和Magee妇女医院联合筛查后诊断为腺癌女性中,HPV阳性率相似,分别为79.0%和76.3%;但是,异常细胞学(细胞学阳性)检出率明显不同,分别为45.4%(KPNC)和73.1%(Magee)(表1)。再次表明不同的实验室细胞学检测的水平可显著影响细胞学在联合筛查检出宫颈癌及癌前病变的作用。 研究子宫颈癌筛查方案的临床试验数据一般强调更为常见的CIN3或CIN2的检出,认为子宫颈癌筛查的主要目的就是在癌症发生之前发现癌前病变[6]。然而,大多数CIN2病变会自发消退,特别是年轻女性[39]。即使是CIN3女性,未经治疗的长期自然病史研究表明,30年内只有30%的CIN3病变进展为宫颈癌 [40]。由于大多数CIN2/3病变并不会进展为宫颈癌,检测这些无进展的CIN2/3病变并不能加强对宫颈癌的预防,一些研究者称之为过度诊断[41] 。因此,对于不太常见的发展为浸润性宫颈癌终末点的预防作用评估变的更加重要。我们Bayesian模型技术可以进行宫颈癌风险的长期预测,同时也直接反映了当地筛查系统数据和治疗方法。采用PCCSM进行Bayesian预测证实宫颈癌风险与HPV阴性/细胞学阳性(异常)结果相关,这种相关性风险可以在Magee妇产医院用计算机影像学指导的液基细胞学和HPV联合筛查中明显可见(图1)。

参考文献:
1) Saslow D, Solomon D, Lawson HW, et al. American Cancer Society, American Society for Colposcopy and Cervical Pathology, and American Society for Clinical Pathology screening guidelines for the prevention and early detection of cervical cancer. ACS-ASCCP-ASCP Cervical Cancer Guideline Committee. CA Cancer J Clin 2012; 62:147–72.
2) Cervical cancer screening and prevention. Practice Bulletin No. 168. American College of Obstetricians and Gynecologists. Obstet Gynecol 2016; 128:e111–30.
3) Gage JC, Schiffman M, Katki HA, et al. Reassurance against future risk of precancer and cancer conferred by a negative human papillomavirus test. J Natl Cancer Inst. 2014; 106(8):dju153.
4) Blatt AJ, Kennedy R, Luff RD, Austin RM, Rabin DS. Comparison of cervical cancer screening results among 256,648 women in multiple clinical practices. Cancer Cytopathol. 2015; 123(5):282–288.
5) Castle PE, Kinney WK, Cheung LC, et al. Why does cervical cancer occur in a state-of-the art screening program? Gynecol Oncol 2017; 146: 546-553.
6) Schiffman M, Kinney WK, Cheung LC, et al. Relative performance of HPV and cytology components of cotesting in cervical screening. J Natl cancer Inst 2018; 110 (5): djx225
7) Katki HA, Schiffman M, Castle PE, et al. Five-year risk of CIN3+ and cervical cancer for women with HPV-positive and HPV-negative high grade Pap results. J Lower Genit Tract Dis 2013; 17: S50-S55.
8) US Department of Health and Human Services. Food and Drug Administration. Guidance for Industry and Food and Drug Administration Staff. Establishing the performance characteristics of in vitro diagnostic devices for the detection or detection and differentiation of human papillomaviruses. November 28, 2011.
9) Lee KR, Ashfaq R, Birdsong GG, Corkill ME, McIntosh KM, Inhorn SL. Comparison of conventional Papanicolaou smears and a fluid-based, thin-layer system for cervical cancer screening. Obstet Gynecol. 1997;90:278–284.
10) Davey E, d’Assuncao J, Irwig L, et al. Accuracy of reading liquid-based cytology slides using the ThinPrep Imager compared with conventional cytology: prospective study. BMJ 2007;335:31-35.
11) Terry G, Ho L, Londesborough P, et al. Detection of high risk HPV types by the hybrid capture 2 test. J Med Virol. 2001; 65:155-162.
12) Einstein MH, Martens MG, Garcia FA, et al. Clinical validation of the Cervista HPV HR and 16/18 genotyping tests for use in women with ASC-US cytology. Gynecol Oncol 2010;118:116-122.
13) Iftner T, Becker S, Neis KJ, et al. Head-to-head comparison of the RNA-based Aptima human papillomavirus (HPV) assay and the DNA-based Hybrid Capture 2 HPV test in a routine screening population of women aged 30 to 60 years in Germany. J Clin Microbiol. 2015;53:2509-2516.
14) Solomon D, Davey D, Kurman R, et al; Forum Group Members; Bethesda 2001 Workshop. The 2001 Bethesda System: terminology for reporting results of cervical cytology. JAMA. 2002; 287:2114-2119.
15) Austin RM, Onisko A, Druzdzel MJ. The Pittsburgh Cervical Cancer Screening Model. A risk assessment tool. Arch Pathol Lab Med. 2010; 134:744–750
16) Onisko A, Austin RM. Dynamic Bayesian Network for Cervical Cancer Screening, Chapter 13, pages 207-218 in Peter JF Lucas and Arjen Hommersom (Editors), Foundations of Biomedical Knowledge Representations, Methods and Applications, Lecture Notes on Artificial Intelligence, Springer International Publishing, Switzerland 2015.
17) Austin RM, Onisko A, Druzdell MJ. Increased cervical cancer risk associated with extended screening intervals after negative human papilloma virus (HPV) test results: Bayesian Risk Estimates using the Pittsburgh Cervical Cancer Screening Model. JASC. 2016; 5: 9-14.
18) Onisko A, Druzdzel MJ, Austin RM. How to interpret the results of medical time series data analysis: Classical statistical approaches versus dynamic Bayesian network modeling. Journal of Pathology Informatics, 2016; 7:50.
19) Bernstein SJ, Sanchez-Ramos L, Ndubisi B. Liquid-based cervical cytologic smear study and conventional Papanicolaou smears: a metaanalysis of prospective studies comparing cytologic diagnosis and sample adequacy. Am J Obstet Gynecol. 2001;185:308-317.
20) Abulafia O, Pezzullo JC, Sherer DM. Performance of ThinPrep liquid-based cervical cytology in comparison with conventionally prepared Papanicolaou smears: a quantitative survey. Gynecol Oncol. 2003;90:137-144.
21) Nance KV. Evolution of Pap testing at a community hospital-a ten year experience. Diagn Cytopathol. 2007;35:148-153.
22) Tao X, Austin RM, Zhang H, et al. Pap test reporting rates for conventional smear and liquid-based cervical cytology from the largest academic women’s hospital in China: analysis of 1,248,785 Pap test reports. Acta Cytol. 2015; 59:445-451.
23) Zheng B, Austin RM, Liang X, et al. Bethesda System reporting rates for conventional Papanicolaou tests and liquid-based cytology in a large Chinese, College of American Pathologists-certified independent medical laboratory: analysis of 1394389 Papanicolaou test reports. Arch Pathol Lab Med. 2015;139:373-377.
24) Hutchinson ML, Isenstein IM, Goodman A, et al. Homogeneous sampling accounts for the increased diagnostic accuracy using the ThinPrep Processor. Am J Clin Pathol. 1994;101:215-219.
25) Ronco G, Cuzick J, Pierotti P, et al: Accuracy of liquid based versus conventional cytology: overall results of new technologies for cervical cancer screening: randomized controlled trial. BMJ 2007; 335: 28.
26) Siebers AG, Klinkhamer PJ, Grefte JM, et al: Comparison of liquid-based cytology with conventional cytology for detection of cervical cancer precursors: a randomized controlled trial. JAMA 2009; 302: 1757–1764.
27) Kitchener HC, Almonte M, Gilham C, et al: ARTISTIC: a randomised trial of human papillomavirus (HPV) testing in primary cervical screening. Health Technol Asses 2009; 13: 1-150.
28) Ronco G, Dillner J, Elfstrom KM, et al. Efficacy of HPV-based screening for prevention of invasive cervical cancer: follow-up of four European randomized controlled trials. Lancet Oncol 2014;383:524-32.
29) Kinney W, Wright TC, Dinkelspiel HE, et al. Increased cerivcal cancer risk associated with screening at longer intervals. Obstet Gynecol 2015; 125: 311-315.
30) Stoler MH, Austin RM, Zhao C. Point- Counterpoint: Cervical cancer screening should be done by primary HPV testing with genotyping and reflex cytology for women over the age of 25 years. J Clin Microbiol 2015; 53: 2798-2804.
31) Dijkstra MG, van Zummeren M, Rozendaal L, et al. Safety of extending screening intervals beyond five years in cervical screening programmes with testing for high risk human papillomavirus: 14 year follow-up of population based randomised cohort in the Netherlands. BMJ 2016;355:i4924
32) Castle PE, Kinney WK, Xue X, et al. Effect of several rounds of human papillomavirus and cytology co-testing on safety against cervical cancer. Ann Int Med 2018; 168:20-29.
33) Zhao C, Florea A, Onisko A, Austin RM. Histologic follow-up results in 662 patients with Pap test findings of atypical glandular cells: results from a large academic womens hospital laboratory employing sensitive screening methods. Gynecol Oncol 2009; 114: 383-389.
34) Wright TC, Stoler MH, Behrens CM, et al. Interlaboratory variation in the performance of liquid-based cytology: Insights from the ATHENA trial. Int J Cancer 2014; 134: 1835-1843.
35) Austin RM, Zhao C. Observations on Pap Test Litigation. Pathology Case Reviews 2011; 16: 73-82.
36) Castanon A, Ferryman S, Patnick J, Sasieni P. Review of cytology and histopathology as part of the NHS Cervical Screening Programme audit of invasive cervical cancers. Cytopathology. 2012; 23:13-22.
37) International Collaboration of Epidemiological Studies of Cervical Cancer. Comparison of risk factors for invasive squamous cell carcinoma and adenocarcinoma of the cervix: collaborative reanalysis of individual data on 8,097 women with squamous cell carcinoma and 1,374 women with adenocarcinoma from 12 epidemiological studies. Int J Cancer. 2006;120:885-891.
38) Kinney W, Fetterman B, Cox JT, et al. Characteristics of 44 cervical cancers diagnosed following Pap-negative, high risk HPV-positive screening in routine clinical practice. Gynecol Oncol 2011; 121: 309-313.
39) Taino K,Athanasiou A, Tikkinen KAO, et al Clinical course of untreated cervical intraepithelial neoplasia grade 2 under active surveillance: systematic review and meta-analysis. BMJ 2018;360: k499.
40) McCredie MRE, Sharples KJ, Paul C, et al. Natural history of cervical neoplasia and risk of invasive cancer in women with cervical intraepithelial neoplasia 3: a retrospective cohort study. Lancet Oncol 2008; 9: 425–34.
41) Malila N, Leinonen M, Kotaniemi-Talonen L, et al. The HPV test has similar sensitivity but more diagnosis than the Pap test- A randomized health services study on cervical screening in Finland. Int J cancer 2013; 132: 2141-2147.
责任编辑:华夏病理 本站欢迎原创文章投稿,来稿一经采用稿酬从优,投稿邮箱tougao@ipathology.com.cn
相关阅读
 数据加载中
数据加载中
我要评论

热点导读
-

淋巴瘤诊断中CD30检测那些事(五)
强子 华夏病理2022-06-02 -

【以例学病】肺结节状淋巴组织增生
华夏病理 华夏病理2022-05-31 -

这不是演习-一例穿刺活检的艰难诊断路
强子 华夏病理2022-05-26 -

黏液性血性胸水一例技术处理及诊断经验分享
华夏病理 华夏病理2022-05-25 -

中老年女性,怎么突发喘气困难?低度恶性纤维/肌纤维母细胞性肉瘤一例
华夏病理 华夏病理2022-05-07







共0条评论