[导读] 整理作者:黄慧(江西省儿童医院)
尤文肉瘤及其类似且可能相关的小圆细胞肿瘤的发展史:我们从何方来,要到何方去?(一)
尤文肉瘤及其类似且可能相关的小圆细胞肿瘤的发展史:我们从何方来,要到何方去?(二)
尤文肉瘤及其类似且可能相关的小圆细胞肿瘤的发展史:我们从何方来,要到何方去?(三)
尤文肉瘤及其类似且可能相关的小圆细胞肿瘤的发展史:我们从何方来,要到何方去?(四)
摘要:小圆细胞肿瘤的诊断一直是非常困难的,且其分类在不断发展变化。自从詹姆斯·尤文博士首次发现这一肿瘤后,“尤文肉瘤”这个名称下的历史背景就发生了变化。尽管尤文肉瘤和原始神经外胚层肿瘤都是在20世纪初被首次描述的,但这些肿瘤在同一个世纪末(大约75年后)被认为可能是不同的实体。随着现代免疫组织化学和分子技术的进步,人们对尤文肉瘤和尤文样肿瘤的认识有了很大的提高,但也提出了新的问题和挑战。我们现在知道,这类肿瘤明显比最初认为的更具异质性,特别是在其细胞遗传学和分子特征方面,其中一些差异可能具有预后相关性。无论我们现在是扩大尤文肉瘤的范围,还是仅仅认识新的独立的疾病,都是有争议的。解决这些新类别和/或独立的疾病的治疗方法需要进一步关注。因此,我们综述了尤文肉瘤、尤文样肿瘤(CIC和BCOR重排肉瘤)和相关和/或类似的小圆细胞肿瘤(间叶性软骨肉瘤、促结缔组织增生性小圆细胞肿瘤和小细胞骨肉瘤)的研究进展及历史展望。我们还试图提供关于尤文肿瘤家族进一步分类和临床相关性的最新信息和见解。
小细胞骨肉瘤
1979年,sim等人首次将发生于骨的小细胞骨肉瘤定义为一种独特的临床病理实体,称之为“具有类似于尤文肿瘤的小细胞骨肉瘤”。在梅奥诊所,从1000例连续骨肉瘤和300例连续尤文肉瘤中挑选出12例(除了12例咨询病例)符合上述标准的病例。12例肿瘤都含有“粉红色基质”,被认为是“骨样基质”,位于小圆形到椭圆形肿瘤细胞之间,不像尤文肉瘤中看到的那样一致[uniform]。偶尔观察到局灶的梭形细胞。检测的11例患者中PAS染色均为阴性。然而,作者认为尤文肉瘤的诊断是成立的,即使PAS染色是阴性。区分尤文肉瘤和小细胞骨肉瘤最重要的原因是因为治疗。对尤文肿瘤而言,手术切除是必要的,而不是放疗。虽然放射敏感性的概念在历史上被用作诊断尤文肉瘤的一个要素,但放射敏感性差也是支持小细胞骨肉瘤确实不同于尤文肉瘤的观点。我们应该指出,在上述资料发表之前,Jacobson记录了37例他统称为“多发性组织瘤”[polyhistioma]的病例,这些病例主要包括间叶性软骨肉瘤,但也有一些可能称为小细胞骨肉瘤更好的病例。事实上,他承认“许多小细胞骨肉瘤非常像这种病例。”1997年,Nakajima等人试图确定区分小细胞骨肉瘤和尤文肉瘤的临床和治疗重要性。对72例患者(45例有治疗和随访数据)的分析结果表明,小细胞骨肉瘤(5年生存率为28.5%)的预后明显低于经典型骨肉瘤(77%)和尤文肉瘤(50%)。然而,在最近的病例报道中,发现那些自1975年以来并受益于新辅助化疗的病例,小细胞骨肉瘤的5年累积生存率为68.6%。关于鉴别诊断,作者们说只有在肿瘤内发现骨样基质生成,小细胞骨肉瘤的诊断就是成立的。从分子角度来看,大多数小细胞骨肉瘤含有复杂的核型,没有重现性的结构异常或染色体易位。据我们所知的文献报道,有6例小细胞骨肉瘤含有t(11;22) (q24;q12) 核型和/或EWSR1重排的。如前所述,有2例报道称BCOR基因重排的肉瘤具有骨样基质。这些病例是否应归类为小细胞骨肉瘤尚不清楚。Righi等人最近分析了36例小细胞骨肉瘤的临床病理特征。所有病例均表现为SATB2强阳性和CD99阴性(我们应该指出,其他文献有发现CD99胞质阳性在小细胞骨肉瘤中相对常见,偶尔有弥漫膜阳性出现)。对10例检测EWS-FLI1、EWS-ERG和CIC-DUX4融合基因,均为阴性(PCR法)。作者认为,以前文献中记载的具有EWSR1基因重排的小细胞骨肉瘤,无论这些肿瘤是否产生骨样基质,都应认为是尤文肉瘤。然而,这种说法需要我们重新评估“骨肉瘤”的定义。大多数人仍然认为诊断小细胞骨肉瘤是需要有与小圆蓝细胞恶性肿瘤密切相关的骨样基质产生。小细胞骨肉瘤也有可能是一个“垃圾桶”,包括与类骨生成有关的所有小细胞肿瘤,大多数缺乏重现性的分子事件,但少数肿瘤具有EWSR1或BCOR基因重排。正如预期的那样,后者应如何治疗也不清楚。
间叶性软骨肉瘤
间叶性软骨肉瘤于1959年由Lichtenstein和Bernstein首次描述,这2例病例(发生于26岁男性的椎骨和22岁女性的顶骨)的形态学表现为“肿瘤由致密的、丰富的细胞和原始的短粗梭形细胞基质组成,部分区域表现出软骨样分化。”两名患者都出现了广泛的骨骼转移,最终死于疾病。Dahlin和Henderson于1961年对10例(上颌和肋骨各2例,跖骨、颈椎、肩胛骨、髂骨、脑膜和起源不明各1例)间叶性软骨肉瘤进行了观察,其中6例患者年龄为30~40岁,虽然8名患者死亡,但临床进展不同,从治疗到死亡的间隔时间为5个月~25年。组织学上,细胞丰富区主要由“轻微到明显的梭形”的小细胞组成,核分裂象多少不等,具有特征性的病变是多少不等的明显或不明显的软骨样病灶和未分化的小细胞。梅奥诊所在1971年用30个新病例进一步扩展了他们的数据(使文献中的总数达到51例,其中17例是纯软组织病例),有超过半数肿瘤患者的年龄为20~30岁,肋骨和颌骨是最好发部位。多数病例至少出现局灶血管外皮瘤样改变。在生存率和治疗反应方面,不同发病部位(骨和软组织)之间没有差异。如前所述,Jacobson最初试图将间叶性软骨肉瘤(和一些小细胞骨肉瘤的病例)包括在“多发性组织瘤”[polyhistioma]的名称下,他认为“间叶性软骨肉瘤”一词是“不合适的”,因为软骨分化并不总是发生,而且尚未证实原始细胞是间叶细胞。但到1977年Jacobson的文章发表时,“间叶性软骨肉瘤”这个术语已经根深蒂固,因此在文献中被普遍接受。
软骨样基质的存在是区分间叶性软骨肉瘤和尤文肉瘤的主要形态学要素,特别是在小活检标本中。如果没有,就很难区分这两个疾病。更复杂的是,大多数间叶性软骨肉瘤弥漫表达CD99,通常是膜阳性。早期的细胞遗传学研究未能确定一个重现性的核型。直到最近,最常见的细胞遗传学异常是涉及13和21号染色体罗伯逊易位。至少有1例含有经典型尤文肉瘤t(11;22)的报道。然而,还不清楚融合基因(如EWSR1-FLI1)是否也相似。现在我们知道大多数间叶性软骨肉瘤含有一种相对特异的基因融合HEY1-NCOA2。由于HEY1(8q21.1)和NCOA2(8q13.3)基因在8号染色体上相隔仅10MB,传统的细胞遗传学很难发现。虽然融合基因的鉴定主要依赖于对先前存在的染色体结构变化的识别,但是利用一种新的“全基因组”筛选的外显子表达数据证实了HEY1-NCOA2基因融合。现在可以证实间叶性软骨肉瘤是一种具有独特临床病理学特征的病种。
促结缔组织增生性小圆细胞肿瘤
Gerald和Rosai最初描述的“具有异向分化[divergent differentiation]的促结缔组织增生性小细胞肿瘤”在1989年被“促结缔组织增生性小圆细胞肿瘤”这个术语取代。Sesternhen等人在1987年首次在17名年轻男性患者中描述了涉及骨盆或阴囊的肿瘤。高度恶性的小圆细胞肿瘤通常累及大龄儿童和成人,最常见于腹腔,包括附睾、胸膜和骨等部位也有报道。病理学特点是巢状和束状小圆细胞被成纤维基质分隔并表现出多种免疫表型(包括神经、肌源性和上皮标记物)。很少促结缔组织增生性小圆细胞肿瘤表达CD99,但WT1(羧基端)通常阳性。该肿瘤侵袭性高,多次局部复发,大多数患者于2~3年内死于该疾病。1992年首次发现该肿瘤大部分病例存在t(11;22)(p13;q11.2)易位导致EWSR1-WT1基因融合。然而,在尤文肉瘤和促结缔组织增生性小圆细胞肿瘤之间,仍有少数发生于腹部的促结缔组织增生性小圆细胞肿瘤表现出明显的“混合”[hybrid]特征,表现为促结缔组织增生性小圆细胞肿瘤的形态特征和免疫表型。显示EWS-FLI1和EWS-ERG基因融合的这两个例子都发生于年轻人,除了表达角蛋白、结蛋白和神经标记物外,瘤细胞CD99强阳性。然而,更多证据支持促结缔组织增生性小圆细胞肿瘤是一种具有独特临床病理学特征的病种。
治疗相关问题
我们在肉瘤分类和预后方面的持续进展有一个明显事实是,即使这些特征可能与预后相关,治疗也不能解释所有这些特定的临床病理学发现和差异。虽然我们有很多证据表明,尤文肉瘤家族中一些有争议的病例的生物学行为明显比其病例差,但大多数患者的治疗方案都是相似的,主要是基于临床分期。如间叶性软骨肉瘤没有特定的化疗方案,它们通常用尤文肉瘤或骨肉瘤的方案。BCOR基因重排肉瘤也是根据尤文肉瘤治疗指南进行治疗,与经典型尤文肉瘤一样,对化疗也很敏感。尽管有强有力的证据表明CIC基因重排肉瘤是一种比经典型尤文肉瘤预后更差的疾病,但大多数病例都是用尤文因肉瘤方案来进行治疗的。虽然尤文样肉瘤和类似的小圆蓝细胞肿瘤非常少见,积累足够的病例来进行有意义的治疗比较试验是非常困难的,但这并不意味着我们作为病理人的角色在试图将尤文肉瘤“家族”分类时是微不足道的,包括识别潜在的亚型和可能不同的病种。
尤文肉瘤家族肿瘤的类型有哪些?
与具有独特的病种相比,应如何定义新的亚型/变异体?它是具有独特的病理形态、临床特征、发病人群、对特定疗法的反应,还是分子和遗传学特征?我们是否需要上述部分或全部特征?Ewing医生对尤文肉瘤的最初定义不仅包括可复制的形态,而且还要求预后差,对放射治疗有显著的反应。当然,我们现在有条件能够将不同的分子和细胞遗传学事件纳入到这个定义中。然而,有争议的是,单凭病理结果,无论是否有明显的遗传学特征,如没有独特的临床表现或治疗反应,都不足以定义一个新的病种。
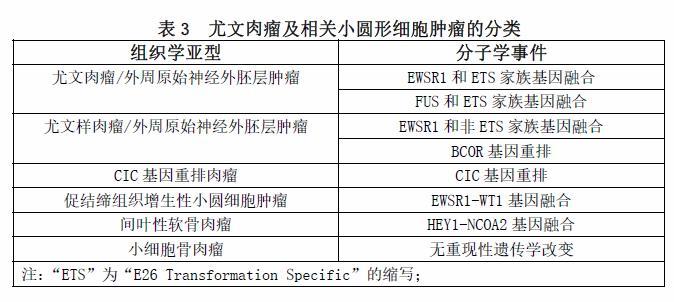
我们尝试总结的尤文肉瘤家族和相关肿瘤的各种亚型或实体的定义见表3。值得怀疑的是,目前任何一个执业医师都不完全相信尤文肉瘤、PNET和Askin瘤是同一肿瘤的不同谱系,包括“尤文肉瘤”的名称。根据大量的证据,我们可以很好地得出结论,促结缔组织增生性小圆细胞肿瘤和间叶性软骨肉瘤是不同的临床病理实体,而不是尤文肉瘤家族的成员,尽管早期个别病例证实了存在具有尤文肉瘤的t(11;22)(q24;q12)核型。过去十年中的大多数文献都支持这一观点,绝大多数病例都显示了相对特定的遗传和分子学特征。促结缔组织增生性小圆细胞肿瘤和间叶性软骨肉瘤也有特定的好发人群和发病部位,可重复的组织学特征(除了是一个小圆形细胞肿瘤),临床预后(通常更差)与常说的尤文肉瘤完全不同。小细胞骨肉瘤的情况仍然复杂。有一些小细胞骨肉瘤表现为BCOR或EWSR1基因重排,尽管很少见,但后者可能是有“骨样形成”的尤文肉瘤。这类病例是否应归类为尤文肉瘤,目前尚不清楚,也存在争议。如果把透明变性的胶原或骨化生简单地误认为“恶性”骨样基质,那么这些病例被排除就是过于苛刻[hypercritical]和毫无根据的[unwarranted]。仅仅通过是否有EWSR1基因重排来定义一个尤文肉瘤可能太有限了,并且没有考虑到这个基因的混杂性,也没有考虑到有FUS基因重排的尤文肉瘤(或尤文样肉瘤)的病例,这些肿瘤在临床和病理学上大多数都无法区分。尽管有少数证据支持ETS家族型融合的尤文肉瘤与非ETS家族型融合的尤文肉瘤之间存在差异,但仍存在明显的临床病理重叠,很少有病例提供明确的结论。越来越多的证据表明CIC基因重排肉瘤不同于尤文肉瘤,但对于BCOR基因重排的小圆细胞肿瘤,类似的结论可能不充分,尽管其有更好临床结果的趋势。CD99局灶或片状阳性的染色模式使得我们更多的考虑为非EWSR1基因重排的尤文样肉瘤以及其他小圆蓝细胞肿瘤,包括间叶性软骨肉瘤和小细胞骨肉瘤。
全文完
【参考文献】Ewing Sarcoma and the History of Similar and Possibly Related Small Round Cell Tumors: From Whence Have We Come and Where are We Going?














共0条评论