[导读] 原标题:应重视对胶质母细胞瘤少见亚型临床及病理学特征的认识
文章来源:《中华病理学杂志》第44卷第5期297-300页
作者:于士柱
导语:随着对胶质母细胞瘤(glioblastoma,GB)异质性认识的不断深入,发现了一些GB的新亚型。在2007版WHO分类表中仅列出了多形性GB、巨细胞型GB和胶质肉瘤,在其正文中重点描述了这三种GB亚型的临床及病理学特征,并简要介绍了小细胞型GB及含少突胶质细胞瘤成分的GB。而对其他9种GB少见亚型未作明确介绍。本文结合文献报道及笔者自己的病例,对这些GB少见亚型的临床、病理、免疫表型及分子遗传学特征做简要介绍,供同道们参考。
一、GB少见亚型的临床特征及生物学行为
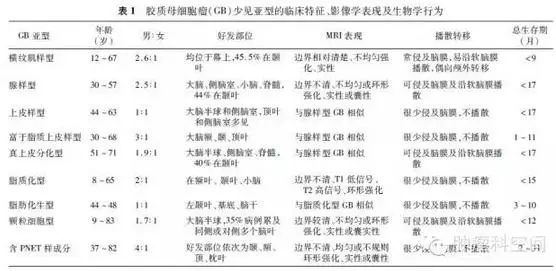
GB少见亚型包括:横纹肌样型、腺样型、上皮样型、富于脂质上皮样型、真上皮分化型、脂质化型、脂肪化生型、颗粒细胞型及含原始神经外胚层肿瘤(PNET)样成分的GB。它们均罕见或少见,并均为侵袭性强的高度恶性肿瘤。腺样型GB偶见于I型神经纤维瘤病患者,部分颗粒细胞型GB来自颗粒细胞型星形细胞瘤复发后恶性进展,含PNET样成分的GB可见于继发性多形性GB。GB少见亚型的其他临床特征、影像学表现及生物学行为详见表1。
二、GB少见亚型的组织病理学与分子病理学特征及鉴别诊断
1.横纹肌样型GB
组织学表现:肿瘤中可见胞质丰富红染、圆形、卵圆形的肥胖横纹肌样细胞,其胞核偏位、呈卵圆形或不规则形,在核旁可见高度红染的包涵体样区。横纹肌样细胞可呈片状排列,也可形成假乳头,其间可见典型多形性GB细胞成分,不同病例之间两种成分的比例可有明显差异。横纹肌样型GB核分裂象多见,可见肾小球样血管内皮增生及假栅栏样和凝固性坏死。免疫组织化学标记:横纹肌样型GB的两种细胞成分均表达胶质纤维酸性蛋白(GFAP)、S-100蛋白、Olig-2、波形蛋白、表皮生长因子受体(EGFR)、PDGFRA、PDGFRB、p53蛋白和INI-1;与原发性多形性GB不同的是可表达神经微丝(NF)、上皮细胞膜抗原(EMA)、CD99、结蛋白、突触素(Syn)、CKAEl/AE3,但不表达EGFRⅧ;与继发性多形性GB不同的是不表达IDH1和IDH2;与非典型性畸胎样/横纹肌样肿瘤(AT/RT)不同的是INI-1(+);GFAF(+)、Olig-2(+)可与横纹肌样型脑膜瘤鉴别;横纹肌肌动蛋白(一)、肌红蛋白(一)可与真性横纹肌肿瘤鉴别。Ki-67阳性指数10%~34%。荧光原位杂交(FISH)检测:wtEGFR获得和多倍体形成、MET获得、PTEN丢失,染色体lOc和2c丢失及7c获得和多倍体形成。DNA测序:无IDH1和IDH2基因突变。
2.腺样型GB:
组织学表现:在典型多形性GB的组织中出现边缘锐利、间质常呈黏液样变的腺样肿瘤细胞区。腺样区的肿瘤细胞中等大小、胞质少,胞核大小较一致、圆形或卵圆形、深染、核分裂象多见[(20—52)/10HPF,呈条索状和筛状(类似脊索瘤)、腺腔样和/或乳头状相互黏着紧密排列。还可见肉瘤细胞成分(主要是纤维肉瘤或多形性梭形细胞肉瘤),偶有骨、软骨和/或横纹肌母细胞化生。可见内皮肥胖的肾小球样血管增生。几乎都有坏死,但凝固性坏死远比假栅栏样坏死更常见。在肿瘤中典型的腺样型GB区域至少占一个低倍视野才能诊断腺样型GB。免疫组织化学标记:腺样型GB的两种细胞成分均表达GFAP、S-100和波形蛋白,所有病例的多形性GB细胞均表达EGFR、INI-1,部分病例的多形性GB细胞表达PDGFRA、p53、p27;与典型多形性GB不同的是可表达EMA、Syn、CKAEl/AE3、CK7、E-cadherin;腺样型GB的腺样细胞不表达CKCAM5.2、CK20、TTF-1及CDX-2,可与转移癌鉴别。Ki-67阳性指数26%~60%,腺样区(75%)明显高于多形性GB区(11%)。FISH检测:wtEGFR、PDGFRA获得,RB1、p16、PTEN丢失。
3.上皮样型GB :
组织学表现:肿瘤中可见边界较清晰、周围包绕丰富网状纤维的低分化大圆上皮样细胞巢及位于其间的典型多形性GB成分,两种成分的比例大致为1:1,偶见以多形性黄色瘤型星形细胞瘤为背景者。上皮样细胞无突起、细胞边界清晰,胞质丰富粉染或红染、也可透明(类似与肾透明细胞癌),胞核圆形、卵圆形、大小不等、可见突出的核仁、核分裂象易见[ (8—22)/10 HPF]。还可见肉瘤细胞成分(主要是纤维肉瘤或多形性梭形细胞肉瘤),偶有骨、软骨和/或横纹肌母细胞化生。可见内皮肥胖的肾小球样血管增生。几乎都有坏死,但凝固性坏死远比假栅栏样坏死更常见。免疫组织化学标记:所有上皮样型GB的两种细胞成分均表达GFAP、S-100蛋白、EGFR、INI-1,部分病例表达PDGFRA、p53、p27;与典型多形性GB不同的是可表达EMA、CKAEl/AE3、CK7、E-cadherin;上皮样型GB的上皮样细胞不表达CKCAM5.2、CK5/6、CK20、TTF-1、CDX-2及癌胚抗原(CEA),可与转移癌鉴别。Ki-67阳性指数16%~39%。FISH检测:wtEGFR、PDGFRA获得,p16、PTEN丢失。
4.富于脂质上皮样型GB:
组织学表现:在典型多形性GB组织中可见大量体积大小不等、圆形或多角形、无细胞突起、细胞膜清晰的肿瘤细胞,胞质富含脂质呈泡沫状、毛玻璃样或透明,胞核居中圆形,常含多个小核仁或单个大核仁,核分裂象易见。因这些细胞被邻近的多形性GB组织或神经毡分隔成边界锐利、排列紧密的实性细胞巢和/或片块,而呈现类似上皮性肿瘤的组织学特征。常见假栅栏样坏死及内皮肥胖的肾小球样血管增生。上皮样细胞巢脂肪染色阳性。免疫组织化学标记:富于脂质上皮样型GB的两种细胞成分均表达GFAP、S-100蛋白、波形蛋白、INI-1;与典型多形性GB不同的是可表达EMA,与继发性多形性GB不同的是不表达IDH1和IDH2;富于脂质上皮样型GB的上皮样细胞巢不表达CKCAM5.2、CK5/6、CK20、CDX-2及CEA,可与转移癌鉴别,不表达CD163和CD68可与组织细胞增生性病变鉴别。Ki-67阳性指数平均15%。DNA测序:无IDH1和IDH2基因突变。
5.真上皮分化型GB:
组织学表现:在典型多形性GB组织中出现具有鳞状上皮或腺上皮细胞特征,且至少表达一种上皮细胞特异性标志物的真上皮性肿瘤细胞巢。鳞状上皮细胞巢中可见角化珠,腺上皮细胞巢中可形成真腺体结构。腺上皮细胞的胞质比腺样型GB的腺样细胞更丰富,胞核大小有一定差异,圆形或卵圆形、较深染、核分裂象多见[(11—30)/10 HPF]。还可见肉瘤细胞成分(主要是纤维肉瘤或多形性梭形细胞肉瘤),偶有骨、软骨和/或横纹肌母细胞化生。可见内皮肥胖的肾小球样血管增生。几乎都有坏死,但凝固性坏死远比假栅栏样坏死更常见。在肿瘤中典型的真上皮分化型GB区域至少占一个低倍视野才能诊断真上皮分化型GB。免疫组织化学标记:真上皮分化型GB的两种细胞成分均表达GFAP、S-100蛋白,所有病例的多形性GB细胞均表达EGFR、INI-1,部分病例的多形性GB细胞表达PDGFRA、p53、p27;与典型多形性GB不同的是上皮成分表达EMA、CKAEl/AE3、CK7、E-cadherin;与腺样型GB和上皮样型GB不同的是真上皮分化型GB表达CKCAM5.2、CK20及CEA;真上皮分化型GB不表达TTF-1、CDX-2,可与转移癌鉴别。Ki-67阳性指数30%~40%,上皮区(58%)明显高于多形性GB区(7%)。FISH检测:wtEGFR获得,RB1、p16、PTEN丢失。
6.脂质化型GB:
组织学表现:在典型多形性GB或巨细胞型GB的组织中,出现形态与多形性黄色瘤型星形细胞瘤( PXA)相似,且界限清晰的PXA样细胞巢。多数PXA样细胞巢的肿瘤细胞中等大小、胞质丰富、富含脂质呈细泡沫状,胞核居中、圆形或卵圆形、大小较一致;部分PXA样细胞巢的肿瘤细胞体积大小不一致,其中可见泡沫状瘤巨细胞,胞核多形性明显,核分裂象多见。PXA样细胞巢的含量最多可占肿瘤的60%区域。脂质化型GB可见突出的肾小球样血管内皮增生及假栅栏样坏死。电镜观察证实PXA样细胞内有脂质蓄积。免疫组织化学标记:脂质化型GB的两种细胞成分均高表达GFAP、S-100蛋白和波形蛋白,但不表达IDH1和IDH2。Ki-67阳性指数平均15%。DNA测序:无IDH1和IDH2基因突变。甲基化特异性PCR检测:有MGMT启动子甲基化。脂质化型GB含典型多形性GB或巨细胞型GB成分,不表达IDH1和IDH2及网状纤维染色阴性,可与PXA鉴别;GFAP(+)、CD68(一)可与组织细胞增生性病变鉴别。
7.脂肪化生型GB:
组织学表现:肿瘤含三种截然不同的成分,即典型多形性GB、成熟分化的脂肪细胞岛及PNET的小原始细胞簇,部分病例可不含PNET成分。PNET区可见神经细胞分化及Syn(+)的Homer-Wright菊形团,电镜观察可见神经细胞性突起。脂肪细胞岛常和PNET成分紧密混杂分布,组织形态颇似脂肪神经细胞瘤。多形性GB成分夹杂于前两种成分之间,其肿瘤细胞特征性高表达GFAP,并可见假栅栏样坏死及肾小球样血管内皮增生。多形性GB和PNET区核分裂象多见。脂肪化生型GB出现真脂肪细胞岛可与富于脂质上皮样型GB及脂质化型GB鉴别;含PNET样成分的GB无真脂肪细胞岛,脂肪神经细胞瘤无多形性GB成分可与脂肪化生型GB鉴别。
8.颗粒细胞型GB:
组织学表现:在典型多形性GB组织中出现胞质富含粗大嗜伊红颗粒、PAS染色强阳性的颗粒细胞。颗粒细胞直径60~100 μm,无突起、圆形或卵圆形,细胞边界和胞膜清晰;嗜伊红颗粒可完全充满胞质,也可沿胞质周边区分布形成细胞中心苍白区;胞核偏位、呈卵圆形或豆瓣状,染色质稀疏或轻~中度增加,含单个突出的嗜伊红核仁,核分裂象少见。呈片状和/或巢状分布的颗粒细胞与比邻的多形性GB细胞形成马赛克样镶嵌排列,其间可见形态介于二者之间的过渡性细胞,多形性GB细胞和过渡性细胞核分裂象多见。颗粒细胞占肿瘤细胞总数的30%—95%(<30%诊断颗粒细胞型GB要慎重),其多数呈良性细胞学形态与颗粒细胞型GB高度恶性行为之间的矛盾表现是该肿瘤的突出特征。颗粒细胞型GB可见突出的假栅栏样坏死及肾小球样血管内皮增生。在血管周围或肿瘤细胞间常见大量淋巴细胞浸润,颗粒细胞间可见丰富的网状纤维网。电镜观察证实光镜看到的颗粒细胞内嗜伊红颗粒是自噬溶酶体。免疫组织化学标记:颗粒细胞型GB的两种细胞成分均高表达Olig-2,多数病例的两种细胞均表达GFAP和S-100蛋白;与原发性多形性GB不同的是多数颗粒细胞型GB的多形性GB细胞高表达p53蛋白,其颗粒细胞的胞质可呈EMA、KP-1、Ubiquitin斑点状阳性(dot-like);与继发性多形性GB不同的是颗粒细胞型GB不表达IDH1和IDH2;其颗粒细胞表达Olig-2和CD68可与颗粒细胞瘤鉴别;其颗粒细胞表达Olig-2和GFAP,不表达巨噬细胞特异性标志物CD163,可与组织细胞增生性病变鉴别。Ki-67阳性指数平均为16%,多形性GB区明显高于颗粒细胞区(5.6:1)。分子生物学检测:染色体7和19获得,1p、8p、9p21、10、13q、22q丢失,有MGMT启动子CpG岛甲基化,偶见EGFR基因扩增,无IDH1和IDH2基因突变及1p/19q丢失。现有证据说明颗粒细胞型GB的所有细胞均起源于星形胶质细胞;其可以是始发病变,也可来自颗粒细胞型星形细胞瘤的恶性进展,但经典的低级别星形细胞瘤不能进展为颗粒细胞型GB。
9.含PNET样成分的GB:
组织学表现:在典型多形性GB组织中及其小血管周围形成边界锐利的PNET样结节。PNET样结节由胞质很少、近似裸核、排列密集、与髓母细胞瘤或神经母细胞瘤相似的未分化小细胞组成,胞核卵圆形、短梭形或新月形、富含染色质呈深蓝染,结节内可见神经毡及Homer-Wright菊形团。核分裂象多见,且PNET样结节内明显多于多形性GB区。多形性GB区可见肾小球样血管增生及地图状假栅栏样坏死,部分病例的多形性GB区可见纤维肉瘤成分和/或骨化生。免疫组织化学标记:所有含PNET样成分的GB的多形性GB细胞均高表达GFAP和波形蛋白,但不表达Syn;PNET样成分均高表达Syn,且不同程度的表达NeuN、NF、CgA、神经元特异性烯醇化酶和CD99,但不表达GFAP和波形蛋白;两种成分均高表达CD56和Olig-2,以上特征是诊断含PNET样成分的GB的重要免疫组织化学指标。中枢的PNET(cPNET)不表达Olig-2是其与含PNET样成分的GB的主要鉴别点。多数含PNET样成分的GB的两种成分还不同程度的表达S-100蛋白和p53。Ki-67阳性指数20%~36%。PCR和焦磷酸测序:43%病例的两种成分均有N-MYC或c-MYC基因扩增;15%~25%病例的两种成分均有IDH1基因(R132H)突变,并表达该突变型IDH1蛋白。有IDH1基因(R132H)突变的含PNET样成分的GB与继发性多形性GB相似,也均有同部位低级别星形细胞瘤的病史,提示这部分含PNET样成分的GB的两种成分均来自低级别星形细胞瘤复发的恶性进展。
三、了解GB少见亚型的必要性和意义
因上述GB少见亚型的组织形态多样性及发病率低导致的经验积累不足,在临床外检工作中常被误诊为其他病变。如横纹肌样型GB可被误诊为AT/RT、横纹肌样型脑膜瘤及原发性或转移性真横纹肌性肿瘤,腺样型GB、上皮样型GB、富于脂质上皮样型GB及真上皮分化型GB常被误诊为转移癌或碰撞瘤,脂质化型GB易与PXA混淆,脂肪化生型GB易与脂肪神经细胞瘤及cPNET混淆,颗粒细胞型GB易与颗粒细胞瘤混淆,含PNET样成分的GB易与cPNET及神经母细胞瘤混淆,富于脂质上皮样型GB、脂质化型GB及颗粒细胞型GB还易与组织细胞增生性病变混淆。因此,有必要加强对GB少见亚型的认识,以避免因误诊延误患者的治疗,并有助于防止医疗纠纷的发生。














共0条评论