
【编者按】2018年,在结直肠癌的药物治疗领域,虽无非常能够改变临床实践的重大研究发布,但我们也看到了很多药物治疗方面的进步,化疗领域仍有新组合的研究,但更多的进步来自于免疫治疗和靶向治疗领域,因此,本文将根据今年大型会议的报道以及重要期刊上的文献作为基础,梳理今年在药物治疗在CRC领域的进步。
本文作者:王正航,王晰程,李健,沈琳
作者单位:北京大学临床肿瘤学院、北京肿瘤医院暨北京市肿瘤防治研究所消化肿瘤内科、恶性肿瘤发病机制及转化研究教育部重点实验室
免疫治疗
免疫检查点抑制剂在dMMR/MSI-H的CRC二线及后线治疗取得了显著疗效,但一线治疗及围术期治疗中的数据缺乏,而且如何进一步提高有效率、如何优化ipi+nivo的剂量均尚不可知。
Checkmate-142研究探索了一线使用nivolumab+ipilimumab的疗效[1]。本研究入组患者共45人,ORR为60%,DCR为84%;免疫治疗是否有效与PD-L1是否表达、BRAF是否突变和是否为林奇综合征均无关。中位PFS和OS均未达到,12月-PFS和12月-OS分别为为77%和83%。3~4级AE为16%。
本研究首次报道了联合免疫治疗在肠癌一线治疗中的疗效,其ORR较为可观,但对生存期的影响仍需要继续观察。
特别强调的是,双药联合(ipi 1mg/kg q3w)治疗的3~4级AE发生率为30%~40%,而本研究将ipi的剂量下调为1mg/kg q6w,发现3~4级AE的发生率仅为16%(与nivo单药发生率类似)。这一剂量调整在保证疗效的同时,大大减少了不良反应的发生,具有极大的临床意义。
NICHE研究探索非转移性肠癌术前予以ipi 1mg/kg d1+nivo 3mg/kg d1 d15的安全性和可行性[2]。结果发现这一策略是安全可行的。dMMR患者均有明显的肿瘤退缩。而pMMR患者的肿瘤退缩不明显。
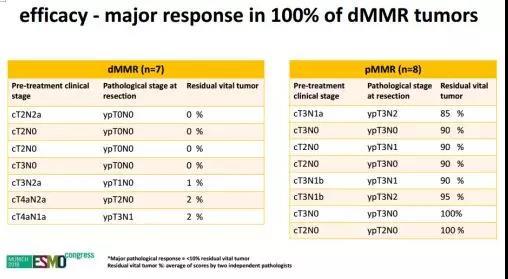
dMMR的结肠癌术前经联合免疫治疗后退缩极为明显(0~2%),这为手术困难(如T4b)的患者、重要脏器保留(如需要保肛)的患者带来了希望和新的选择。但是,围手术期免疫治疗是否具有改善生存的意义仍不得而知。I~II期的患者预后本身就很好,可能不需要围术期治疗;III期患者使用围手术期免疫治疗似乎是合理的,但目前仍缺乏长期的随访数据。
而dMMR/MSI-H仅占mCRC的5%;对于剩下95%的pMMR/MSS的患者,单药免疫治疗几乎无效。那么,免疫治疗联合其他治疗是否可能有效?
尽管前期的机制研究证明免疫治疗联合抗VEGF治疗或MEK抑制剂均能够改善免疫抑制状态、从而提高免疫治疗的疗效。但MODUL研究证明atezo联合BEV+化疗在一线治疗中不优于BEV+化疗[3],IMBlaze370研究证明atezo+MEK抑制剂在三线治疗中也无优势[4]。
上述两项临床研究均以失败告终,如何将MSS这类冷肿瘤变为热肿瘤仍需要更多的探索。
一线化疗联合靶向治疗:方案的优化
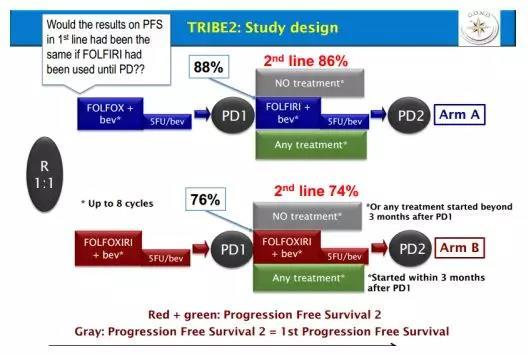
初始治疗应该如何选择?NCCN指南没有做特别的推荐,认为只要在整体病程的治疗中充分使用FP、OXA和IRI即可;而ESMO专家共识则推荐双药化疗而非单用FP治疗。Meta分析显示,一线使用FOLFOXIRI+BEV在ORR、PFS和OS方面均优于FOLFOX或FOLFIRI联合BEV[5]。但是这些研究均未严格设计一线进展后的二线治疗方案,因此,“初始三药是否优于序贯两药”一直没有答案。
TRIBE2研究对比了初始使用三药联合化疗与按计划依次使用三药的疗效[6]。主要研究终点为PFS2(随机至PD2的时间)。A组和B组的一线PFS和二线PFS分别为9.9月 vs. 12月(P<0.001)和5.5月 vs. 6.0月(P=0.120),PFS2分别为16.2月 vs. 18.9月(P<0.001),ORR分别为50% vs. 61%(P=0.005)。≥3级的腹泻、中性粒细胞减少和粒缺发热在B组中更高。
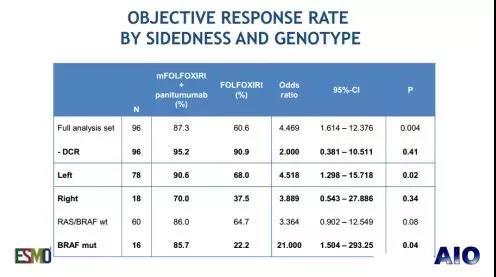
VOLFI研究探索了FOLFOXIRI+PANI (PANI组)对比 FOLFOXIRI (对照组)一线治疗 RAS 野生型结直肠癌的疗效与安全性[7]。在左半CRC中,PANI组和对照组的ORR分别为90.6% vs. 68%(P=0.02)。此外,对于右半结肠和BRAF突变型患者,PANI组的ORR也较高。对于不可切除的患者,PANI组和对照组的PFS分别为9.0月 vs. 10.7月(P=0.35);对于BRAF突变的患者,两组的PFS分别为6.4月 vs. 6.1月(无统计学差异)。3~5级AE在两组中分别为81.3% vs. 66.7%。
三药化疗联合靶向治疗是目前强度最大但也是不良反应最大的治疗方案。尽管上述研究均未特异筛选入组人群,但是在现阶段的临床实践中,这一强力治疗方案仅仅被用于某些特定的人群。
对于转化治疗和肿瘤负荷大的患者,降低肿瘤负荷是争取手术机会和改善生活质量的主要手段,因此应首选ORR高的方案。除了目前常用的“三药+BEV”和“两药+CET(RAS/BRAF野生型)”之外,VOLFI研究证明:对于RAS野生型患者,三药+PANI的有效率无论是在左半高于三药化疗,在右半CRC和BRAF突变患者中也高于三药化疗(样本量小,且不具统计学差异)[7]。
对于以控制疾病、延缓肿瘤进展为目的的姑息治疗而言,需要综合考量毒性和生存期的平衡。对于BRAF突变的患者,因为其生物学行为差,故建议予以强烈治疗:VOLFI研究证明予以FOLFOXIRI+PANI的PFS(6.5月)不优于FOLFOXIRI(6.1月)[7],目前ESMO共识建议予以FOLFOXIRI±BEV。今年在Annuals of Oncology上发表的TRIBE的回顾性分析发现,BRAF突变的右半CRC可能更能从三药+BEV治疗中获益。
抗EGFR治疗后的治疗决策
抗EGFR后维持治疗
一线使用BEV后的维持治疗中,BEV的地位已经明确。但是对于一线使用抗EGFR治疗的患者,应如何选择后续维持治疗方案,目前仍缺乏证据。
MACRO2 TTD研究(II期)证明CET不劣于CET+化疗(未分左右半)[8],VALENTINO研究证明PANI劣于PANI+化疗(无论是左半CRC还是右半CRC)[9],另一项研究证明CET等同于BEV(未分左右半)[10]。
对于一线使用抗EGFR治疗未PD的患者,目前有三种维持治疗策略:①继续使用抗EGFR+化疗维持;②换用抗VEGF+化疗维持;③单纯化疗维持;④暂停治疗。现有的证据较少,且均来自于西方人群的数据,因而目前尚缺乏公认的临床推荐。另外,考虑到REVERCE研究(见下)所带来的对治疗顺序的关注,以及BEV和CET相继进入我国医保,我们期待我国能进行更多的研究来解决抗EGFR治疗后的维持策略。
抗EGFR进展后靶向治疗
目前一线抗EGFR进展后,极有可能出现了抗EGFR的耐药克隆,因此二线并不推荐继续使用抗EGFR治疗。这些克隆是否会消失、从而带来rechallenge-CET的机会?目前仍不得而知。而ctDNA的检测为我们带来了新的视野。
一项研究通过检测ctDNA,发现停用抗EGFR后,RAS突变克隆和EGFR突变克隆(二者均为耐药克隆)呈指数衰减[11]。这些结果提示,当使用抗EGFR治疗进展后,间隔的使用时间可能为10~15月。
另一项研究探索了三线再次使用IRI+CET的疗效[12],结果显示:25人的ctDNA是可评估的,12人为RAS突变。PR患者中,均未检测到RAS突变。RAS野生型者PFS(4.0个月)明显长于RAS突变者(1.9个月)。
这些结果提示,对于使用抗EGFR治疗进展的患者——无论是已停用抗EGFR治疗还是治疗中进展,在rechallenge之前,均可考虑检测ctDNA来协助指导治疗决策。
少见靶点的治疗策略
抗HER2治疗
HER2扩增患者不到mCRC的5%。但是MyPathway和HERACLES均证明了双药抗HER2治疗具有良好的前景。但是,并非所有HER2扩增的患者均能从抗HER2治疗中获益。哪些患者更容易从这种治疗策略中获益?
HERACLES的研究者发现,无论是组织还是ctDNA,基于NGS检测出的HER2基因拷贝数较高的人群更容易从治疗中获益[13]。

(NopCN:血浆的标化基因拷贝数)
NTRK基因融合
随着诊断技术和药物研发的进步,也有很多少见变异成为了CRC的治疗靶点。
2018年,LOXO-101(Larotrectinib)被FDA批准用于NTRK基因融合的实体瘤。在全体实体瘤中的有效率为75%,其中共纳入4例结肠癌患者,其中2人SD,2人PR[14]。

NTRK基因融合的发生率极低:基于肿瘤组织的NGS数据显示,肠癌中NTRK基因融合的发生率在国外仅有0.05%~0.31%(3/978)[15、16];在中国人群中的发生率可能稍高,为1.4%[17]。尽管这些特殊类型的基因改变发生率极低,但这类人群从新的靶向药物中获益率极高。
此外,基因融合的患者更有可能是MSI-H[16]或TMB更高[18](但样本量较小,结论可信度下降),NTRK融合者若为MSI-H,应首选免疫治疗还是靶向治疗?这仍需要更多的临床数据。
注:
CRC:结直肠癌;nivo:nivolumab;ipi:ipilimumab;
atezo:atezolizumab;BEV:贝伐珠单抗;CET:西妥昔单抗;PANI:帕尼单抗;FP:氟尿嘧啶类药物;IRI:伊立替康;OXA:奥沙利铂;MSI-H:微卫星高度不稳定;dMMR:错配修复蛋白功能缺失;ORR:客观缓解率;DCR:疾病控制率;PFS:无进展生存期;OS:总生存期。

沈琳
主任医师、教授、博士生导师,北京大学肿瘤医院副院长、消化肿瘤内科主任、北京市肿瘤防治研究所副所长。
现任中国抗癌协会肿瘤药物临床研究专业委员会主任委员,中国抗癌协会肿瘤精准治疗专业委员会候任主任委员,中国抗癌协会胃癌专业委员会秘书长,中国老年医学学会肿瘤分会会长,中国医师协会外科医师分会MDT专业委员会主任委员,中国研究型医院学会消化道肿瘤专业委员会副主任委员,中国医疗保健国际交流促进会结直肠癌肝转移治疗专业委员会副主任委员,中国女医师协会临床肿瘤学专家委员会副主任委员,中国胃肠道肿瘤临床试验协作组(CGOG)执行主席等。同时担任人民卫生出版社《肿瘤综合治疗电子杂志》和《中国医学前沿杂志(电子版)》主编。

李健教授
主任医师、博士生导师,北京大学肿瘤医院消化肿瘤内科行政副主任、GCP中心副主任。

王晰程教授
北京大学肿瘤医院消化内科副主任医师,副教授。

王正航医生
北京大学肿瘤医院消化内科住院医师。
参考文献
[1] Lenz H-JJ, Van Cutsem E, Limon ML, et al. Durable clinical benefit with nivolumab (NIVO) plus low-dose ipilimumab (IPI) as first-line therapy in microsatellite instability-high/mismatch repair deficient (MSI-H/dMMR) metastatic colorectal cancer (mCRC)[J]. Annals of Oncology,2018,29:LBA18_PR.
[2] M. Chalabi, L. F. Fanchi, J. G. Van den Berg, et al. Neoadjuvant ipilimumab plus nivolumab in early stage colon cancer[J]. Annals of Oncology,2018,29:LBA37_PR.
[3] Grothey A, Tabernero J, Arnold D, et al. Fluoropyrimidine (FP) + bevacizumab (BEV) + atezolizumab vs FP/BEV in BRAFwt metastatic colorectal cancer (mCRC): Findings from Cohort 2 of MODUL – a multicentre, randomized trial of biomarker-driven maintenance treatment following first-line induction therapy[J]. Annals of Oncology,2018,29:LBA19.
[4] Bendell J, Ciardiello F, Tabernero J, et al. Efficacy and safety results from IMblaze370, a randomised Phase III study comparing atezolizumab+cobimetinib and atezolizumab monotherapy vs regorafenib in chemotherapy-refractory metastatic colorectal cancer[J]. Annals of Oncology,2018,29:LBA004.
[5] Shui L, Wu YS, Lin H, et al. Triplet Chemotherapy (FOLFOXIRI) Plus Bevacizumab Versus Doublet Chemotherapy (FOLFOX/FOLFIRI) Plus Bevacizumab in Conversion Therapy for Metastatic Colorectal Cancer: a Meta-Analysis[J]. Cellular physiology and biochemistry : international journal of experimental cellular physiology, biochemistry, and pharmacology,2018,48:1870-1881.
[6] Cremolini C, Antoniotti C, Lonardi S, et al. TRIBE2: A phase III, randomized strategy study by GONO in the 1st- and 2nd-line treatment of unresectable metastatic colorectal cancer (mCRC) patients (pts)[J]. Annals of Oncology, ,2018,29:LBA20.
[7] Geissler M, Klingler T, Knorrenschild JR, et al. 1st-line mFOLFOXIRI + panitumumab vs FOLFOXIRI treatment of RAS wt mCRC: A randomized phase II VOLFI trial of the AIO (KRK-0109)[J]. Annals of Oncology,2018,29:453PD.
[8] Aranda E, Garcia-Alfonso P, Benavides M, et al. First-line mFOLFOX plus cetuximab followed by mFOLFOX plus cetuximab or single-agent cetuximab as maintenance therapy in patients with metastatic colorectal cancer: Phase II randomised MACRO2 TTD study[J]. European journal of cancer,2018,101:263-272.
[9] Morano F, Corallo S, Bartolomeo M, Di., et al. Negative hyper-selection of RAS wild-type (wt) metastatic colorectal cancer (mCRC) patients randomized to first-line FOLFOX plus panitumumab (Pan) followed by maintenance therapy with either 5FU/LV plus pan or single-agent pan: Translational analyses of the VALENTINO study[J]. Annals of Oncology,2018,29:LBA22.
[10] Cremolini C, Antoniotti C, Lonardi S, et al. Activity and Safety of Cetuximab Plus Modified FOLFOXIRI Followed by Maintenance With Cetuximab or Bevacizumab for RAS and BRAF Wild-type Metastatic Colorectal Cancer: A Randomized Phase 2 Clinical Trial[J]. JAMA oncology,2018,4:529-536.
[11] Parseghian CM, Loree JM, Morris VK, et al. Anti-EGFR resistant clones decay exponentially after progression: Implications for anti-EGFR rechallenge[J]. Journal of Clinical Oncology,2018,36:3511.
[12] Cremolini C, Rossini D, Dell'Aquila E, et al. Rechallenge for Patients With RAS and BRAF Wild-Type Metastatic Colorectal Cancer With Acquired Resistance to First-line Cetuximab and Irinotecan: A Phase 2 Single-Arm Clinical Trial[J]. JAMA oncology,2018.
[13] Bardelli A, Siravegna G, Sartore-Bianchi A, et al. Plasma HER2 (ERBB2) copy number to predict response to HER2-targeted therapy in metastatic colorectal cancer[J]. Journal of Clinical Oncology,2018,36:3506.
[14] Drilon A, Laetsch TW, Kummar S, et al. Efficacy of Larotrectinib in TRK Fusion-Positive Cancers in Adults and Children[J]. The New England journal of medicine,2018,378:731-739.
[15] Zehir A, Benayed R, Shah RH, et al. Mutational landscape of metastatic cancer revealed from prospective clinical sequencing of 10,000 patients[J]. Nature medicine,2017,23:703-713.
[16] Rankin A, Klempner SJ, Erlich R, et al. Broad Detection of Alterations Predicted to Confer Lack of Benefit From EGFR Antibodies or Sensitivity to Targeted Therapy in Advanced Colorectal Cancer[J]. The oncologist,2016,21:1306-1314.
[17] Ling Q, Li B, Wu X, et al. The landscape of NTRK fusions in Chinese patients with solid tumor[J]. Annals of Oncology,2018,29:75P.
[18] Clifton K, Raymond VM, Dasari A, et al. Actionable fusions in colorectal cancer using a cell-free circulating tumor DNA (ctDNA) assay[J]. Journal of Clinical Oncology,2018,36:3507.























共0条评论