专家专栏|人乳头瘤病毒检测方法及其临床意义简述
来源:妇产科网
作者:杨怀涛1, 李娟2, 赵澄泉3(1. 美国Conemaugh医学中心2. 济南市妇幼保健院3. 美国匹兹堡医疗中心)
HPV不同于其他DNA病毒,不能由传统的细胞培养方法检查。经典的直接病毒学诊断技术如电镜和免疫组织化学,由于有限的敏感性和特异性,也不能常规用于HPV检测。抗HPV抗体的血清学检测由于分析准确性差而尚未用于常规的临床诊断。因此,所有商业化的HPV检测方法都是检测临床样本中HPV核酸。尽管近二十年许多HPV核酸检测方法被成功广泛地应用于实验室研究,但大多数却没有被美国食品药品监督管理局(FDA)批准用于临床检测。
目前美国经FDA批准用于检测高危型HPV的方法有7种。其中包括HPV杂交捕获2代(HC2)技术,Cervista高危型HPV检测及Cervista HPV16/18测定法,COBAS4800HPVDNAPCR检测法, 针对检测HPVE6和E7mRNA的Aptima HPV方法及Aptima HPV16、18/45基因分型方法,新近批准的BDOnclarity™HPVAssay检测技术。我们将简要讨论这些检测方法包括设计、临床指征、检测的高危型HPV类型、临床验证效果、以及潜在的问题和解决方法。本文HPV指高危型HPV。
一.HPV检测方法简介
HC2HPVDNA检测技术该技术是1997年由Digene公司开发,1999年FDA批准用于临床检测经细胞学诊断为“意义不明的不典型鳞状上皮细胞(ASC-US)”患者的反馈性检验 。2003年3月30日,FDA批准该方法用于30岁以上女性的常规宫颈Pap细胞学和HPV联合检验” 。HC2 HPV检测技术是诊断HPV最早应用的方法,其它的HPV检测方法一般都要求在临床验证过程中与HC2方法做对照比较,具有与HC2相似的敏感性和特异性。
HC2HPV检测方法是一种体外核酸杂交方法,该方法使用微孔板发光信号定量检测13种高危型HPVDNA检测(16、18、31、33、35、39、45、51、52、56、58、59、68)并将信号放大。含有靶DNA的宫颈细胞样本与特异性高危型HPVRNA探针鸡尾酒杂交,RNA探针和欲检测的高危型HPVDNA合成的杂交物被捕获到微孔板上。该板上已预先涂上针对RNA-DNA杂交的特异性抗体。在碱性磷酸酶标记的抗体与固定的杂交体结合后,该信号被化学发光底物检出。多个标记的抗体与每个捕获的杂交体结合导致大量的信号放大,发出的光信号在光度计上被测出相对光单位(RLU), 以其强度表示临床宫颈标本欲检测的高危型HPVDNA存在与否。
等于或大于截断值(CO)的RLU表示存在高危型HPVDNA序列。为了提高工作量,HC2检测快速捕获系统 (Qiagen公司)在过去的几年已被使用。
使用这个系统,一个检测人员在8h内可以处理患者标本达352例,包括其间自动操作3.5小时。
HC2HPVDNA检测要求标本用HC2DNA收集装置或HC宫颈采样器(宫颈刷),标本运输使用Digene(Qiagen)公司样本运输培养液或Cytyc PreservCyt瓶。标本可以存放在室温下长达2周,便于送至实验室。两周后,标本在2-8℃下可以继续保持1周。如果在标本收集后3周内还不能进行检测,则标本可以保存于负20℃ ,至最多3个月。保存在Cytyc PreservCyt保存液里的标本不仅可进行薄层液基涂片检查, 也可用于HC2HPV的检测,如进行后者检测则需要4ml的PreservCyt保存液。PreservCyt保存液保存的标本可以在2-30℃下保存到3个月。
一般来说,PreservCyt保存液保存的标本不可以冷冻保存。HC2方法目前存在的主要问题是分析不够准确,这是由于其鸡尾酒探针与其他HPV (11、53、54、55、66、MM4、MM7、MM8或MM9、39)发生交叉反应 。另外,该方法缺乏内对照来评价标本满意度或可能存在的干扰物等。研究发现HC2检测法存在5%的假阳性率。
Cervista高危型HPV检测技术Hologic公司研发的Cervista高危型HPVDNA检测技术于2009年3月12日经FDA批准。Cervista检测用于:
(1)宫颈细胞学为ASC-US患者的反馈性HPV检测;
(2) 30岁及以上妇女宫颈细胞学辅助检测是否存在高危型HPV。
FDA批准Cervista检测技术适用于ThinPrep PreservCyt保存液保存的标本。Cervista HPV检测技术包括两种检测方法:Cervista高危型HPV检测和Cervista HPV16和18的检测。它可定性检测宫颈标本中是否存在14种高危型HPV类型(16、18、31、33、35、39、45、51、52、56、58、59、66、68)。高危型HPV不能确定特异的HPV基因型。
Cervista高危型HPV检测技术使用的方法是Invader化学法。它是一种检测特定的核酸序列的信号放大方法。这种方法使用两种类型的等温反应:初次反应发生在靶DNA序列上,第二次反应产生荧光信号。在初次反应中,有两种类型的序列特异性寡核苷酸:寡核苷酸探针和Invader寡核苷酸。它们与DNA靶向序列结合。
当这些寡核苷酸在目的序列上至少有一个碱基对重叠时就形成了侵袭性结构。裂解酶在重叠位置裂解探针的5部分。过剩的探针在快速的循环启动和关闭靶序列中每个靶序列产生许多裂解的5端片段。这些片段与通用的发夹荧光共振能量转移器(FRET) 寡核苷酸结合,产生另一个侵袭性结构,并可被裂解酶作为底物而识别。在酶裂解荧光团和淬灭分子之间的FRET寡核苷酸后,荧光信号便在循环启动和关闭靶序列中时产生。
这种Cervista高危型HPV检测技术的试剂是以3种寡核苷酸混合物来提供的,设有包括阳性和阴性对照在内的内对照和外对照,每次检测中必须进行对照。当阳性和阴性对照结果正确,样本结果才有效。与人组蛋白2基因 (H2be,HIST2H2BE) 结合的寡核苷酸也存在并可作为内对照。通过在探针上使用2套不同的5一端序列和两个分别标记不同荧光(FAM和红色)的FRET寡核苷酸,高危型HPV检测技术能够在一个孔中同时检测HPV的DNA序列和HIST2H2BE。
阳性结果表明DNA样本中14种高危型HPV至少存在1种。阳性结果由FAM荧光信号代表,高于经验得出的截断值;阴性结果则低于经验得出的截断值。任何样本的最终阳性、阴性或不确定性结果是根据信噪比而产生 的,这个比值被称作为FOZ(Fold-Over-Zero)。
宫颈标本应收集在ThinPrep巴氏涂片系统中的 PreservCyt保存液内,使用宫颈刷/匙采集标本。对于Cervista高危型HPV检测,官颈标本置于PreservCyt保存液中,20~30℃中保存可长达18周。Cervista高危型HPV检测技术的局限性是可能与其他类型的HPV如HPV67和70发生交叉反应,从而产生假阳性结果。
CervistaHPV16/18检测技术Hologic公司研发的Cervista HPV 16和18检测技术是一种体外的定性检测宫颈标本中HPV16和18 DNA的基因分型诊断方法。 Cervista HPV16和18检测使用与高危型HPV检测同样的技术:Invader化学法。在初次反应中,用于该检测技术的寡核苷酸探针与高危型HPV16和高危型HPV18的DNA靶序列结合。与Cervista高危HPV检测方法同时被FDA批准应用(2009年3月12日) 。
美国阴道镜和宫颈病理学会(ASCCP)建议对细胞学阴性、高危型HPV阳性的30岁及以上妇女进行HPV16和18检测。如果HPV16和18阳性,可直接转诊阴道镜检查。HPV16和18检测技术的局限性是其交叉反应和假阴性。该方法可与高水平的高危型HPV31发生交叉反应。非常低的HPV感染或样本差误可导致假阴性结果。
Cobas4800HPV检测技术
Cobas4800HPV检测技术是罗氏公司于2009年11月在欧洲市场推出的。2011年4月,美国FDA批准Cobas4800HPV技术用于宫颈标本的检测。它是使用荧光信号检测通过即时PCR方法扩增的核酸。4800HPV检测技术是通过Cobas4800系统进行操作的,该系统由两个独立仪器组成:Cobasz480和Cobas X 480分析仪。4800HPV检测技术由FDA批准可以使用ThinPrep PreservCyt或者SurePath™ Preservative Fluid保存液采集的宫颈标本收集。
Cobas4800系统中的软件可整合样品制备、扩增、检测和数据管理。该软件对每个样品都有两个不同的检测选项:一种是对所有14种高危型HPV类型进行混合检测,另一种是额外加上HPV16和18型检测。Cobas HPV检测使用的是通过PCR扩增的目的DNA,随后进行核酸杂交一次性分析14种高危型HPV。
该检测方法最大优点可以同时HPV16/18基因分型,也可检测其余的12种高危型HPV (31、33、35、39、 45、51、52、56、58、59、66、68)。Cobas HPV检测有4种指征:
(1) 21岁及以上ASC—US患者的反馈性HPV检查;
(2)21岁及以上ASC-US患者,评价其是否存在高危型HPV16和18型感染;
(3) 30岁及以上妇女宫颈细胞学的辅助检查,检测是否存在高危型HPV类型;
(4) 30岁及以上妇女,评价其是否存在高危型HPV16和18型感染。
2014年4月25日FDA批准Cobas HPV可用子宫颈癌一线筛查,这是美国FDA第一个批准可用一线筛查的HPV检查。但4年后的今天,仍然很少有人用HPV检查作为一线筛查。
Cobas HPV检测技术有质量控制 (每次运行时有内对照:13-球蛋白,阳性和阴性对照以保证实验结果可靠)、高流量(Cobas 4800系统被设计一天可处理样本达280个)、自动化(仅有装卸微孔板是手工操作)和兼容LIS系统(Cobas4800系统可以连接到实验室信息系统)等优点。有关Cobas4800HPV检测分析及其临床效果的文献有限。该检测方法的临床敏感性和特异性与HC2相当,实验室内和实验室间重复性高,数据表明该测定法完全满足国际指南要求,可作为临床有效的HPV检查方法 。
Aptima HPV检测技术
AptimaHPV检测技术由Gen-Probe公司研发,是于2011年10月28日由FDA批准的HPV检测方法。FDA批准该检测方法可使用Gen-Probe Tigris,是一的全自动分子诊断检测系统。Gen-Probe2012年8月被Hologic收购。AptimaHPV检测技术是一种转录介导的、以扩增为基础的检测方法,可检测14种高危型HPV (16、 18、31、33、35、39、45、51、52、56、58、59、66、68)的E6/E7mRNA转录子,该方法不能区分14种高危型HPV的具体类型。
Aptima检测技术包括3个主要步骤:低聚物靶向捕获、转录介导扩增 (TMA)的靶向扩增、杂交保护实验(HPA)和通过对扩增产物进行检测分析。当标本细胞溶解后,目的mRNA被释放出来并由带有磁性微粒的低聚物捕获。捕获低聚物含有高危型HPVmRNA靶分子特定区域的互补序列,在杂交反应过程中,二者结合形成捕获低聚物:靶复合物。当靶向捕获完成后,高危型HPVmRNA通过TMA而扩增。TMA反应使用两种酶:MMV逆转录酶和T7RNA多聚酶。MMLV逆转录酶被用于产生靶向高危型HPV mRNA序列的一个DNA拷贝,其中包含T7RNA多聚酶的启动子序列。
随后,T7RNA多聚酶从DNA拷贝模板中产生多拷贝的RNA扩增子。扩增子的检测是通过HPA完成。HPA使用化学发光标记的单链核酸探针,该探针对扩增子互补。从标记的RNA:DNA杂交体发射出来的光被测量成光子信号,并报告为相对光单位。内对照被作为质量控制。该检测方法的软件自动确定分析测试结果。通过信号值/截止值(S/CO)确定,测试结果可能是阴性、阳性或无效。
宫颈标本可收集在含有PreservCyt溶液的ThinPrep Pap 瓶或Aptima宫颈标本采集运输管中。如果标本储存于PreservCyt溶液中,在运输前PreservCyt液基巴氏标本应储存于2—8 C,温度达到30℃ 则不能超过30 天。如果收集在PreservCyt保存液中的标本被转移到Aptima样品运输管中, 在2~30℃它可储存长达60 天。如果需要更长时间保存, PreservCyt液基巴氏标本可储存负20℃或以下,保存时间可长达24个月。如果标本采集并保存在Aptima采集运输管, 在2-30℃它可储存长达60 天。如果需要长期储存,标本储存负20或以下,保存时间也可长达24个月(Gen-Probe公司502182EN修订版A,2011)。
Aptima检测技术的优点是它不会发生交叉反应,其中包括其他高危型HPV或宫颈样本中正常菌群和机会性病原 菌。AptimaHPV检测主要用于21岁以上妇女ASC-US细胞学的反馈HPV检测,30岁及以上妇女应用细胞学和HPV共同筛查。Aptima检测方法具有高度的敏感性和特异性。在CIN3及其以上的病例中,该检测方法虽具有与HC2一样的敏感 性(95%),但比HC2法更加特异 [16]。
Aptima HPV16、18/45基因分型试验
2012年10月12日,FDA批准Aptima HPV16、18/45基因分型试验可用于临床宫颈癌的筛查。
(1)用于21岁及以上ASC-US妇女,Aptima HPV检查(14种高危HPV型)阳性者,评估HPV16、18/45存在否,结合细胞学检查为临床医生提供处理的信息;
(2)对于30岁及以上细胞学和HPV联合检查高危HPV阳性者,尤其是细胞学阴性者,如HPV16、18/45阳性可直接转诊阴道镜检查。Aptima HPV16、18/45检测原理与Aptima HPV检测技术基本相似,靶向捕获,转录介导扩增(TMA)靶向扩增和杂交保护实验对扩增产物进行检测分析。
BD Onclarity™ HPV Assay 检测技术
BD Onclarity™ HPV Assay HPV检测技术由美国BD公司(Becton, Dickinson and Company)研发,是于2018年2月12日由FDA批准的最新HPV检测方法。BD Onclarity™ HPV Assay是采用BD Viper LT系统的一个的定性的自动检测采集在BD SurePath的宫颈标本中的HPV分子诊断技术。是一基于由PCR扩增HPV的靶区DNA并结合核酸杂交用一次性检测来检查14种高危HPV。
该技术检测基因型16,18,45并同时检测其它的高危HPV包括31,33,35,39,51,52,56,58,59,66和68。该检测系统经FDA批准可使用一下临床指征:
(1)检测21岁及21以上有宫颈细胞学ASC-US结果的女性的高危HPV基因型16,18和45决定21岁和21岁以上有宫颈细胞学ASC-US结果的女性是否推荐做阴道镜检查;
(2)对于30岁及以上妇女,和细胞学共同检查;
(3)可以用于25岁及以上妇女宫颈癌的一线筛查来检测高危HPV包括16和18。HPV16和18结果阳性者可推荐到阴道镜检查。但时这种检测方法目前很少在临床应用。
二. 宫颈细胞学HPV的检出率和组织随访结果
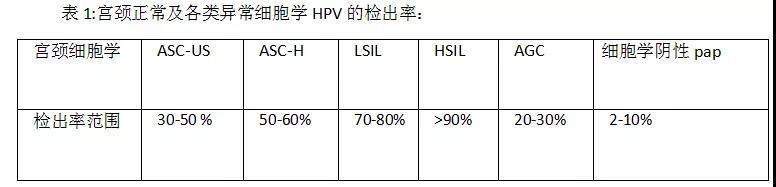
1、非典型鳞状上皮细胞-不明确意义(ASC-US)
文献报道的ASC-US的HPV检出率变化差异很大,主要的原因是ASC-US细胞学诊断的低重复率和被研究人群的异质性。ASC-US TBS报告率大约为4%-10%,美国CAP2017年调查数据显示实验室中位数ASC-US率为5.4% (ThinPrep)、5%(Sure Path)。ATHENA研究报道在21岁极其以上的女性,HPV的检出率是32.6%。其它研究的检出率为31.2 – 34.5%之间。虽然美国CAP调查50%实验室ASC-US HPV感染率为38.3%,30岁及以上妇女为30.7%,30岁以下妇女为51.3%。
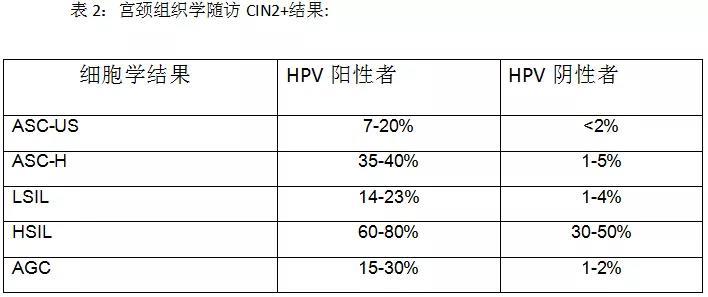
ALTS的研究显示HPV在ASC-US检出率是57.1%,但现美国大多大医院或临床中心ASC-US妇女HPV阳性率在30-40%之间。ASC-US/HPV阳性妇女组织学随访CIN2+(CIN2及以上)检出率变化较大,可为4.3-26.7%,大多数研究结果为5%-15%范围内。UPMC Magee妇女医院一项大样本研究3238例ASC-US/HPV阳性妇女半年组织随访CN2/3检出率为7.3%,其中,各种HPV检测方法组织随访CIN2/3结果稍有不同,HC2方法为8.7%,Cervista为4.6%,Aptima为7.3%。
2. 非典型鳞状上皮细胞-不排除高级别(ASC-H)
在细胞学诊断中,ASC-H诊断的细胞学并不常见。虽有一定判读标准,ASC-H的检测率在不同的实验室变化很大, 位于0.1 – 1.09%。美国CAP报道ASC-H中位数实验室报告率为0.3% 。综合122个实验室ASC-H报告率为0.57%。HPV在ASC-H的检出率变化范围很大,为33– 85%。但大多数实验室资料显示ASC-H妇女HPV感染为50-60%,平均为55%。
ASC-H/HPV阳性妇女组织随访CIN2/3的检出率为25-58%,平均为36%。UPMC Magee妇女医院885例ASC-H/HPV阴性妇女平均29个月随访CIN2/3检出率仅为1.6%。虽然ASCCP临床处理指南建议对ASC-H病人应常规做阴道镜检查,但大多临床试验资料显示HPV阴性ASC-H病人CIN2+病变检出率很低,所以在美国很多实验室对ASC-H病人常规反馈性检测HPV,临床医生可根据HPV检查全面平衡对病人的临床处理。
3. 低级别上皮内瘤变(LSIL)
美国CAP2017年调查报告显示 LSIL的流行率在ThinPrep是2.7%,SurePrep是2.8%。UPMC Magee妇女医院LSIL报告率为3.4%。北加利福尼亚Kaiser Permanente (KPNC)的调查表明HPV在LSIL在30及其以上的女性的检出率是83.5%。 ALTS 结果显示是82.9%。Magee妇女医院LSILHPV阳性率为74-80%。HPV在20岁以下的年轻女性可高达92%,以后随着年龄的下降而渐渐降低。总体而言大多数研究报告显示LSIL妇女HPV阳性率为70-80%之间,平均为75%。LSIL/HPV阳性妇女CIN2/3检出率为10%-20%,平均15%UPMC最近一项研究显示1011例LSIL妇女半年组织随访CIN2/3检出率为8.7%。HPV阳性组为10.2%,而HPV阴性组仅为2.8%。
4. 高级别上皮内瘤变(HSIL)
2017年美国CAP实验室调查显示HSIL的TBS细胞学报告率中位数为0.4%,匹兹堡医学中心Magee妇女医院HSIL报告率为0.5%,1226例HSIL妇女HPV阳性率为94%。总之,细胞学HSIL妇女HPV阳性率应大于90%。如果小于90%就需考虑是否高报HSIL或HPV检查方法有问题。细胞学HSIL妇女组织学随访CIN2+病变检出率大约为50-70%,其余为CIN1或阴性。主要原因包括妇科医生阴道镜取样不佳,病理医生过高报HSIL或者病变较小而消退。
5. 非典型腺细胞(AGC)
在细胞学判读中AGC的报告率介于0.1%-0.8%,美国CAP2017年调查AGC实验室报告中位数为0.2%。UPMC Magee妇女医院AGC报告率较高为0.6%。在细胞学为AGC的妇女HPV的检出率为20 – 30%。Kaiser Permanente (KPNC)的调查表明30岁及其以上的妇女HPV的检出率是21.3%。UPMC Magee妇女医院报道细胞学为AGC的妇女 HPV 检出率为24.3% - 27.7%。AGC妇女组织随访70-80%为阴性结果。UPMC Magee妇女医院3007例AGC病人随访结果显示CIN2及以上病例(包括宫内膜和转移癌)为15%,宫颈AIS或浸润性腺癌为2%,美国Kaiser1422例妇女CIN2+病例为16.7%,而实验AIS或浸润性腺癌为1.6%。
虽然对于AGC妇女ASCCP指南并不推荐做HPV检测,但AGC/HPV阳性妇女组织随访宫颈呈高级别鳞病变为17%-34%,AIS以上腺病变可达7%-28%,而AGC/HPV阴性妇女宫颈高级别病变小于2%,所以AGC妇女HPV感染状态对于临床处理具有参考价值。
6. 阴性宫颈细胞学(NILM)
阴性宫颈细胞学(NILM)HPV在Pap细胞学阴性的女性的流行率变异很大,1% - 35.4%的范围。HPV在30及其以上的女性的检出率是介于3.4% - 8.2%。匹兹堡医学中心Magee妇女医院报道阳性细胞学Pap30岁以上的女性病人其HPV检测率为在30岁以下的年轻女性为8.0%, 而30岁以上的女性1.9%高。ATHENA结果显示HPV在Pap细胞学阴性的女性的检出率是6.7%。
细胞学阴性文献报道细胞学阴性/HPV阴性妇女随访结果差异很大,除了检查方法和人群不同外,随访时间长短也有关系。
单次HPV阳性Pap细胞学为阴性的女性12个月的组织学随访CIN3+的风险是0.8% - 4.1 %。KPNC的调查结果是2%hrHPV阳性Pap细胞学为阴性的女性在10年内2%发展成CIN2+. 如果是HPV16或者HPV18阳性的话,38%发展成CIN3+. 匹兹堡医学中心Magee妇女医院的一项大型研究显示,HPV阳性Pap细胞学为阴性的女性在2年间的CIN2+为2.4%。 ATHENA的研究资料表明HPV16或/和HPV18阳性的Pap细胞学为阴性的女性患CIN3+的绝对风险是9.8%。
三.小结
经FDA批准的用于宫颈细胞学标本的HPV检测方法目前有7种。它们在临床的应用日益广泛。HPV检测作为非典型鳞状上皮细胞的反馈检测,病人的分流管理30岁及以上妇女共同筛查,甚至宫颈细胞学标本的一线筛查发挥着越来越重要的角色,虽然在美国HPV一线筛查很少应用于临床各种HPV检测方法都有其特点,特异性和敏感性略有不同,但无论是DNA或mRNA检测方法在宫颈癌筛查中其主要作用是检测HPV存在与否,并非哪一种方法就一定是检测HPV持续感染状态或致癌基因等。充分了解这些HPV检测方法及其相应的临床应用意义,对病人教育,医疗工作者的临床应用都有着重要的意义。
参考文献
1. Bernard HU, Burk RD, Chen Z, et al. Classification of papillomaviruses(PVs)based on 189 PV types and proposal of taxonomic amendments.Virology,2010,40l(1):70-79.
2. Li N, Franceschi S, Howell—Jones R, et al. Human papillomavirns type distribution in 30,848 invasive cervical cancers worldwide:variation by geographical region,histological type and year of publication.Int J Cancer,201 1,128(4):927— 935.
3. Hobbs CG,Sterne JA,Bailey M.et al.Human papillomavirns and head and neck cancer:a systematic review and meta-analysis. Clin Otolaryngol,2006,31(4):259-266.
4. De Vuyst H,cliⅡbrd GM,Nascimento MC,et al.Prevalence and type distribution of human papillomavirus in carcinoma and intraepithelial neoplasia of the vulva,vagina and anus:a meta. analysis.Int J Cancer.2009,124(7):l626.1636.
5. Munoz N,Bosch FX,de Sanjos6 S,et al.Epidemiologic classification of human papillomavirus types associated with cervical cancer.N Engl J Med,2003,348(6):518-527.
6. Snijders PJ,Heideman DA,Meijer CJ.Methods for HPV detection in exfoliated cell and tissue specimens.APMIS,2010, 118(6-7):520-528.
7. Molijn A,Kleter B,Quint W,et al.Molecular diagnosis of human papillomavirus(HPV)infections.J Clin Vir01,2005,32 (Suppl 1):$43一S51.
8. Coutl6e F,Mayrand MH,RogerM,et al.Detection and typing of human papillomavirus nucleic acids in biological fluids. Public Heahh Genomics,2009,12(5-6):308.318.
9. Brink AA,Snijders PJ,Meijer CJ.HPV detection methods.Dis Markers,2007,23(4):273-281. 12. Heideman DA,Hesselink AT,Berkhof J,et al.Clinical validation of the cobas 4800 HPV test for cervieal screening purposes.J Clin Microbiol,2011,49:3983-3985
10. Castle PE, Solomon D, Wheeler CM, et al. Human papillomavirus genotype specificity of hybrid capture 2. J Clin Microbiol,2008,46:2595-2604,
11. Stoler MH,wright TC Jr,Sharma A,et al.High-risk human papillomavirus testing in women with ASC-US cytology:results from the ATHENA HPV study.Am J Clin Pathol,2011,135(3): 468-475.
12. Einstein MH, Martens MG, Garcia FA, et al. Clinical validation of the Cervista HPV HR and 16/18 genotyping tests for use in women withASC-US cytology. Gynecol Oncol 2010; 118: 116e22
13. Patadji S, Li Z, Pradhan D, Zhao C. Significance of high-risk HPV detection in women with atypical glandular cells on Pap testing: Analysis of 1857 cases from an academic institution. Cancer Cytopathol. 2017 Mar;125(3):205-211. doi: 10.1002/cncy.21791. Epub 2016 Oct 24.
14. Atkins KA, Jeronimo J, Stoler MHALTS Group. Description of patients with squamous cell carcinoma in the atypical squamous cells of undetermined significance/low-grade squamous intraepithelial lesion triage study. Cancer 2006 ; 108: 212e21.
15. Demarco M, Lorey TS, Fetterman B, Cheung LC, Guido RS, Wentzensen N, Kinney WK, Poitras NE, Befano B, Castle PE, Schiffman M. Risks of CIN 2+, CIN 3+, and Cancer by Cytology and Human Papillomavirus Status: The Foundation of Risk-Based Cervical Screening Guidelines. J Low Genit Tract Dis. 2017 Oct;21(4):261-267.
16. Pradhan D, Li Z, Ocque R, Patadji S, Zhao C. Clinical significance of atypical glandular cells in Pap tests: An analysis of more than 3000 cases at a large academic women's center. Cancer Cytopathol. 2016;124(8):589-95
17. Patadji S, Li Z, Pradhan D, Zhao C.
18. Barron S, Austin RM, Li Z, Zhao C. Follow-up outcomes in a large cohort of patients with HPV-negative LSIL cervical screening test results. Am J Clin Pathol. 2015 Apr;143(4):485-91.
19. Zhao C, Moriarty AT, Ghofrani M, Husain M, Tambouret RH, Laucirica R, Laser A, Fischer A, Ocal IT, Souers RJ, Russell DK, Fan F, Crothers BA. Human papillomavirus testing and reporting rates in 2012: results of a College of American Pathologists national survey. Arch Pathol Lab Med. 2015 Jun;139(6):757-61.
20. Zhao C, Li Z. Automated cell block system for atypical glandular cells of cervical cytology: is it feasible? Cancer Cytopathol. 2014;122(1):5-7
21. Cohen D, Austin RM, Gilbert C, Freij R, Zhao C. Follow-up outcomes in a large cohort of patients with human papillomavirus-negative ASC-H cervical screening test results. Am J Clin Pathol. 2012 ;138(4):517-23.
22. Gao FF, Austin RM, Zhao C. Histopathologic follow-up and human papillomavirus DNA test results in 290 patients with high-grade squamous intraepithelial lesion Papanicolaou test results. Cancer Cytopathol. 2011;119(6):377-86.
23. Heider A, Austin RM, Zhao C. HPV test results stratify risk for histopathologic follow-up findings of high-grade cervical intra-epithelial neoplasia in women with low-grade squamous intra-epithelial lesion Pap results. Acta Cytol. 2011;55(1):48-53.
24. Zhao C, Florea A, Austin RM. Clinical utility of adjunctive high-risk human papillomavirus DNA testing in women with Papanicolaou test findings of atypical glandular cells. Arch Pathol Lab Med. 2010 Jan;134(1):103-8.
25. Armah H, Austin RM, Dabbs D, Zhao C. Follow-up findings for women with human papillomavirus-positive and atypical squamous cells of undetermined significance screening test results in a large women's hospital practice. Arch Pathol Lab Med. 2009 Sep;133(9):1426-30.
26. Bandyopadhyay S, Austin RM, Dabbs D, Zhao C. Adjunctive human papillomavirus DNA testing is a useful option in some clinical settings for disease risk assessment and triage of females with ASC-H Papanicolaou test results. Arch Pathol Lab Med. 2008 Dec;132(12):1874-81.
27. Zhao C, Elishaev E, Yuan KH, Yu J, Austin RM. Very low human Papillomavirus DNA prevalence in mature women with negative computer-imaged liquid-based Pap tests. Cancer. 2007 Oct 25;111(5):292-7.
28. Zhang H, Varma KR, Han M, Matsko J, Zhao C. Immediate histopathologic follow-up of cervista and Aptima high-risk HPV assays in women with LSIL cytology. Cancer Cytopathol. 2018 Aug;126(8):525-532
本站欢迎原创文章投稿,来稿一经采用稿酬从优,投稿邮箱tougao@ipathology.com.cn
相关阅读
 数据加载中
数据加载中
我要评论

热点导读
-

淋巴瘤诊断中CD30检测那些事(五)
强子 华夏病理2022-06-02 -

【以例学病】肺结节状淋巴组织增生
华夏病理 华夏病理2022-05-31 -

这不是演习-一例穿刺活检的艰难诊断路
强子 华夏病理2022-05-26 -

黏液性血性胸水一例技术处理及诊断经验分享
华夏病理 华夏病理2022-05-25 -

中老年女性,怎么突发喘气困难?低度恶性纤维/肌纤维母细胞性肉瘤一例
华夏病理 华夏病理2022-05-07







共0条评论