整理作者:强子
病例展示
患者女性,71岁,2009年春季因前额部头皮发现疼痛性结节而就诊。磁共振及CT示额骨及中线周围帽状腱膜下软组织异常,脑实质未见异常。2010年1月,自额骨处开颅并行硬脑膜活检。病理检查为恶性梭形细胞肿瘤,部分细胞呈上皮样;免疫组化检查肿瘤局灶表达SMA,广谱细胞角蛋白阴性,且EMA、CD34、desmin、GFAP、S100均为阴性。局灶可见坏死,核分裂高达5个/10HPF。
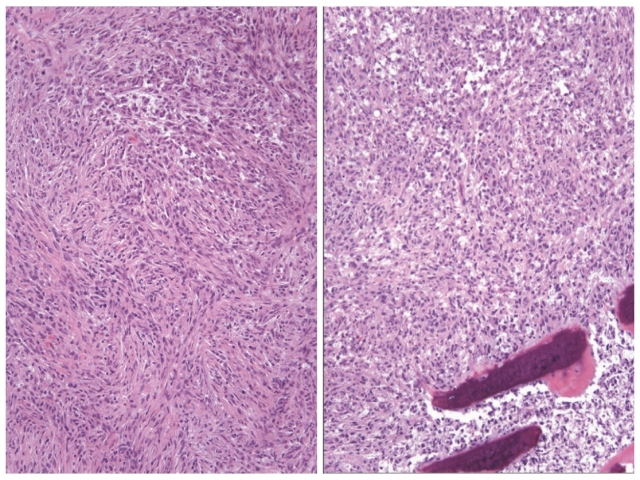
图1. 硬脑膜处肿物组织学表现,恶性梭形细胞肿瘤,部分细胞呈上皮样。

图2. 硬脑膜处肿物组织学表现,可见大量核分裂及坏死(未示);免疫组化SMA阳性。
综合上述资料,病理诊断为未分类的高级别肉瘤。2010年2月中旬PET检查仅见额部FDG摄取增加。在此期间多次血常规检查,均在正常范围。2010年3月份患者开始替莫唑胺治疗并放疗,但治疗1月内因血小板显著减少而停止替莫唑胺;放疗持续了3个月。
5个月后随访PET,发现双肾局灶FDG摄取显著增加,额部及脑实质无显著异常。一侧肾脏活检,可见上皮性肿瘤在肾小管间呈显著浸润性生长。肿瘤细胞不表达细胞角蛋白、EMA、CD34、RCC、SMA、desmin,但出现了PAX8的阳性表达。
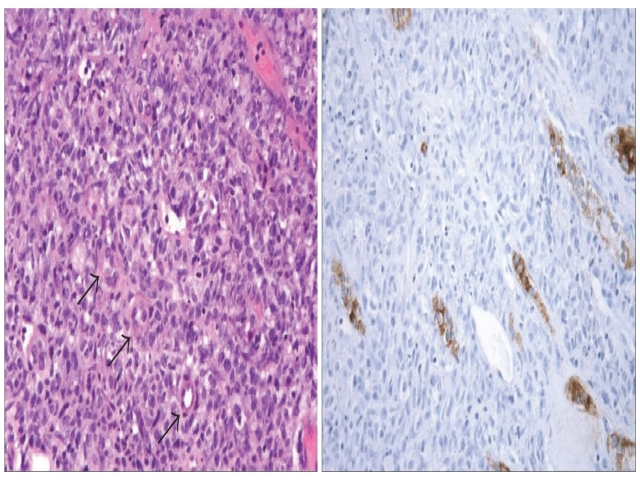
图3. 肾脏活检,可见上皮性肿瘤在肾小管间呈显著浸润性生长;肿瘤细胞不表达EMA。

图4. 肾脏活检标本免疫组化检测。PAX8在标记肾小管的同时,瘤细胞也出现了阳性表达。
根据上述资料,加之此前有报道表明多克隆PAX8抗体因为会与PAX5发生交叉反应,因此可作为B细胞淋巴瘤的敏感、相对特异性指标,因此再次补充免疫组化指标,肿瘤细胞表达LCA、CD20、PAX5、BCL6、BCL2(局灶),不表达CD3、CD5。
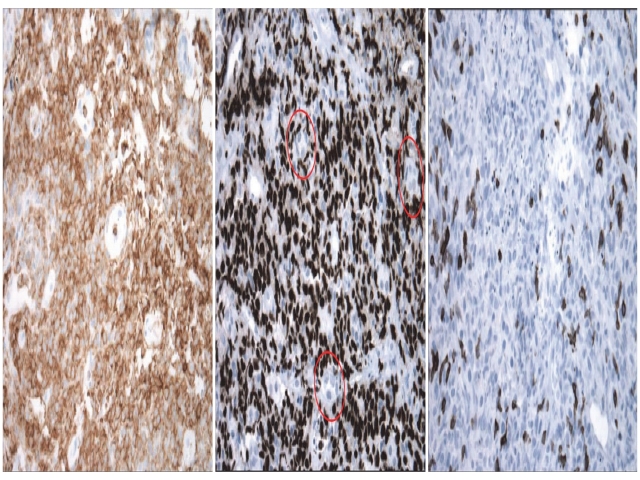
图5. 肾脏活检标本补充免疫组化标记,肿瘤细胞表达LCA(左)、PAX5(中)及CD5。
结合各项资料,最终诊断为滤泡中心起源的弥漫性大B细胞淋巴瘤。复阅2010年病理切片,肿瘤细胞为梭形,仅凭组织学还是很难考虑到弥漫性大B细胞淋巴瘤,但二者的肿瘤细胞形态学有一定相似性。因此对2010年病例加做免疫组化,结果证实肿瘤细胞表达PAX8、LCA、CD20,不表达CD3,,证实该处病变也是梭形细胞型的弥漫性大B细胞淋巴瘤。至此,患者转诊至血液肿瘤专家处进一步诊疗。
讨论
回溯该病例的诊断过程,仅因肾脏穿刺活检中,PAX8在肾小管表达的同时、出现了肿瘤细胞的表达,因此引发了后面加做淋巴造血系统指标、并进而复阅此前病理切片,最终修订诊断并指导患者转诊至血液肿瘤专家处的一系列故事。
弥漫性大B细胞淋巴瘤鉴别诊断一般不会考虑到肉瘤,其形态学一般是较大的多边形细胞增生,这些细胞的胞核不规则,轮廓扭曲;染色质空泡状,散在淡染至嗜酸性的胞质。罕见情况下,弥漫性大B细胞淋巴瘤的瘤细胞可呈梭形改变,并呈束状或席纹状排列,与本例一样会类似梭形细胞肿瘤,如梭形细胞肉瘤、癌肉瘤。这类患者男女比例接近,主要发生于中、老年。梭形细胞亚型弥漫性大B细胞淋巴瘤可发生于多个部位,如皮肤、肝脏、软组织、涎腺、纵膈、女性生殖道等,仅少数患者会同时出现淋巴结受累。此前报道的病例中,大部分均为梭形细胞表达B细胞标记CD20,少数病例会同时表达BCL6。此外,高达56%的病例会至少局灶表达SMA。由于梭形细胞亚型弥漫性大B细胞淋巴瘤非常罕见,因此对于非淋巴造血系统专科的病理医师来说相对困难。
PAX8在甲状腺、肾脏、苗勒氏管来源组织及相应肿瘤中的表达早已广为人知。需要注意的是,多克隆PAX8抗体可表达于非生殖道、非苗勒管来源器官、非甲状腺肿瘤,如胰腺神经内分泌肿瘤、胸腺肿瘤;因为会与PAX5发生交叉反应,因此可表达于淋巴造血系统肿瘤,并可作为B细胞淋巴瘤的敏感、相对特异性指标;但单克隆性PAX8抗体无此特点。本文中所用抗体即多克隆性抗体。因此该文也提醒我们:如来源未明的肿瘤免疫组化中出现PAX8的表达,但上皮或其他肉瘤特异性标记均阴性的情况下,鉴别诊断也应考虑到B细胞淋巴瘤。
点击下载英文文献
参考文献
Hirsch MS.PAX8 Distinguishes Diffuse Large B-Cell Lymphoma Mimicking Sarcoma[J].Case reports in pathology,2017:6714549.
DOI:10.1155/2017/6714549


















共0条评论