来源:中国抗癌协会肿瘤病理专业委员会
本标准起草单位:中国人民解放军第三军医大学第一附属医院、天津医科大学总医院神经病学研究所、福建医科大学附属第一医院
本标准起草人:卞修武、于士柱、王行富
1、范 围
本规范规定医疗机构病理科或其他具备相应资质的实验室进行胶质瘤病理诊断工作的基本原则、通用操作规范,以及相关临床与管理部门的职责与要求。
本规范适用于医疗机构病理科、承担肿瘤病理诊断的病理教研室、独立实验室等机构(以下简称病理科)。
2、规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅所注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
《中华人民共和国执业医师法》
《临床技术操作规范-病理学分册》
《病理科建设与管理指南(试行)》(卫办医政发(2009)31号)
中国中枢神经系统胶质瘤诊断与治疗指南(2015版)
《WHO中枢神经系统肿瘤分类》(2016版)
NCCN 指南-中枢神经系统肿瘤(2016版)
3、术语和定义
3.1、 胶质瘤 glioma
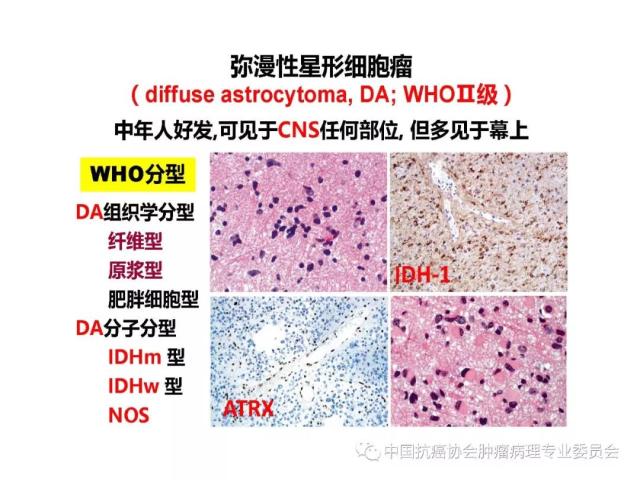
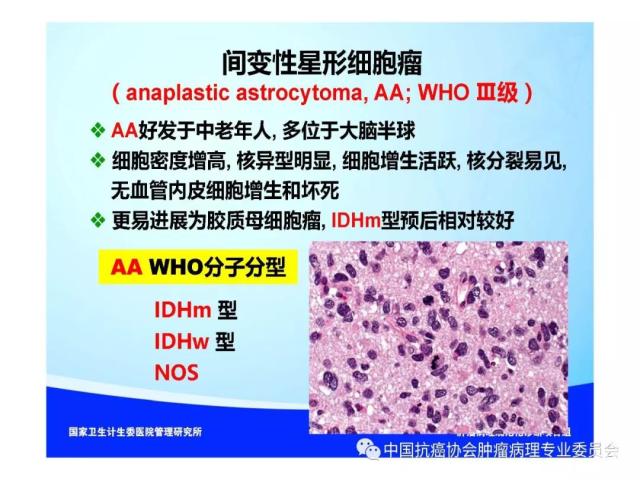
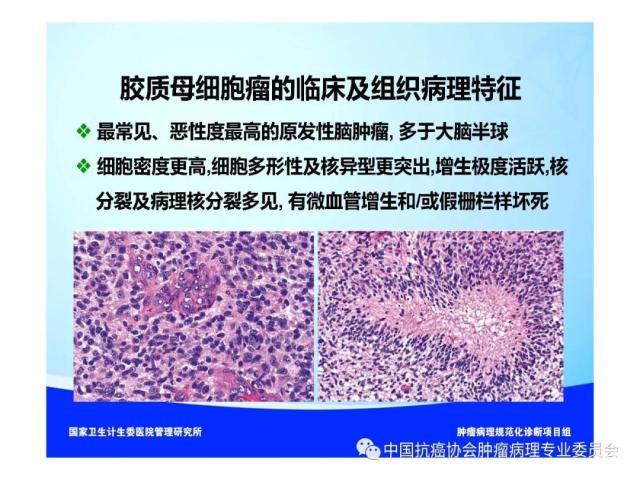
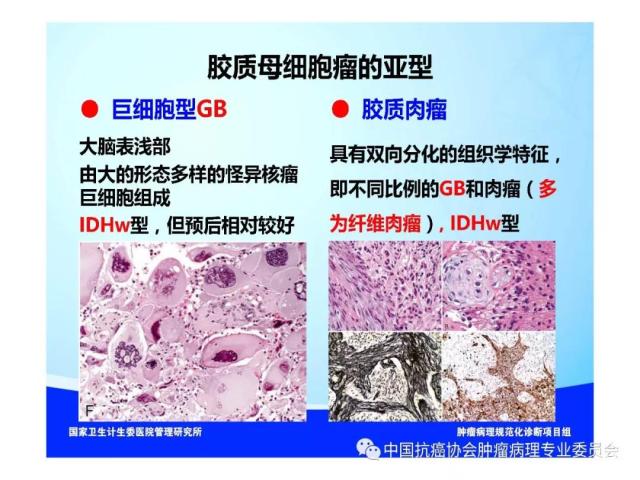
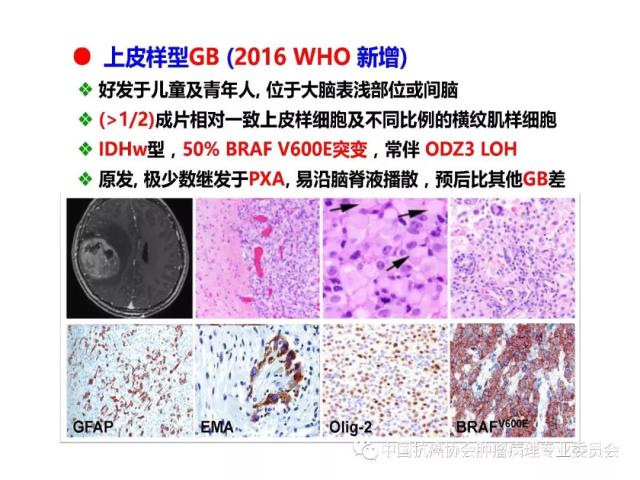
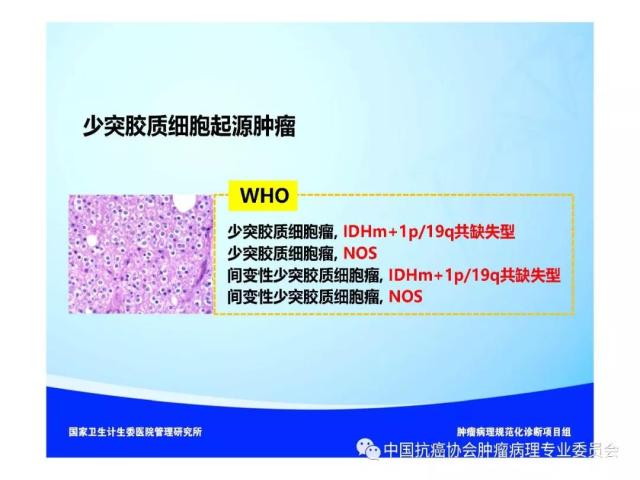
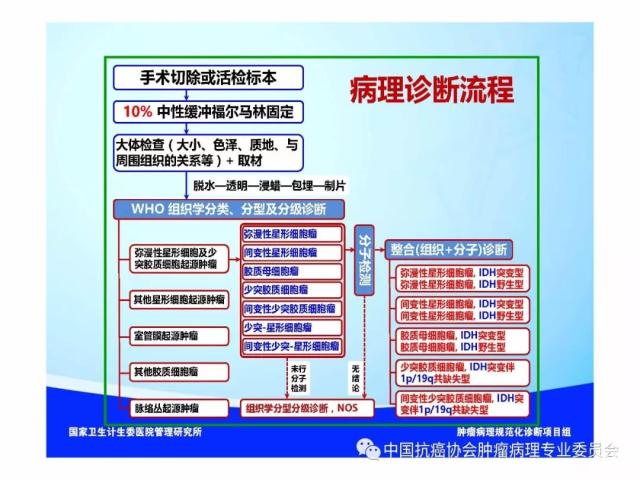
是指具有星形胶质细胞、少突胶质细胞、室管膜细胞或脉络丛上皮细胞形态特征的神经上皮组织起源的肿瘤,胶质瘤的组织学分类、分型及分子分型详见附录 A。
3.2、 非特指 not otherwise specified;NOS
NOS是指因缺乏代表性分型基因是否为野生型或突变型的确切分子检测信息,而不能被归入特定分子分型的肿瘤。2016年WHO分类明确规定在不能做诊断性分子检测的单位,仍允许只采用组织学分类和分型,但必须用“NOS”标明该病理诊断未确定其分子分型(附录 A)。
3.3、 胶质瘤的WHO分级
《WHO中枢神经系统肿瘤分类》按照不同胶质瘤的生物学行为将其分为Ⅰ~Ⅳ级,Ⅰ级预后良好、Ⅱ级预后介于I级和III级之间、Ⅲ级为恶性、Ⅳ级为高度恶性,胶质瘤的WHO分级标准详见附录 B。
3.4、 间变性anaplastic
在《WHO中枢神经系统肿瘤分类》中,除大细胞/间变性髓母细胞瘤为高度恶性(WHO Ⅳ级)外,包括胶质瘤在内的其他所有前面标有“间变性”的中枢神经系统肿瘤均为恶性(WHO Ⅲ级)。
4、标本类型及采集与送检
4.1、 标本类型
包括立体定向穿刺活检组织标本、开放手术活检组织标本和各种手术切除的组织标本。
4.2 标本采集与送检
临床必须将活检或手术所采集的组织标本完整无缺地送给病理科检测。
5、标本接收及固定
5.1、标本接收与登记
标本的接收、编号及登记参见总则。
5.2 标本固定
5.2.1 立体定向活检组织标本、开放手术活检组织标本及术中冰冻切片后剩余组织,应立即用10%中性缓冲福尔马林固定。
5.2.2手术切除标本应立即用足够量的10%中性缓冲福尔马林固定,一般固定液为标本的10倍体积。
5.2.3 以上各种标本的固定时间范围在12h~72h。
6、取材前标本及相关信息核对
6.1、 需核对的内容
取材前必须首先核对姓名、床位号、住院号、标本类型及部位等,以及临床诊断和术中所见等信息是否完整,经核对标本无误且相关信息完整方可取材。
6.2、 疑问确认及相关信息完善
对上述需核对内容有疑问和(或)相关信息不完整者,应及时与神经外科医生沟通确认,经双方确认标本无误并补全相关信息后方可取材。
7、大体描述及取材规范
7.1 立体定向活检标本
7.1.1 大体检查及记录:标明穿刺活检组织的数目,每块组织的大小、颜色、质地等,可能的情况下尽量分清灰白质结构。
7.1.2 取材:确认组织固定合格后标本全部取材(立体定向活检标本不宜行术中病理诊断)。
7.2 开放手术活检标本
7.2.1 大体检查及记录:同7.1.1。
7.2.2 取材:确认组织固定合格后标本全部取材;如送检标本需做术中冰冻检查,除已与神经外科医生确认可再取部分组织做常规病理外,只能取部分组织做冰冻制片,并确保剩余组织能满足常规石蜡制片。
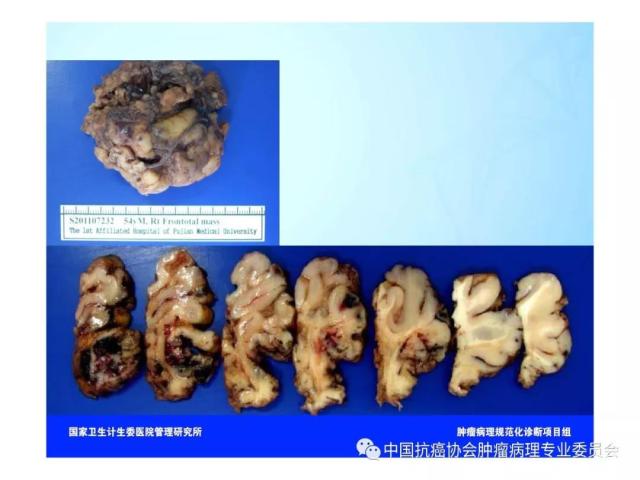
7.3 手术全切或次全切标本
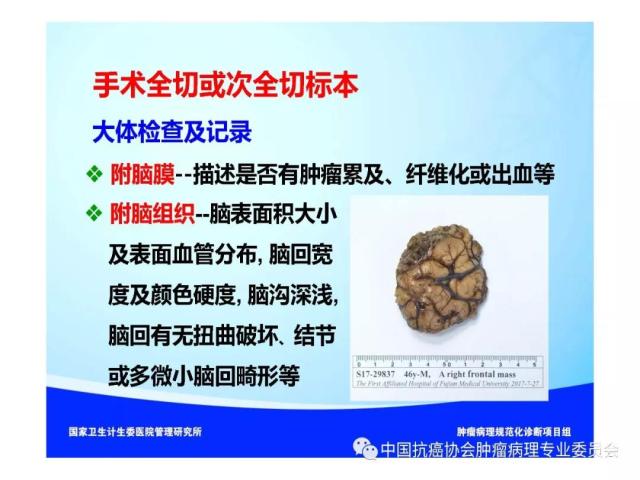
7.3.1 大体检查及记录:
⑴ 观察和记录标本是否附带脑膜和(或)脑组织。
⑵ 标本附带脑膜组织时应描述脑膜组织是否有肿瘤累及、纤维化或出血等。
⑶标本附带脑组织时应测量脑表面积的大小,描述脑回的宽度、颜色及硬度、脑沟的深浅、表面血管分布,并观察脑回形态是否正常、有无扭曲破坏、硬化结节或多微小脑回畸形等。
⑷ 不附带脑组织的标本应测量和记录标本长×宽×高的最大径,观察和记录其质地等,并沿最大直径平面平行切开标本,而后每隔0.5cm平行切开最大平面两侧的标本,观察和记录病变切面的颜色及有无出血、坏死和囊性变等。
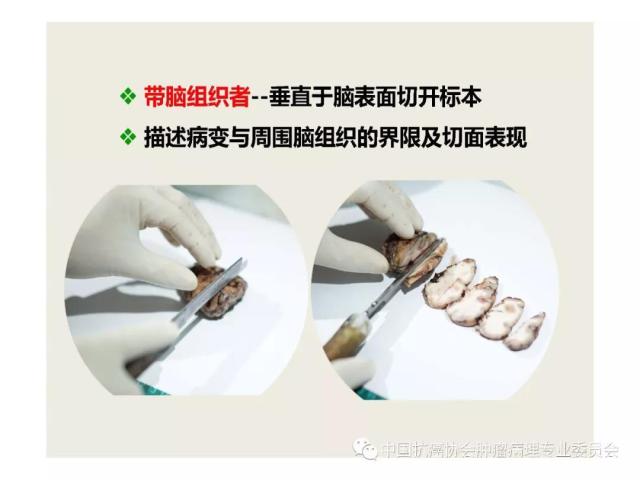
⑸附带脑组织的标本应垂直于脑表面每隔0.5cm平行切开标本,测量和记录病变的范围大小,观察和记录病变部位和质地及其切面的颜色和有无出血、坏死、囊性变等,并描述病变与周围脑组织的界限是否清楚及邻近脑组织的灰白质结构有无异常改变等。
⑹标本为破碎组织时,应测量和记录标本总的长×宽×高的最大径,其余观察和描述同上。
7.3.2 取材:
⑴ 术中冰冻标本取材:标本有明确肿块者在肿块处取材;有脑表面结构者均按照垂直于脑表面切开标本,在可疑病变处取材。具体取材块数可视标本大小及需要而定。
⑵ 石蜡包埋标本取材:取材原则与术中冰冻标本取材相同。
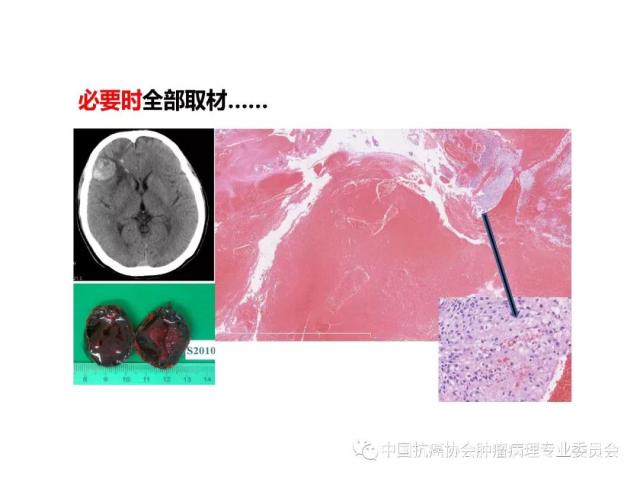
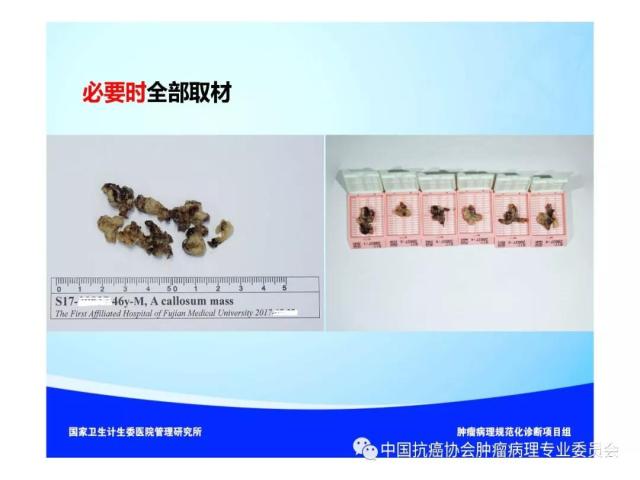
①不能做多个间隔0.5cm平行切面的小标本应全部取材送检;
②病变最大直径≤5cm者,应至少在每个间隔0.5cm平行切面的病变处取材1块,必要时宜全部取材送检;
③病变最大直径>5cm者,应至少在每个间隔1cm平行切面的病变处取材1块,必要时可根据需要适当多取;
④较大标本必须在病变与脑或脊髓交界处取材,如病变含大片坏死组织,应于非坏死区取材;
⑤标本为破碎组织时,取材块数视标本大小及需要而定。
8、病理诊断
8.1、病理诊断标准
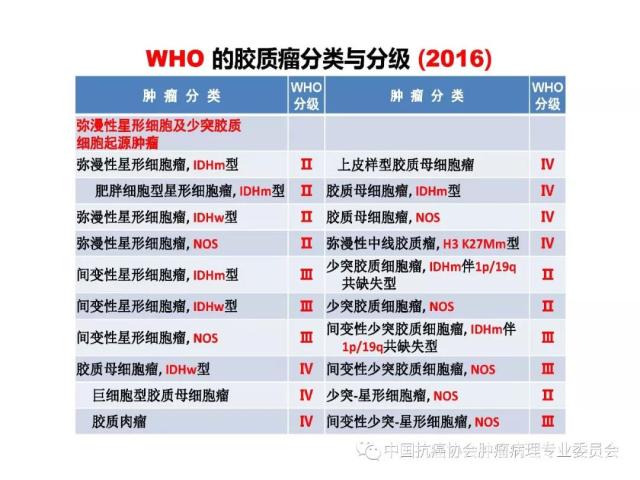
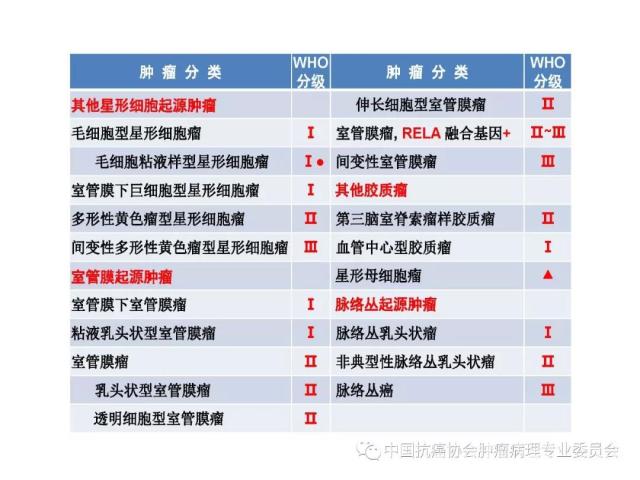
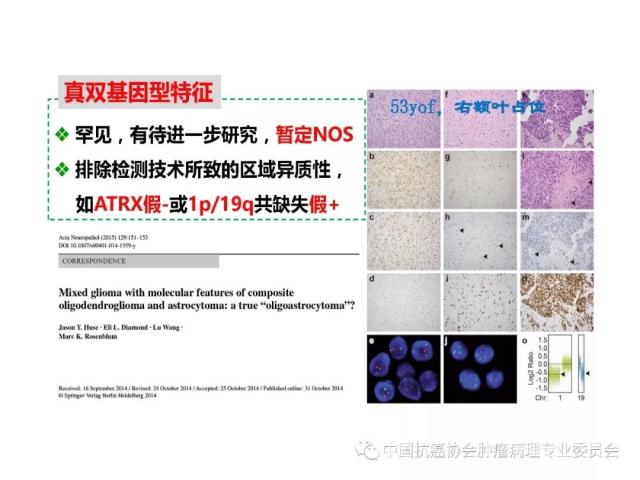
胶质瘤病理诊断应采用国内外公认的 WHO 中枢神经系统肿瘤病理学分类、分型及分级标准。本标准参照2016版《WHO中枢神经系统肿瘤分类》对胶质瘤组织学分类、组织学分型、分子分型及分级的标准(附录 A、附录B),但允许暂无条件的病理科不做分子分型诊断。
8.2、 组织学分类、组织学分型、分子分型及分级
2016版WHO分类对胶质瘤的组织学分类、组织学分型、分子分型及分级参见附录A。
8.3、 组织学分级标准
2016版WHO分类对胶质瘤的组织学分级标准参见附录B。
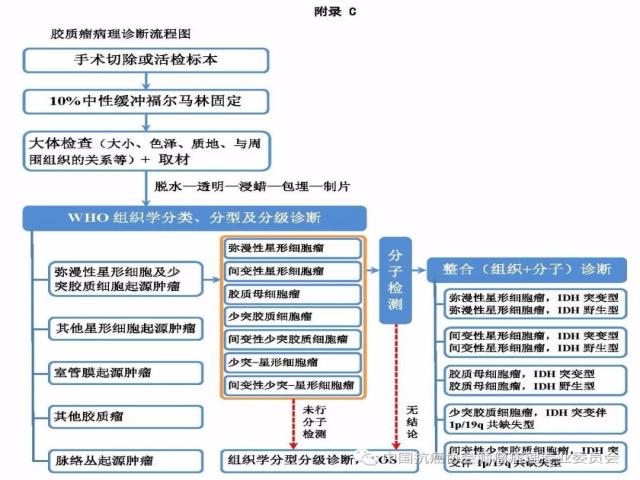
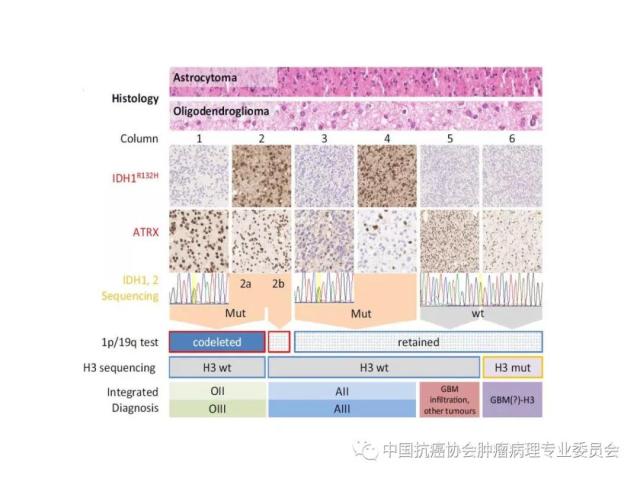
8.4、病理诊断流程
胶质瘤的病理诊断流程参见附录C。
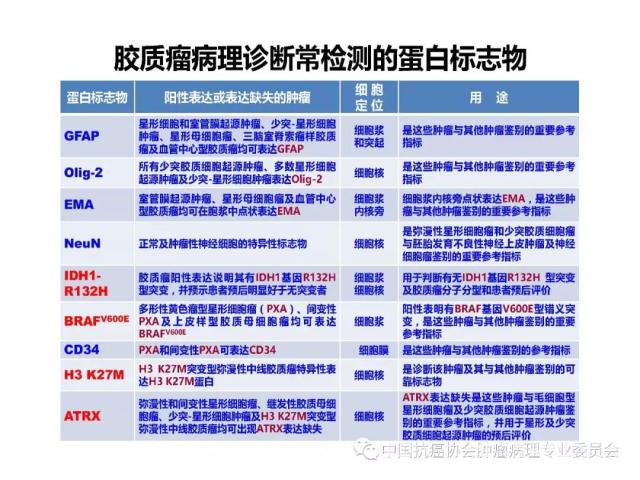
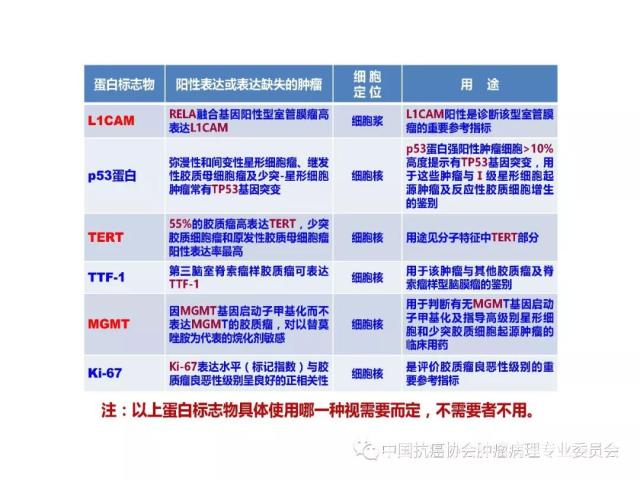
9、胶质瘤病理诊断常用的蛋白标志物
常用于胶质瘤病理诊断、预后评估及指导临床治疗的蛋白标志物参见附录D。
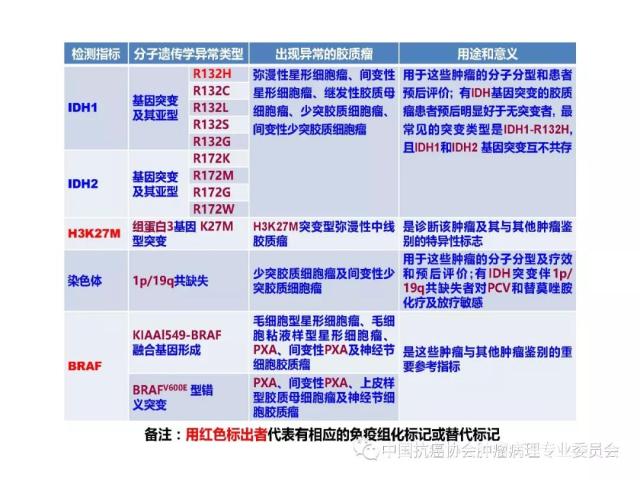
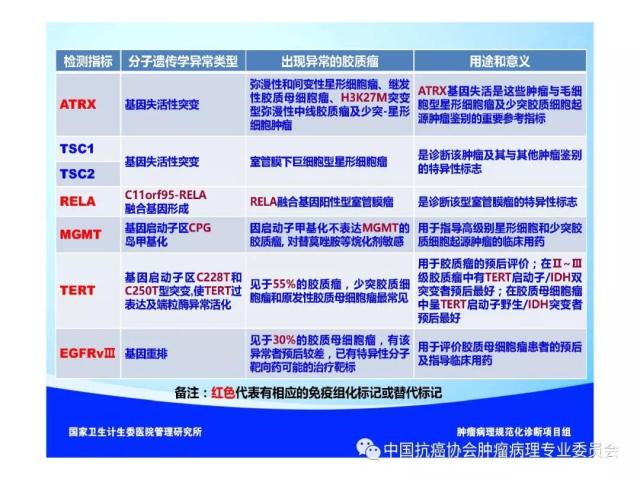
10、胶质瘤病理诊断、预后评估及与治疗相关的分子遗传学检测
常用于胶质瘤病理诊断、预后评估及与治疗相关的分子遗传学检测指标参见附录E。
11、病理报告内容及规范
11.1 组织病理报告应包括以下内容
肿瘤部位,精确的病理诊断(组织学分型及分级),对于难以给出确切诊断者应给出考虑或符合诊断;组织病理报告应附上免疫组化或组织化学分析的结果;对于需要上级医院会诊及有其他特殊情况者应在报告中给出明确备注。
11.2 分子病理报告应包括以下内容
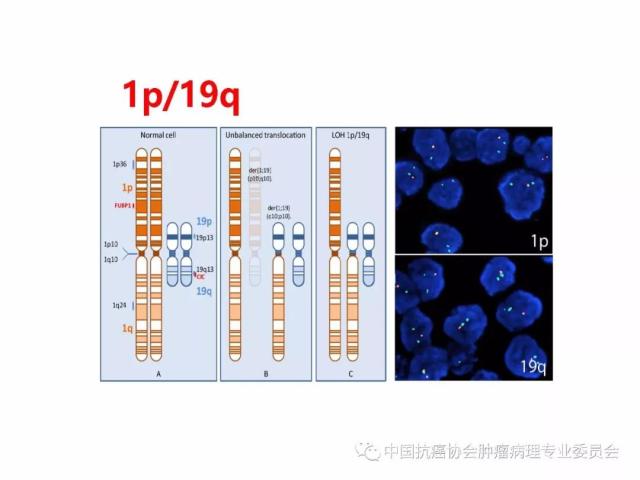
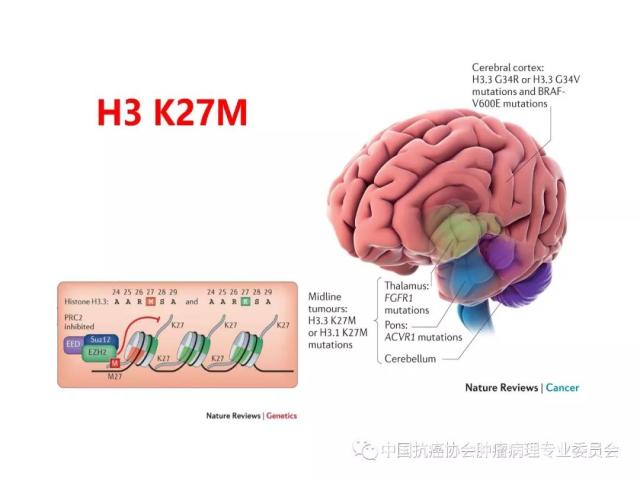
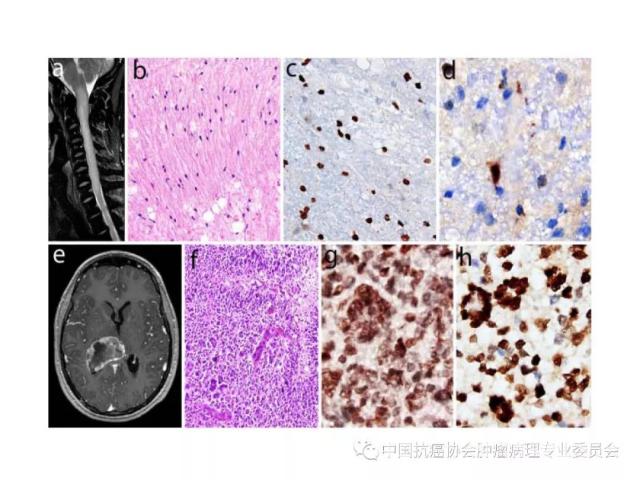
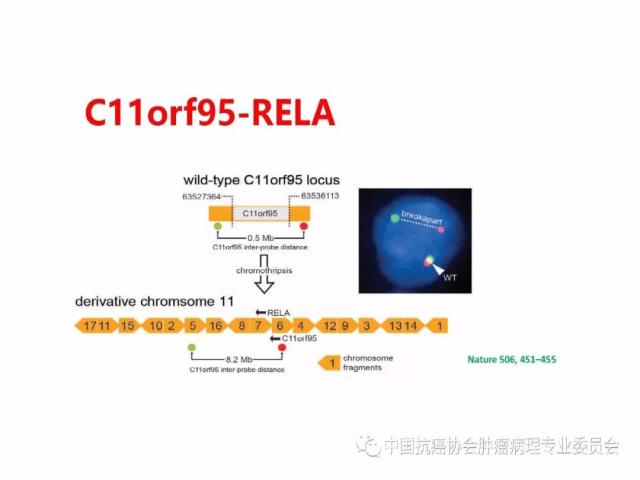
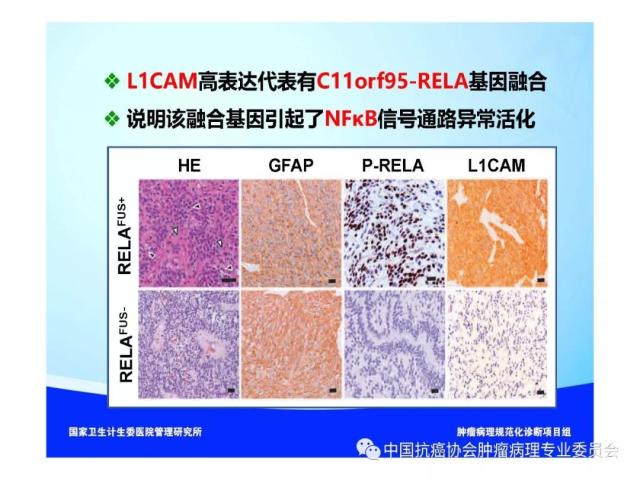
肿瘤的分子分型以及有无IDH1/2突变、H3 K27M突变、染色体1p/19q共缺失、BRAF V600E突变、KIAAl549-BRAF和C11orf95-RELA 融合基因形成、MGMT启动子甲基化等分子遗传学检测信息,并在报告单上注明检测方法及分子遗传学检测结果的基本意义等。
11.3、以组织学分类、分型及分级诊断为主,在没有条件的病理科可以不作分子检测及分子诊断。
11.4、病理诊断报告推荐格式
胶质瘤病理诊断报告的推荐格式参见附录 F。





参 考 文 献
1.Louis DN, Ohgaki H, Wiestler OD, et al, eds.WHO classification of tumours of the central nervous system. Lyon: IARC Press,2016.
2.Ichimura K, Narita Y, Hawkins CE. Diffuselyinfiltrating astrocytomas: pathology, molecular mechanisms and markers. ActaNeuropathol, 2015, 129(6): 789-808.
3.Aldape K, Zadeh G, Mansouri S, et al.Glioblastoma: pathology, molecular mechanisms and markers. Acta Neuropathol,2015, 129(6): 829-848.
4.Wesseling P, van den Bent M, Perry A.Oligodendroglioma: pathology, molecular mechanisms and markers. ActaNeuropathol, 2015, 129(6): 809-827.
5.Collins VP, Jones DT, Giannini C. Pilocyticastrocytoma: pathology, molecular mechanisms and markers. Acta Neuropathol,2015, 129(6): 775-788.
6.Yan H, Parsons DW, Jin G, et al. IDH1 andIDH2 mutations in gliomas. N Engl J Med, 2009, 360 (8): 765-773.
7.Jones C, Baker SJ. Unique genetic andepigenetic mechanisms driving paediatric diffuse high-grade glioma. Nat RevCancer, 2014, 14(10): 651-661.
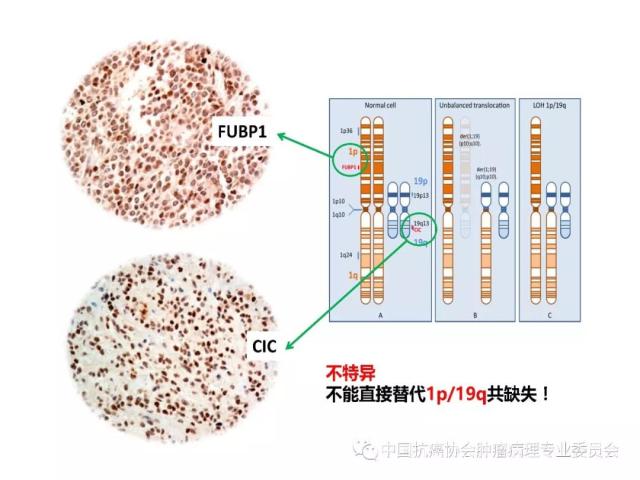
8.Yip S, Butterfield YS, Morozova O, et al.Concurrent CIC mutations, IDH mutations, and 1p/19q loss distinguisholigodendrogliomas from other cancers. J Pathol, 2012, 226(1): 7-16.
9.Kleinschmidt-DeMasters BK, Aisner DL,Foreman NK. BRAF VE1 immunoreactivity patterns in epithelioid glioblastomaspositive for BRAF V600E mutation. Am J Surg Pathol, 2015, 39(4):528-540.
10.Parker M, Mohankumar KM, Punchihewa C, et al.C11orf95-RELA fusions drive oncogenic NF-κB signalling in ependymoma. Nature, 2014,506(7489): 451-455.
11.Reuss DE, Sahm F, Schrimpf D, et al. ATRX andIDH1-R132H immunohistochemistry with subsequent copy number analysis and IDHsequencing as a basis for an "integrated" diagnostic approach foradult astrocytoma, oligodendroglioma and glioblastoma. Acta Neuropathol, 2015,129(1): 133-146.
12.Kannan K, Inagaki A, Silber J, et al.、、 Whole-exome sequencing identifies ATRXmutation as a key molecular determinant in lower-grade glioma. Oncotarget,2012, 3(10): 1194-1203.
13.Nonoguchi N, Ohta T, Oh JE, et al. TERTpromoter mutations in primary and secondary glioblastomas. Acta Neuropathol,2013, 126(6): 931-937.
14.Bielle F, Villa C, Giry M, et al. Chordoidgliomas of the third ventricle share TTF-1 expression with organum vasculosumof the lamina terminalis. Am J Surg Pathol, 2015, 39(7): 948-956.
15.Montano N, Cenci T, Martini M, et al.Expression of EGFRvIII in glioblastoma: prognostic significance revisited.Neoplasia, 2011, 13(12): 1113-1121.






















































































共0条评论