来源:中国抗癌协会肿瘤病理专业委员会
本标准起草单位:复旦大学附属肿瘤医院、四川大学华西医院、北京军区总院、北京大学肿瘤医院
本标准起草人:杨文涛、步宏、丁华野、薛卫成
1、范围
本标准规定医疗机构病理科或其他具备相应资质的实验室进行乳腺癌病理诊断工作的基本原则、通用操作规范以及相关临床与管理部门的职责与要求。
本标准适用于医疗机构病理科、承担肿瘤病理诊断的病理教研室、独立实验室等机构(以下简称病理科)。
2、规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅所注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
《中华人民共和国执业医师法》
《临床技术操作规范-病理学分册》
《病理科建设与管理指南(试行)》(卫办医政发(2009)31号)
WHO乳腺肿瘤组织学分类(2003版和2012版)
AJCC乳腺癌分期(第七版)
乳腺癌NCCN指南(2014版)
St Gallen早期乳腺癌国际共识(2015版)
中国乳腺癌HER2检测指南(2014版)
中国乳腺癌雌、孕激素受体免疫组织化学检测指南(2015版)
乳腺癌新辅助化疗后的病理诊断专家共识(2015版)
中国抗癌协会乳腺癌诊治指南与规范(2014版)
3、术语和定义
3.1 导管原位癌ductal carcinoma in situ
一种肿瘤性导管内病变,特征为导管型肿瘤性上皮细胞明显增生,细胞有轻至重度异型,未突破导管基底膜,缺乏间质浸润。
3.2 小叶瘤变lobular neoplasia
发生于终末导管小叶单位内的、通常以体积较小、黏附松散的小叶型肿瘤细胞为特征的全系列性不典型上皮增生性病变,可伴或不伴有终末导管的派杰样扩散。小叶性肿瘤包括不典型小叶增生和小叶原位癌。
3.3 微浸润癌microinvasive carcinoma
癌细胞突破基底膜浸润至邻近组织,其浸润灶的最大径≤1mm。
3.4 前哨淋巴结sentinel lymph node
首先收纳乳腺区域淋巴液的1个或数个淋巴结。
4、标本类型及固定
4.1 标本类型
包括粗针穿刺活检标本、麦默通活检标本、各种手术切除标本。
4.2 标本固定
4.2.1 标本的采集与送检,编号与登记参见总则。
4.2.2 穿刺或切除后的乳腺组织应立即固定(不得超过1小时)。应选择足够的磷酸缓冲液配制的4%中性甲醛固定液。当组织较大时,应将其每隔5mm切开,宜用纱布或滤纸将相邻的组织片分隔开,以保障固定液的充分渗透和固定。固定时间6-72小时。
5、取材及大体描述规范
接受标本后,首先必须核对姓名、床位号、住院号、标本名称及部位。
5.1 粗针穿刺活检标本
5.1.1 大体检查及记录:标明穿刺组织的数目,每块组织的大小,包括直径和长度。
5.1.2 取材:送检组织全部取材。粗针穿刺活检标本不宜行术中病理诊断。
5.2 麦默通活检标本
5.2.1 大体检查及记录:标明活检组织的总大小。
5.2.2 取材:送检组织全部取材。麦默通活检标本不宜行术中病理诊断。
5.3 乳腺肿块切除标本
5.3.1 大体检查及记录
按外科医生的标示确定送检标本的部位。若未标记,应联系外科医生明确切除标本所在的位置。测量标本三个径线的大小;若带皮肤,应测量皮肤的大小。
测量肿瘤或可疑病变三个径线的大小。记录肿瘤或可疑病变的部位和外观。记录每块组织所对应的切片总数及编号。
5.3.2 取材
术中冰冻取材:有明确肿块,肿块处取材。如为钙化灶,宜对照X线摄片对可疑病变取材。如无明确肿块,对可疑病变处取材
石蜡取材:若肿块或可疑病变最大径小于或等于5cm,应至少每1cm取材1块,必要时宜全部取材后送检。若标本肿块或可疑病变最大径大于5cm,应每1cm至少取材1块,如6cm的肿块至少取材6块。乳腺实质的其它异常和皮肤均需取材。
5.4 乳腺病变保乳切除标本
5.4.1 大体检查及记录
(1)按外科医生的标示确定送检标本的部位。若未标记,应联系外科医生明确切除标本所在的位置。
(2)测量标本三个径线的大小,若附带皮肤,则测量皮肤的大小。
(3)根据临床标记,正确放置标本,建议将标本各切缘(表面切缘、基底切缘、上切缘、下切缘、内切缘、外切缘)涂上染料。
(4)按从表面到基底的方向,沿标本长轴每隔5mm做一个切面,将标本平行切分为若干块组织,并保持各块组织的正确方向和顺序。
(5)仔细查找病灶,并测量肿瘤三个径线的大小;若为化疗后标本,则测量瘤床大小;若为局切后标本,则描述残腔大小及有无残留病灶。
(6)测量肿瘤、瘤床或残腔距各切缘的距离,观察最近切缘。
(7)记录每块组织所对应的切片编号及对应取材内容。
5.4.2 取材
5.4.2.1 切缘取材
保乳标本切缘取材主要有两种方法:垂直切缘放射状取材(radial sections perpendicular to the margin)和切缘离断取材(shave sections of the margin)。
(1)垂直切缘放射状取材(图1):根据手术医生对保乳标本做出的方位标记,垂直于基底将标本平行切成多个薄片(建议间隔5mm),观察每个切面的情况。描述肿瘤大小、所在位置及肿瘤距各切缘的距离,取材时将大体离肿瘤较近处的切缘与肿瘤一起全部取材,大体离肿瘤较远处的切缘抽样取材,镜下观察时准确测量切缘与肿瘤的距离。

图1 垂直切缘放射状取材
(2)切缘离断取材: 将六处切缘组织离断,离断的切缘组织充分取材,镜下观察切缘的累犯情况(图2)。
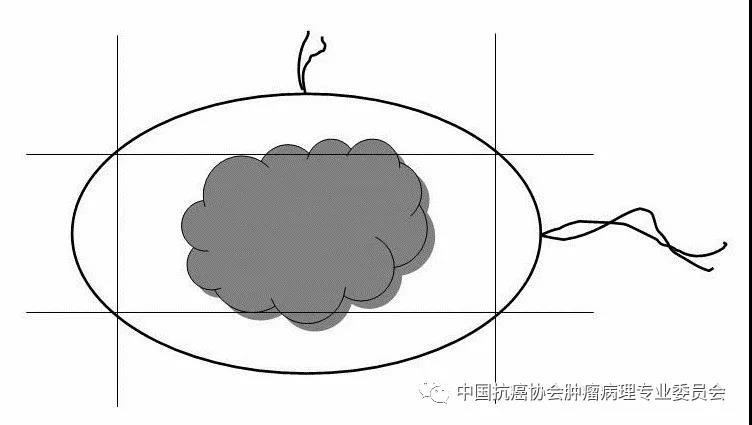
图2 切缘离断取材
5.4.2.2 肿瘤及周围组织取材
若肿块或可疑病变最大径小于或等于5cm, 应沿肿瘤或可疑病变的最大切面至少每1cm取材1块,必要时宜全部取材后送检。若肿块或可疑病变最大径大于5cm,则每1cm至少取材1块。若为新辅助化疗后标本,则参照乳腺癌新辅助治疗后病理诊断规范(2015版)进行取材。若为手术残腔:送检代表性的切面,包括可疑的残留病灶。
乳腺实质的其它异常。
皮肤。
5.5 乳腺切除术(包括单纯切除术和改良根治术)
5.5.1 大体检查及记录
按正确的方向摆放标本以便识别肿瘤所在的象限:改良根治术标本可通过识别腋窝组织来正确定位(腋窝组织朝向外上方)。单纯切除术标本,需根据外科医生的标记来定位,若未标记方向,则与外科医生联系以确定标本的正确方向。
测量整个标本及附带皮肤、腋窝组织的大小。描述皮肤的外观,如有无手术切口、穿刺点、瘢痕、红斑或水肿等。
从基底部水平切开乳头,取乳头水平切面组织一块以观察输乳管的横断面,而后垂直于乳腺表面切开乳头其它组织。描述乳头、乳晕的外观。
将标本切成连续的薄片。
仔细查找病灶,记录病灶所在象限位置,描述肿瘤(质地、颜色、边界、与皮肤及深部结构的关系)或手术残腔的特征。若有明确肿块,则测量肿瘤三个径线的大小;若为化疗后标本,则测量瘤床大小;若为局切后标本,则描述残腔大小及有无残留病灶。测量肿瘤、残腔、瘤床距最近表面切缘及基底切缘的距离。
描述非肿瘤乳腺组织的情况。
将腋窝脂肪组织同标本离断后,仔细寻找淋巴结,对规范的腋窝清扫标本宜至少找及10枚淋巴结。描述淋巴结的总数目及最大径范围、有无融合、有无与周围组织粘连。注意需附带淋巴结周围的结缔组织。
5.5.2 取材
原发肿瘤和手术残腔的取材:
若为肿瘤:送检肿瘤的最大切面;若肿块或可疑病变最大径小于或等于5cm,应至少每1cm取材1块,必要时宜全部取材后送检。若标本肿块或可疑病变最大径大于5cm,则每1cm至少取材1块,如已诊断为导管原位癌,应将病灶全部取材。
若为化疗后瘤床,则参照乳腺癌新辅助治疗后病理诊断规范(附录A)取材。
若为手术残腔:送检代表性的切面,包括可疑的残留病灶。
其余组织的异常病灶。
乳头。
距肿瘤最近处表面被覆皮肤。
距肿瘤最近处基底切缘,尽可能取切缘的垂直切面。
周围象限乳腺组织每个象限代表性取材1块
5.6 前哨淋巴结活检
(1)宜将淋巴结每间隔2mm切成若干片组织。
(2)仔细检查每片组织上是否存在肉眼可见的转移灶。
(3)所有切面均需送组织学评估。
6、病理诊断分类、分级和分期方案(附B,附C,附D)
6.1 组织学分型
参见附件B,某些组织学类型的准确区分需行免疫组化后确定。
6.2 组织学分级
参见附件C。
6.3 乳腺癌的分期方案
参见附件D。
7、免疫组化和分子病理检测及其质量控制
7.1 应对所有乳腺浸润性癌病例进行ER(雌激素受体)、PR(孕激素受体)、HER2免疫组化染色,HER2 2+病例应进一步行原位杂交检测。ER、PR检测参考中国乳腺癌ER,PR检测指南(参见附件E)。HER2检测参考中国乳腺癌HER2检测指南(参见附件F)。
7.2 应对所有乳腺浸润性癌病例进行Ki-67检测,并对癌细胞中阳性染色细胞所占的百分比进行报告。
7.3 开展乳腺癌免疫组化和分子病理检测的实验室应建立完整有效的内部质量控制和认证体系,不具备检测条件的单位应妥善地准备好标本,提供给具有相关资质的病理实验室进行检测。
8、病理报告内容及规范
乳腺浸润性癌的病理报告(参见附录G)应包括与患者治疗和预后相关的所有内容,如肿瘤大小、组织学类型、组织学分级、有无并存的导管原位癌、有无脉管侵犯、切缘和淋巴结情况等。还应包括ER、PR、HER2、Ki-67的检测情况。若为治疗后乳腺癌标本,则应对治疗后反应进行病理评估。导管原位癌的病理诊断报告应报告核级别(低、中或高级别)和有无坏死(粉刺或点状坏死)、以及手术切缘情况。对癌旁良性病变,宜明确报告病变名称或类型。对保乳标本的评价宜包括显微镜检查中肿瘤距切缘最近处的距离、若切缘阳性,应注明切缘处肿瘤的类型(原位癌或浸润性癌)。
附录A
乳腺癌新辅助化疗后的病理诊断专家共识(2015版)
附录B
乳腺癌组织学分型(参照2003版及2012版WHO)
附 录 C
乳腺癌组织学分级
根据是否有腺管形成、细胞核多形性及核分裂象计数3项指标进行分级, 建议采用改良的Scarff-Bloom-Richardson分级系统。

注:对腺管结构、细胞核多形性及核分裂计数三个指标分别进行评分:总分为3-5分,组织学分级为Ⅰ级;6-7分,组织学分级为Ⅱ级;8-9分,组织学分级为Ⅲ级。
附录D
(资料性附录)
乳腺癌TNM分期(AJCC 第七版)
原发肿瘤(T)
TX 原发肿瘤无法评估。
T0 没有原发肿瘤证据。
Tis 原位癌:
Tis(DCIS) 导管原位癌
Tis(LCIS) 小叶原位癌
Tis(Paget) 乳头派杰病,乳腺实质中没有浸润性癌和(或)原位癌
注:乳腺实质有癌且伴派杰病者,应按乳腺实质肿瘤的大小进行分期,并注明派杰病的存在。
T1 肿瘤最大直径≤2cm
T1mic 微小浸润癌,浸润灶最大直径≤0.1cm
注:对于多发微浸润灶,以单个最大浸润灶的大小为分期标准,而不以所有浸润灶的总和为准,但要注明多灶微浸润。形成多个局部浸润病灶时,根据最大病灶的直径大小进行分期。
T1a 肿瘤最大直径>0.1cm, 但≤0.5cm
T1b 肿瘤最大直径>0.5cm, 但≤1cm
T1c 肿瘤最大直径>1cm, 但≤2cm
T2 肿瘤最大径大>2cm, 但≤5cm
T3 肿瘤最大径>5cm
T4 无论肿瘤大小,直接侵及胸壁或皮肤
T4a 肿瘤侵犯胸壁,不包括仅侵犯胸肌(包括肋骨、肋间肌和前锯肌,但不包括胸肌)
T4b 乳腺皮肤水肿(包括橘皮样变),溃疡,或不超过同侧乳腺的皮肤卫星结节
T4c 兼有T4a和T4b的表现
T4d 炎性乳癌
区域淋巴结(N)
NX 区域淋巴结无法评估
N0 区域淋巴结无转移
N1 同侧腋窝淋巴结转移,淋巴结可活动pN1mi 微转移( 最大直径>0.2mm,但<2mm)
N2 同侧腋窝淋巴结转移,固定或相互融合或缺乏同侧腋窝淋巴结转移的临床证据,但临床上发现同侧内乳淋巴结转移*
N2a 同侧腋窝淋巴结转移,固定或相互融合
N2b 仅临床上发现内乳淋巴结转移*,而无同侧腋窝淋巴结转移的临床证据
N3 同侧锁骨下淋巴结转移伴或不伴有腋窝淋巴结转移;或临床上发现同侧内乳淋巴结转移*,并伴有腋窝淋巴结转移;或同侧锁骨上淋巴结转移伴或不伴腋窝或内乳淋巴结转移
N3a 同侧锁骨下淋巴结转移
N3b 同侧内乳淋巴结及腋窝淋巴结转移
N3c 同侧锁骨上淋巴结转移
*临床发现=临床检查或影像学检查发现的淋巴结转移,高度怀疑存在转移,或者根据细针吸细胞学推定存在淋巴结宏转移。通过针吸细胞学而非切除活检证实存在转移者,应添加后缀(f)。
远处转移 (M)
Mx 远处转移无法评估
M0 无远处转移
M1 有远处转移
区域淋巴结(pN)
病理学分类至少要求切除腋下组(Ⅰ级)淋巴结,这种切除通常至少包括6枚淋巴结。如果淋巴结呈阴性,但是淋巴结数目不足,分类为pN0。
pNx 区域淋巴结无法评估(淋巴结未切除或此前已切除)
pN0 组织学检查无区域淋巴结转移*
注:孤立肿瘤细胞(ITC)是指通过常规HE切片或免疫组织化学发现,单个肿瘤细胞或成团的肿瘤细胞病灶大小不超过0.2mm;对于分散不融合的肿瘤,每个淋巴结单张组织切片中肿瘤细胞数量不超过200个。仅含有ITC的淋巴结,不能算作阳性淋巴结,但要计入淋巴结总数。
pN1 微小转移:或1-3枚同侧腋窝淋巴结转移,和(或)经前哨淋巴结活检发现内乳淋巴结镜下转移,但无临床征象*
pN1mi 微小转移(>0.2mm,或单个淋巴结单张组织切片中肿瘤细胞数量超过200个,但最大直径≤2mm)
pN1a 1-3枚腋窝淋巴结转移,至少1处转移灶>2mm
pN1b 经前哨淋巴结活检发现内乳淋巴结镜下转移(包括微转移),但无临床征象
pN1c pN1a +pN1b
pN2 转移情况描述如下:
pN2a 4-9枚腋窝淋巴结转移,至少1处转移灶>2mm
pN2b 有临床转移征象的同侧内乳淋巴结转移*,但不伴有腋窝淋巴结转移
pN3 转移情况描述如下:
pN3a ≥10枚同侧腋窝淋巴结转移(至少1处转移灶>2mm),或锁骨下淋巴结(Ⅲ级腋窝淋巴结)转移
pN3b 有临床转移征象的同侧内乳淋巴结转移*,并且有≥1枚腋窝淋巴结转移;或存在≥3枚腋窝淋巴结转移,通过检测前哨淋巴结发现内乳淋巴结转移,但无临床征象。
pN3c 同侧锁骨上淋巴结转移
注:*有临床征象=临床检查或影像学检查发现的淋巴结转移(不包括淋巴闪烁造影术);高度怀疑存在转移;或者根据细针吸细胞学推定存在淋巴结宏转移;通过针吸细胞学而非切除活检证实转移存在者。
无临床征象=临床检查或影像学分析(不包括淋巴闪烁造影术)未查到转移。

附录E
(资料性附录)
中国乳腺癌雌、孕激素受体免疫组织化学检测指南(2015版)
附录F
(资料性附录)
中国乳腺癌HER2检测指南(2014版)
附录G
(资料性附录)
乳腺癌病理诊断报告书推荐格式 
点击查看PC端视频
点击查看手机端视频
参 考 文 献
1. Tavassoli FA,Devilee P. World Health Organization Classification of Tumours.Pathology and genetics of tumours of the breast and female genital organs Lyon:IARC Press, 2003.
2. Lakhani SR, Ellis IO, Schnitt SJ, et al. World Health OrganizationClassification of Tumours: World Health Organization Classification of Tumoursof the Breast. Lyon: IARC Press, 2012.
3. NCCN ClinicalPractice Guideline in OncologyTM. Breast Cancer. 2014 Nationalcomprehensive Cancer Network.
4. American Joint Committeeon Cancer. AJCC Cancer Staging Handbook, 7th ed. Chicago: Springer,2010.
5. Wright MJ, Park J, Fey JV, et al. Perpendicular inked versustangential shaved margins in breast-conserving surgery: does the method matter?J Am Coll Surg, 2007, 204(4):541-549.
6. Elston CW, Ellis IO. Pathological prognostic factorsin breast cancer. I. The value of histological grade in breast cancer:experience from a large study with long-term follow-up. Histopathology, 1991, 19(5):403-410.
7. 乳腺癌雌、孕激素受体检测指南. 中华病理学杂志, 2015, 44(4):237-240.
8. 乳腺癌HER2检测指南(2014版). 中华病理学杂志, 2014,43(4):262-267.
9. 乳腺癌新辅助化疗后的病理诊断专家共识. 中华病理学杂志, 2015,44(4):232-236.
10. Dowsett M, Nielsen TO, A’Hern R,et al. Assessment of Ki67 in breast cancer: recommendations from the InternationalKi67 in Breast Cancer Working Group. J Natl Cancer Inst, 2011,103 (22):1656–1664.
11. Coates AS, Winer EP, Goldhirsch A,et al. Tailoringtherapies-improvingthe management of early breast cancer:StGalleninternational expert consensus on the primary therapy of earlybreast cancer 2015. Ann Oncol, 2015,26(8):1533-1546.



















共0条评论