[导读] 作者:吴焕文, 刘旭光, 李俊杰, 王 婧, 张 卉, 庞俊译, 梁智勇
( 中国医学科学院北京协和医院 病理科, 北京 100730)
[摘要]
目的 观察乳腺实性乳头状癌( SPC) 的癌巢周围及纤维血管轴心中肌上皮细胞存在与分布情况, 探讨肌上皮标记在 SPC 鉴别诊断及浸润判断中的价值。
方法 收集 23 例乳腺 SPC 的临床病理资料, 进行形态学观察及肌上皮细胞免疫组化结果判读,并复习相关文献。
结果 23 例 SPC 中, 18 例( 78. 3% ) 在癌巢周围及纤维血管轴心中至少有一种肌上皮标记的表达,其中 12 例( 52. 2% ) 具有基本完整的癌巢外周及纤维血管轴心肌上皮细胞层,6 例( 26. 1% ) 有不同程度的肌上皮细胞缺失,仅 5 例( 21. 7% ) 肌上皮细胞完全缺失。然而, 与周围正常导管 /小叶相比较,SPC 的肌上皮细胞数目均明显减少( 尤以 p63 染色最为明显,表现为 p63 染色的肌上皮细胞核间距增宽) 。p63、CK14 在肌上皮细胞染色强度与范围上具有较高的一致性, 背景反应少, 较易判读。CD10 对部分病例癌巢外周肌上皮染色效果欠佳。所有病例的肿瘤细胞 CK5 /6 均( - ) ,且至少有一种神经内分泌标记的表达。
结论 SPC在癌巢外周及纤维血管轴心内可存在完整或部分的肌上皮细胞层。SPC 病例中肌上皮细胞核间距增加、数目减少。肌上皮细胞存在与否对于 SPC 与 UDH 的鉴别诊断以及 SPC 浸润的判断应用价值有限。
乳腺实性乳头状癌 ( solid papillary carcinoma,SPC) 是少见类型的乳腺乳头状肿瘤, 多发生于 > 60岁的老年女性。Maluf 与 Koerner[1] 于 1995 年首先提出 SPC 这一名称,用来描述一组具有特定组织病理学特征的病变,这些特征包括: 实性乳头状生长方式、低级别的细胞学特点、细胞内外的黏液沉积、常伴有神经内分泌分化, 推测此病变可能是伴有神经内分泌分化的富于细胞性黏液癌的浸润前期。鉴于SPC 常伴神经内分泌分化、常见梭形细胞、实性乳头状生长,也有文献将类似病变称为神经内分泌导管内癌、内分泌型导管内癌、梭形细胞导管内癌、实性导管内乳头状癌、导管内乳头状癌实性亚型[2-7]。肌上皮细胞对于乳头状肿瘤的病理诊断与鉴别诊断非常重要。目前,国内外关于SPC中的肌上皮存在与分布情况的研究较少, 且存在争议。本文拟通过观察 SPC 中的肌上皮存在与分布情况, 探讨肌上皮细胞及其标记物在 SPC 鉴别诊断及浸润判断中的价值。
1 材料与方法
1. 1 材料 收集 2014-05—2017-02 间北京协和医院病理科存档的 23 例 SPC 的临床与病理资料,所有病例均经 3 位病理医师 ( 2 位高年资、1 位低年资) 重新阅片一致确认诊断。
1. 2 方法 标本经 4% 中性甲醛液固定, 常规脱水、石蜡包埋,4 μm 厚切片,HE 染色,光镜观察。免疫组化采用 EnVision 两步法,所采用 SMA 一抗购自Dako 公司,CK5 /6 一抗购自北京西雅金桥生物技术有限公司, CD10、CK14 一抗购自 Leica 公司, p63、CgA、Syn 一抗以及二抗均购自北京中杉金桥生物技术有限公司。染色步骤按相关说明书进行。
1. 3 免疫组化评分标准 高分子量角蛋白 CK5 /6及神经内分泌标记 CgA、Syn 的免疫组化评分依据为肿瘤细胞阳性的比例: 0, 无阳性细胞; 1, < 10% ;2,10% ~ 50% ; 3,50% ~ 70% ; 4, > 70%[7]。肌上皮标记的免疫组化评分依据位于肿瘤细胞与间质交界处的肌上皮细胞存在的比例( 肿瘤细胞团外周及肿瘤内纤维血管轴心分别评估) ,比例同前。
2 结果
2. 1 临床病理特点 23 例肿瘤最大径 0. 6 ~ 2. 3cm,来源于 22 位患者( 其中 2 例标本来源于同一患者的不同侧乳腺) 。22 位患者均为女性, 年龄 30 ~88 岁( 中位年龄 73. 5 岁) 。2 例癌巢形态不规整,呈地图样、锯齿状排列,伴有促纤维反应的背景( 图1) ; 10 例伴有普通型浸润性癌( 图2) 。
2. 2 免疫组化 23例标本中分别有22、18、2、20个病例进行了p63、CD10、SMA、CK14 染色(表1)。
所有病例均进行了两种或以上的肌上皮标记染色。18 例( 78. 3% ) 在癌巢外周及癌巢内纤维血管轴心至 少有一种肌上皮标记的表达,其中12 例( 52. 2% ) 具有基本完整的癌巢外周及纤维血管轴心肌上皮细胞层( 图 3,4) ,6 例( 26. 1% ) 有不同程度的肌上皮细胞缺失( 至少有一部分癌巢外周和 /或轴心肌上皮局灶或完全缺失) ( 图 5,6) ; 仅有 5 例( 21. 7% ) 肌上皮细胞完全缺失( 包括前述 2 例癌巢形态不规整的病例) ( 图 7) 。虽然绝大部分病例有不同程度的肌上皮细胞存在, 但是不论是在肌上皮完整或不同程度缺失的病例中, 与周围正常导管相比较, 肌上皮细胞数目均明显减少( 尤以 p63 染色最为明显,表现为 p63 染色的肌上皮细胞核间距增宽) ( 图 8) 。
表 1 23 例 SPC 的肌上皮及腺上皮免疫组化标记表达情况
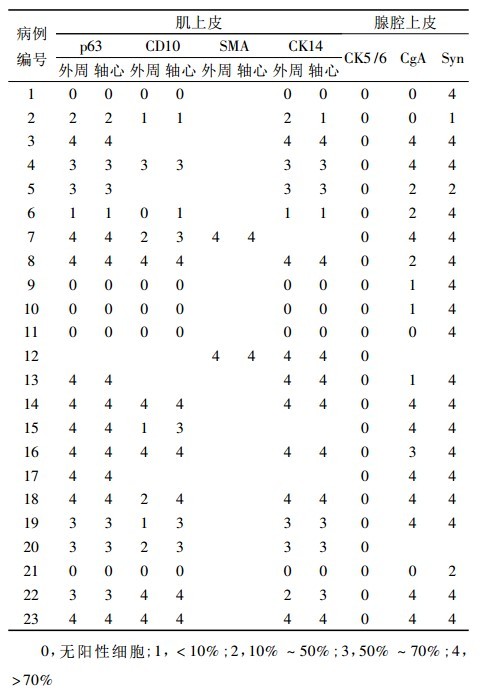
本组病例中, p63、CK14 在肌上皮细胞染色强度与范围上具有较高的一致性,背景反应少,较易判读。CD10 肌上皮染色结果判读有一定的背景反应干扰,且在多个病例中对外周肌上皮染色效果欠佳( 表 1, 图 9) ; 然而, 在另外 1 例病变中, CD10 却比p63 及 CK14 肌上皮染色效果更好( 着色更强且更连续) 。CK5 /6 在多数 SPC 病例中对肌上皮细胞的染色效果欠佳, 不是合适的 SPC 中的肌上皮标记物。2 例还进行了 SMA 肌上皮染色, SMA 染色能够清晰地显示外周和 /或轴心肌上皮, 但是存在间质 /血管背景着色。
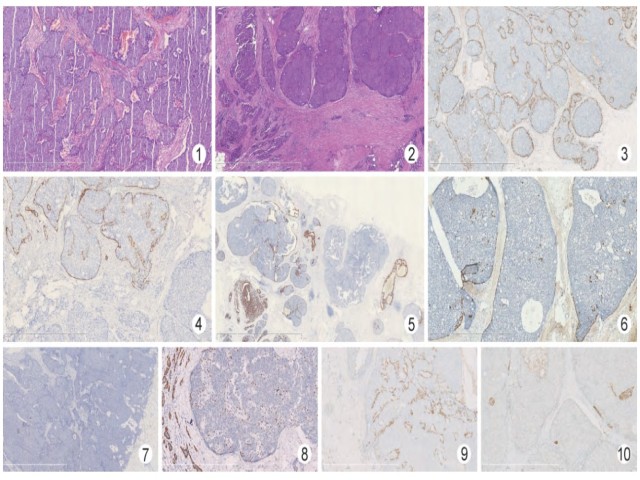
图 1 SPC 癌巢形态不规整,呈地图样、锯齿状排列, 伴有促纤维反应的背景
图 2 SPC( 图右上) , 伴有传统的浸润性癌( 非特殊型) ( 图左下)
图 3 CD10 染色显示癌巢外周及纤维血管轴心具有完整肌上皮细胞层
图 4 CK14 染色显示SPC 癌巢外周及纤维血管轴心具有完整肌上皮细胞层( 图上) ,而伴发的浸润性癌肌上皮完全缺失( 图下)
图 5 CK14 染色显示部分癌巢( 图右中) 外周及纤维血管轴心的肌上皮完全缺失
图 6 CK14 染色显示同一癌巢肌上皮部分缺失( 中部癌巢的右侧)
图 7 CK14 染色显示所有癌巢外周及纤维血管轴心的肌上皮完全缺失( 癌巢形态不规整, 呈地图样、锯齿状排列)
图 8 p63 染色显示,与正常导管 /腺泡相比较( 图左) ,癌巢外周及纤维血管轴心的肌上皮细胞核间距增宽、肌上皮细胞数目明显减少( 图右)
图 9 在多个病例中,CD10 对癌巢外周肌上皮染色效果欠佳
图 10 CK5 /6 染色显示, 肿瘤细胞( - ) ,部分病例癌巢中心或周边残存的正常导管上皮 CK5 /6 呈( + ) EnVision 法
本组所有病例均进行了 CK5 /6 染色, CK5 /6 在这些病例的肿瘤细胞中无一例外地呈阴性, 需要注意的是,部分病例癌巢中心或周边残存的正常导管上皮 CK5 /6 呈阳性( 图 10) 。21 个病例进行了神经内分泌标记染色, 这些病例的肿瘤细胞至少表达一种神经内分泌标记。与 CgA 相比较, Syn 通常染色范围更广、着色更强。
2. 3 淋巴结转移及预后情况 22 例病例中 7 例行前哨淋巴结活检术,2 例行腋窝淋巴结清扫术,均未发现淋巴结转移。18 例患者有预后信息, 随访时间5 ~ 38 个月,均无复发及转移。
3 讨论
肌上皮细胞存在与否及其分布方式对于乳头状肿瘤的病理诊断与鉴别诊断非常重要。良性导管内乳头状瘤具有完整的导管外周肌上皮细胞层及乳头轴心肌上皮细胞层( 后者位于乳头轴心纤维血管间质与腺腔上皮细胞之间的交界处) ; 导管内乳头状瘤 伴 导 管 上 皮 不 典 型 增 生 ( atypical ductalhyperplasia, ADH) 或导管原位癌( DCIS) 具有完整的导管外周肌上皮细胞层, 但在 ADH 及DCIS 区域乳头轴心肌上皮细胞缺失或稀疏; 导管内乳头状癌也具有完整的导管外周肌上皮层, 但病变中的乳头轴心肌上皮细胞完全或几乎完全缺失; EPC 病变外周肌上皮细胞及乳头轴心肌上皮细胞均完全缺失,少部分 EPC 病例可在病变周边存在局灶稀疏的肌上皮细胞。
目前关于 SPC 中肌上皮细胞存在及分布情况研究较少。一般认为, SPC 癌细胞巢外周肌上皮细胞层可以缺失也可以存在, 实性乳头状增生区域内部则缺乏肌上皮细胞[8 - 9] 。然而, 这种认识尚存争议,不同文献报道中的结果有明显差异。在 Maluf等[1] 与 Dickersin 等[10] 的报道中, 几乎所有病例的乳头轴心及癌细胞巢周围均无肌上皮细胞存在。然而,Tsang 等[6] 报道的所有病例的癌细胞巢周围均存在肌上皮细胞。Tan 等[5] 的报道也通过 HMW 免疫组化染色显示此类病变乳头轴心及癌细胞巢周围均存在肌上皮细胞。也有报道认为, SPC 病例中肌上皮细胞存在情况有较大的变异, 肌上皮细胞存在与否可能与受累的导管直径有关( 肌上皮缺失病例中受累导管的最大径更大) , 少部分病例所有癌巢周边均存在肌上皮, 大部分病例存在不同程度的肌上皮缺失[11] 。上述各组研究在 SPC 肌上皮细胞存在与分布方面的差异可能与病例及人群选择、SPC累及的导管直径、肌上皮染色判读标准等因素有关。本文的 SPC 病例中,绝大多数病例癌巢周边及纤维血管轴心存在完整或部分的肌上皮细胞层。结合我们的观察,可以明确 SPC 病例癌巢周边及纤维血管轴心均可以存在肌上皮细胞层。众所周知, SPC 与导管内乳头状瘤伴普通型导管上皮增生具有许多共同的形态学特征, 包括乳头状结构、实性生长方式、细胞流线排列以及低级别的细胞核等。这些相似性使得两者在组织学鉴别上存在一定困难。病变内纤维血管轴心肌上皮细胞的存在与否是鉴别导管内乳头状瘤与导管内乳头状癌的关键之一。鉴于相当一部分 SPC 癌巢内纤维血管轴心均可存在肌上皮细胞,肌上皮细胞免疫组化标记在 SPC 与导管内乳头状瘤伴 ADH 的诊断中的应用价值非常有限。文献报道,CK5 /6、ER 及神经内分泌标记物在两者的鉴别诊断中作用更为重要, SPC 病例 CK5 /6 阴性、ER弥漫强阳性、部分病例神经内分泌标记物 CgA、Syn阳性,而 ADH 病例 CK5 /6 阳性( 马赛克样) 、ER 强弱不等的 阳 性、神 经 内 分 泌 标 记 物 CgA、Syn 阴性[7,12] 。本研究中, 所有病例 CK5 /6 均呈阴性, 且所有病例均表达一或两种神经内分泌标记物。但是,CK5 /6 染色需要避免因病变中残存正常上皮而导致的解读错误。
癌巢外周肌上皮存在与否对于 SPC 浸润的判断价值也有疑问和争议。目前的共识是, SPC 浸润的判断主要依据是组织学形态而非癌巢周围有无肌上皮围绕。根据 SPC 癌巢外周肌上皮的情况及浸润的形态, 大致可以分为 4 类情况: ①如果 SPC 癌巢外周肌上皮存在, 可以将其看成 DCIS 的一种特殊类型; ②如果 SPC 实性细胞巢外周肌上皮缺失,但是癌巢形态规整,没有明确的浸润证据,也应该按照原位癌来进行分期与处理; ③如果实性细胞巢外周肌上皮缺失,癌巢形态不规整呈地图样、锯齿状排列,伴有促纤维反应的背景,部分学者认为此类肿瘤应视作浸润,称为浸润性 SPC 或膨胀性浸润; ④SPC也可与普通型浸润性乳腺癌共存, 后者多为黏液癌或者伴神经内分泌分化,也可为浸润性导管癌、小叶癌、混合性癌等[8,13 - 14] 。当然, 以上的区分方式还存在一些问题,特别是所谓浸润性 SPC 或膨胀性浸润尚缺乏支持其为浸润性癌的直接依据, 且和第 2类情况之间的界定存在主观性。虽然 SPC 有淋巴结转移甚至远处转移的报道且转移灶形态上可高度类似于原发 SPC[1,11,15 - 16] , 目前报道的 SPC 转移病例均伴有多少不等的传统浸润癌成分, 尚无第 2 类或 3 类病例出现转移的报道。因而, 肌上皮标记物在 SPC 浸润判断中的应用价值有限, 其浸润的判断主要依赖于癌巢形态、间质反应及是否伴有普通型浸润性癌。本研究中的病例均无淋巴结转移, 随访过程中亦无复发、转移。鉴于本研究纳入病例数少、随访时间短( 5 ~ 38 个月) , 上述 4 类 SPC 的预后差异需要扩大样本量、增加随访时间来进一步阐明。
虽然本组绝大部分病例在病变整个或部分区域癌巢外周及纤维血管轴心中存在肌上皮, 但我们的确观察到 SPC 病例中肌上皮数目明显减少, 表现为与周围正常导管相比 p63 染色的肌上皮细胞核间距增宽。这种现象的一个可能解释是肿瘤膨胀性生长、病变导管迅速扩张, 压迫周围肌上皮细胞, 导致肌上皮细胞胞质的拉伸, 进而使得相邻肌上皮细胞胞核之间的间距增加[11, 17] 。Tramm 等[17] 在伴大汗腺改变的导管中也观察到了类似现象。然而, 与正常导管相比,伴大汗腺改变的导管中肌上皮细胞与腺腔上皮细胞数目的比值显著降低, 而具有良性增生性改变的非大汗腺扩张导管中肌上皮细胞的数目分布与正常导管相似。认为大汗腺病变肌上皮细胞核间距增加、数目减少可能与导管扩张导致的肌上皮细胞胞质拉伸无关。SPC 中肌上皮细胞核间距增加、数目减少的具体原因和机制有待于进一步探讨。本组病例中, p63、CK14 染色效果较好, 具有较高的一致性, 背景反应少, 较易判读, 是 SPC 优选的肌上皮标记物。CD10 有背景染色, 在部分病例中对癌巢外周肌上皮染色效果欠佳, 但是在个别病例中能够作为 p63、CK14 的补充。CK5 /6 在多数 SPC病例中对肌上皮的染色效果欠佳, 不适宜作为 SPC中的肌上皮标记物。因而, SPC 中可能存在免疫表型改变的情况,多种肌上皮标记物的联合使用能够更准确地反应 SPC 中肌上皮细胞的真实情况。
综上,我们的结果表明,SPC 在癌巢外周及纤维血管轴心内均可存在完整或部分的肌上皮细胞层。与周围正常导管相比较, SPC 病例中肌上皮细胞核间距增加、数目减少。p63、CK14 在 SPC 肌上皮染色中的效果较好, 多种肌上皮标记物的联合使用能够更准确地反应 SPC 中肌上皮细胞的真实情况。肌上皮细胞存在与否对于 SPC 与 ADH 鉴别以及SPC 浸润判断的应用价值有限。
点击下载PDF文献
参考文献:略















共0条评论