[导读] 研究表明,输卵管(尤其是伞端)在某些盆腔肿瘤的发生中发挥关键性作用,这一器官受到越来越多的关注。本文系统复习输卵管的解剖学、组织学,并介绍输卵管黏膜化生性病变、增生与非典型增生、癌前病变和输卵管病变与腹膜癌、卵巢癌的关系以及这方面的研究进展。
作者简介:
刘爱军,主任医师(副教授),医学博士,硕士生导师,解放军总医院病理科行政副主任,院“百位名医”培养对象,擅长女性生殖系统病理学诊断。
在临床病理诊断工作中,输卵管一直处于微不足道的地位。因为在传统观点上,除了输卵管异位妊娠外,原发于输卵管的其他病变罕见,许多输卵管肿瘤或瘤样病变往往为偶然发现,似乎没有太多临床意义。但近些年的研究表明,输卵管(尤其是伞端)在某些盆腔肿瘤的发生中起着关键作用,因此这一器官受到越来越多的关注。本文从输卵管解剖及组织学谈起,对输卵管黏膜化生、增生与非典型增生、癌前病变及其与盆腔腹膜癌、卵巢癌的关系做一系统介绍。以期使大家能在临床及外检工作中正确认识输卵管病变,并充分重视其临床意义。
1.输卵管解剖与组织学
输卵管起源于副中肾管(Müllerian管),正常情况下位于子宫和卵巢之间的阔韧带内,起于宫角止于卵巢外上方,分为间质部、峡部、壶腹部及漏斗部(包括伞端) 4 部分。间质部与宫腔延续,斜向外上穿行于子宫角; 峡部位于宫角外,长约1 cm,壁厚腔窄; 壶腹部最长(约占输卵管1/2),壁薄弯曲,黏膜皱襞复杂; 漏斗部开口于腹腔,伞端内面纵行黏膜皱襞直接与卵巢密切接触,具有拾卵作用。输卵管黏膜衬覆单层上皮,由纤毛细胞、分泌细胞和插入细胞3种成分构成。最常见的是纤毛细胞,其次是分泌细胞,二者占黏膜上皮>90%。纤毛细胞呈棱柱状(二维切面呈柱状),游离缘具有纤毛; 分泌细胞呈柱状或锥形,游离缘有微绒毛,随月经周期变化而呈现不同程度的分泌; 插入细胞是分泌细胞的变异型,零星散在,细胞核较长,在月经前期和月经期数量增多。分泌细胞和纤毛细胞以不规则的长度交替排列,二者总体没有明显数量差异,免疫组化可清晰地勾勒出二者的成分比例; 分泌细胞bcl-2阳性,p73阴性,而纤毛细胞与之相反。根据在输卵管中的部位、卵巢激素水平和生育年龄,黏膜上皮构成比例有不同变化: 壶腹部纤毛细胞可达60%,峡部约30%; 卵泡期在雌激素作用下纤毛细胞增大增高,分泌细胞随着顶部分泌颗粒的储积也逐渐增高; 而黄体期受孕激素影响,纤毛细胞变短小,分泌细胞突出于表面以顶浆分泌方式释放分泌物后变得矮小,这种变化以漏斗部最为明显。随着年龄的增长,黏膜组织收缩和上皮细胞的复杂性降低,类似于绝经后子宫内膜,黏膜皱襞逐渐变钝。输卵管伞端开放于腹膜腔,其黏膜上皮与腹膜间皮相互移行,而且黏膜上皮与黏膜固有层内淋巴管关系密切。病理人家收集整理
2.输卵管上皮化生与良性增生性病变
输卵管局灶上皮常有黏液上皮化生、宫内膜上皮化生、移行细胞化生,还可有分泌空泡变和嗜酸性变等,但是因这些改变的临床意义一般不大而不被重视,往往被低诊或漏诊。
2. 1 黏液上皮化生 较常见。输卵管上皮被柱状黏液上皮取代,黏液化生可伴发输卵管炎症或其他类型化生,甚至13%~16% 可伴有阑尾黏液性病变,8.7%伴卵巢黏液性病变。输卵管化生灶局限,可有炎性背景,无浸润或异型性,仍属于良性,而非转移性病变。但伴有多部位黏液病变者,可能与P-J综合征有关,有报道称其抑癌基因STK11发生突变。
2. 2 移行细胞化生 主要位于输卵管伞端黏膜上皮与间皮交界部,呈多灶性,平均直径(0.01~2.5px),可与黏液上皮化生伴随发生。位于浆膜面的化生细胞巢也称为Walthard细胞巢,其细胞大小形态一致,可见核沟,无核分裂象,p63强阳性。
2. 3 宫内膜上皮化生 少见。表现为纤毛细胞明显减少,代之以排列较为拥挤的柱状上皮增生,上皮下没有宫内膜间质样细胞,藉此可与内膜异位鉴别。因为宫内膜的上皮也主要由柱状分泌细胞和纤毛细胞构成,只是柱状细胞占比远大于纤毛细胞,所以宫内膜上皮化生与输卵管分泌细胞过度生长(secretorycell outgrowth,SCOUT)不易区分,后者纤毛细胞成分几乎消失。有文献显示,WT1在浆液性肿瘤细胞核呈阳性,但在宫内膜样肿瘤为阴性,可用来鉴别不同上皮分化。
2. 4 妊娠相关变化 包括过度分泌和Arias-Stella(A-S)反应,前者可见核下空泡; 后者似子宫内膜腺上皮的A-S反应,细胞核增大深染、胞质透亮和胞膜清晰。
2. 5 其他上皮类型改变 包括细胞内出现明显的分泌囊泡和胞质嗜酸性变,这些被认为是分泌细胞的“过度浆液性分化”。有报道显示,在输卵管的子宫内膜异位病灶基础上,可发生嗜酸性合体细胞改变。另外,输卵管黏膜内偶见砂砾体钙化,可能是上皮脱落死亡后的继发性改变,这种情况有时与卵巢的交界性浆液性肿瘤伴发。
2. 6 输卵管上皮细胞非典型性 激素水平波动或炎症刺激均可使输卵管上皮细胞核形态发生改变。但这些反应性改变仍然保留细胞极向和纤毛细胞,藉此可与克隆性增生相鉴别。重度急、慢性输卵管炎(包括输卵管结核)可导致上皮旺炽增生,核增大深染,上皮结构紊乱,似筛状生长,增生的上皮甚至可突入黏膜下淋巴管内,与肿瘤非常相似,形成所谓的“假癌性增生”。与癌鉴别的关键是病变的炎症背景显著,大体检查和低倍镜观察无真正的瘤块,而鉴别还需结合病史及影像学检查。
2. 7 输卵管乳头状增生 也称为微小乳头状瘤,特征是黏膜上皮乳头状增生。与黏膜皱襞相比,乳头结构更复杂,管腔内可见离散的小乳头。有文献报道,输卵管乳头状增生可伴发卵巢或盆腹膜交界性浆液性肿瘤,而且输卵管也可单独发生交界性浆液性肿瘤。
3.输卵管癌及其前驱病变
3. 1 输卵管癌的两种临床表型 输卵管癌可分为经典型和伞端型两种表型: 经典型肿瘤主要位于壶腹部管腔内,伞端常粘连闭锁,瘤体通常较大,破坏输卵管肌壁并可扩展到管外。这种类型已被大家熟知,诊断上没有困难和歧义。伞端型是近年提出的类型,肿瘤位于开放的伞端,瘤体虽较小,但易在腹膜和卵巢表面播散种植。因此,伞端型尤其是“早期”输卵管伞端癌,常以“隐匿癌”或“偶发癌”形式被发现,包括以下3种情况: ①按照传统标准诊断为卵巢或腹膜癌手术切除的输卵管中发现微小癌灶;②子宫或卵巢的非上皮性病变或其他原因连带切除的输卵管中,偶然发现输卵管癌灶; ③为减低癌症风险对BRCA基因突变携带者行预防性卵巢输卵管切除术,发现输卵管癌灶。文献证实,如果对输卵管取材更加规范和细致,早期伞端癌检出率可从<2.5%明显升高至17%。
3. 2 浆液性癌的前驱病变 输卵管癌以浆液性癌最为多见,其前驱病变包括输卵管SCOUT和p53印记。这些病变主要位于伞端,少数位于壶腹部。SCOUT定义为>30个分泌上皮连续增生,可呈假复层排列,其免疫组化特征为bcl-2阳性,但p53阴性,Ki-67增殖指数低; 与正常黏膜上皮比较,PAX2表达丢失或降低。这是一种可能具有潜在危险的癌前病变。研究发现,卵巢浆液性上皮性肿瘤(无论分化程度高低)以及卵巢其他非肿瘤病例,采用SEE-FIM(sectioningand extensively examining thefimbriated end)方法对输卵管进行充分取材,均可见SCOUT,但在高级别浆液性癌中更多见,提示SCOUT与高级别浆液性肿瘤有潜在的相关性。p53印记(p53signature)定义为形态上呈良性外观或仅有轻度非典型性的输卵管分泌上皮连续增生,但分子水平上发生了改变的一种病理状态,其免疫组化特征是: Ki-67增殖指数较低(阳性率<20%),但p53和γ-H2AX阳性。γ-H2AX是细胞DNA损伤的标记物。基因测序显示,p53基因突变。因此,p53印记也可理解为“p53阳性的SCOUT”。当p53印记的上皮呈现不典型增生但又不足以诊断上皮内癌时,这种增生性病变尚无统一诊断术语,因为与其他部位(如宫颈)黏膜上皮增生病变相比,输卵管病变发病率较低,对其认识还不够透彻深入,诊断的可重复性比较低,故目前只能采用描述性诊断,如非典型增生。但“非典型性”本身并不反映进展为癌的风险,如前所述,炎症刺激也可导致上皮非典型性。是否可引入“高级别或低级别上皮内瘤变”的概念有待进一步积累资料论证。
3. 3 输卵管上皮内癌 浆液性输卵管上皮内癌(seroustubal intraepithelial carcinoma,STIC)的特征是分泌细胞形态出现显著异型性,核浆比增大,极向消失,细胞核多形性,核分裂象增多,细胞呈复层排列,管腔内易见脱落的上皮团。但是,异型细胞局限于黏膜上皮内,未突破基底膜。免疫组化显示,p53强阳性; Ki-67增殖指数显著增高,至少>40%,一般>70%。输卵管的宫内膜样上皮内癌偶有报道,形态学表现为假复层柱状或立方上皮紧密排列,核浆比较STIC低,p53阴性或弱阳性,Ki-67增殖指数增高(>20%,但一般较STIC低)。该病变有时也可与子宫体的宫内膜样癌伴发,这种情况下,究竟属于单独发生还是源自子宫内膜肿瘤的播散,尚有一定争议。病理人家收集整理
输卵管的黏液性上皮内癌罕见,上皮细胞胞质内充满黏液,与肠型上皮或宫颈内膜上皮相似,细胞核异型性明显,可见核分裂象。但异型上皮局限于黏膜上皮基底膜内,无间质浸润。其免疫组化p16和/或p53阳性,提示与浆液性上皮病变关系密切,或为浆液性上皮的一种化生性改变。有时黏液性上皮内癌与宫颈、宫内膜或卵巢黏液性病变伴发,这种情况可能给判断病变的真正来源带来困扰。
4 输卵管病变与盆腔内浆液性癌
输卵管黏膜上皮从SCOUT到p53印记,再到STIC,最后发展为浸润性浆液性癌,是输卵管黏膜上皮细胞从良性到恶性逐渐演进的过程。“盆腔内浆液性癌”主要指子宫腔外盆腔其他部位(包括输卵管、卵巢及盆腔腹膜)发生的浆液性癌。目前研究表明,相当比例的盆腔内浆液性癌可能源自输卵管伞端黏膜,而非以前认为的起源于卵巢表面生发上皮或腹膜衬覆上皮。生理状态下,暴露于盆、腹腔的输卵管伞端黏膜不但具有强大的舒缩摆动能力,而且与卵巢表面关系密切,以发挥其正常的拾卵功能。伞端黏膜上皮在与卵巢密切接触中可脱落,并异位种植于卵巢表面,尤其在排卵造成的卵巢表面破损修复过程中形成所谓的皮质内上皮包涵囊肿,在此基础上,受多种因素影响,卵巢内可发生浆液性肿瘤; 同样,输卵管伞端黏膜上皮也可脱落种植于盆腔腹膜其他部位,形成输卵管内膜异位或发生浆液性肿瘤。当输卵管黏膜出现病变,特别是发生STIC时,其细胞黏附性明显降低,更易脱落种植,从而播散到卵巢或腹膜,形成盆腔内癌灶。输卵管黏膜分泌上皮病变及其与盆腔内浆液性病变的关系如图1所示。
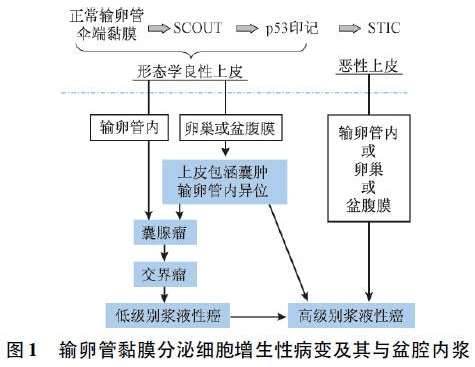
支持这一观点的证据包括: ①卵巢表面和腹膜表面均被覆间皮,由此发生的肿瘤理论上应该为恶性间皮瘤,间皮细胞免疫标记物如calretinin、CK5阳性。而盆腔内浆液性癌与输卵管伞端的黏膜上皮免疫表型一致,CK7、PAX-8和HOXA家族蛋白阳性,但间皮细胞标记阴性。②约25%的卵巢表面或皮质内以及盆腹膜,甚至盆腔内淋巴结,可见输卵管内膜异位灶,在异位的基础上可发生浆液性肿瘤,正如在子宫内膜异位的基础上可发生宫内膜样癌或透明细胞癌一样。③盆腔内浆液性癌与输卵管上皮的p53印记和STIC一样,均显示p53强阳性; 而且,杂合性缺失分析显示伞端病变与盆腔内浆液性癌具有相同的基因异常,表明其共同的组织起源。
至于子宫内膜的浆液性癌,从发病机制来看,大多数源于子宫内膜腺体的异型增生(endometrialglandular dysplasia,EmGD),经过子宫内膜的上皮内癌(endometrial intraepithelial carcinoma,EIC)发展为浸润性癌。如果子宫内膜浆液性癌伴发输卵管癌或STIC,或伴发盆腔内其他部位浆液性病变,则很难判断肿瘤的原发灶和继发灶,尤其是当各个病灶均为高级别时,一般主张以一元论解释; 但是如果各部位病灶均很小或均发现前驱病变时,也可能为多原发性。
5 输卵管病变新认识带给临床实践的影响和思考
首先,输卵管标本病理检查取材应当摒弃传统的“漏斗部、壶腹部及峡部各取一块”的盲目取材方式。即使不能将整条输卵管全部取材包埋,也要采取“伞端全部包埋、壶腹部重点取材”的方式,即SEE-FIM方法。首先自伞端37.5px处离断并纵向剖开漏斗部管腔,平行于管腔方向做连续纵切面并将伞端全部包埋,其余部分垂直于管腔连续横切并重点包埋壶腹部。这种方法可最大限度地减少输卵管病变的漏诊,提高输卵管隐匿癌的检出率。
其次,关于卵巢癌的早期诊断。卵巢癌病死率长期以来居高不下,之所以没有取得突破性进展,关键在于与宫颈癌和乳腺癌不同,卵巢癌一直没有早诊早治的有效筛查手段。目前,卵巢癌检查方法包括盆腔触诊、盆腔超声及CA125检测,前两种方法仅能检查出已达到一定体积的包块,而CA125既不敏感也不特异,所以大部分浆液性卵巢癌一经发现往往已处于晚期。当务之急是建立一套敏感且特异的分子标记或物理检查途径,用于识别可能位于输卵管的癌前病变和微小癌灶,及早干预以达到防微杜渐的目的。病理人家收集整理
再次,关于盆腔内癌的预防。如果输卵管伞端是大多数或全部盆腔内癌的主要起源,在下列情况或许可考虑进行保留卵巢的输卵管切除术: ①卵巢癌高危人群(如BRCA基因异常携带者)进行预防性手术; ②因子宫良性病变而行子宫切除者; ③输卵管结扎者。实际上,已经有观点敦促妇产科输卵管结扎手术或子宫切除时常规切除输卵管,即使不属于卵巢癌高风险人群。当然,若改变手术规范还需要循证医学研究的支持,尽管输卵管、卵巢预防性全切可有效降低卵巢癌的发病率,但是保留卵巢的输卵管单纯切除并不能消除盆腔内可能已存在的异位输卵管黏膜上皮,所以单纯输卵管切除是否可达到既降低盆腔内癌的风险,又不影响生活质量的目的,还需要进一步积累临床证据。
最后,有关卵巢浆液性癌的临床研究。在设立“正常对照”时,宜选取正常输卵管黏膜组织,而非正常卵巢组织,原因是正常卵巢本身并无浆液性上皮,其表面被覆为间皮,皮髓质为大量纤维、血管组织以及各级卵泡成分。若以正常卵巢组织为对照,研究卵巢的浆液性上皮肿瘤则缺乏针对性和可比性。
本文转自《诊断病理学杂志》2014年9月第21卷第9期














共0条评论