作者:马恒辉,周晓军(南京军区南京总医院病理科)
对于石蜡切片而言,组织的固定是组织随后脱水、透明、浸蜡等处理的第一步,也是最重要的一步。包埋操作是否规范对后续组织切片同样具有重要的决定意义。本文就组织固定、处理及包埋常见的问题与对策,进行分析与讨论,旨在与技术人员一起学习交流,以提高组织固定处理及包埋的质量,为组织切片和染色以及病理诊断提供有力的保证。
1、固定
组织固定的目的在于保存组织。组织离体后要尽快地用固定液浸泡,以达到渗透组织的目的,并使组织具有一定的硬度。这样不仅可以防止组织的自溶改变,而且还可以防止组织中的有效成分在后续的一系列处理过程中改变性状。所以,固定标本尤其是固定大块或条索状标本时要尽可能的保持标本正常时的状态,不得发生扭曲。
目前,10%中性缓冲福尔马林是应用最广的常用固定液之一[1,2]。它对大多数的病理标本都具有良好的固定作用,穿透速度快,组织硬化程度小。组织经10%中性缓冲福尔马林固定后,可以保存数月而不会发生不良变化,且细胞核和细胞质的微细部分均保存良好,多数也可进行免疫组化染色(图1~5)。
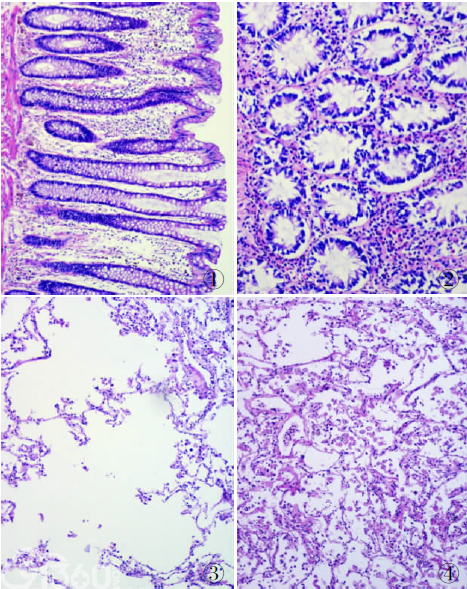
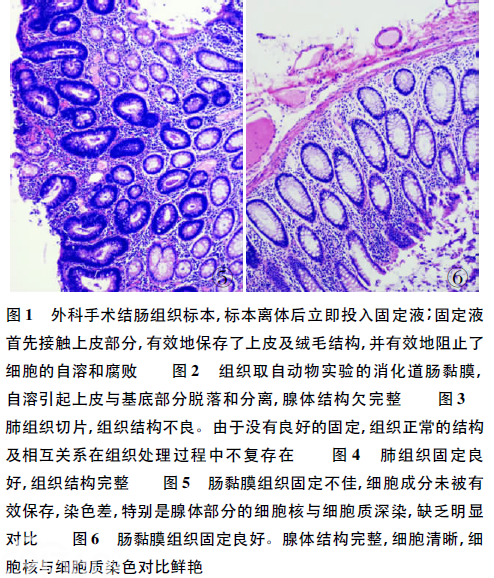
目前,不少科室在使用自动化仪器设备时,因为程序设置不当,标本没有足够的时间在固定液停留,有的甚至用乙醇脱水直接替代了固定步骤,导致组织固定效果不佳。另在戊二醛、Helly、Zenker、Bouin中固定的组织,必须及时取出冲洗,保留在适当的液体中。如果放置时间过长可能会导致固定过度,甚至影响染色[3](图6)。
2、组织处理
组织处理包括三个主要步骤:脱水、透明和浸透,目的在于从组织标本中移去多余的水分,引入一种遇热融化、遇冷凝结的介质(如石蜡),有利于组织切片[4]。
组织处理的方式通常有两种:一种是开放式,即标本从一个液体槽交换转移到另一个液体槽;一种是密闭式,即标本始终停留在一个固定的处理槽内,液体通过真空泵吸进吸出产生运动,从而达到对组织进行处理的目的[1,2]。开放式处理存在着一定的安全隐患,而密闭式处理则相对安全。密闭式通过控制面板的数字按钮,对标本进行电脑智能化控制,标本始终位于一个湿润的环境,即标本处理室内,即使发生故障,也不会发生人为的干燥、干涸现象。另外,配备自动报警装置,减少室内有害液体的直接排放。密闭式的局限性在于,并非所有的液体都能适用于机器。密闭式处理模式能够提供加温、加压及搅拌等多项功能。不过,虽然加温加压及搅拌等功能可以缩短组织标本的处理时间,但是在使用时一定要加以小心。尤其是处理活检小标本时更应如此。如果把富含脂肪的组织与手术标本和活检小标本放在一起混合处理,效果会不理想。反之,如果标本处理时间太短,也不能得到良好的组织处理效果。除非是体积小、固定好的标本,才有可能得到良好的组织处理效果。
无论处理模式是开放还是密闭式,组织处理的过程均应保持清洁,使用的液体应定时更换,保持工作的液面在指定的高度,不得高于或低于标准刻度线。装有标本的包埋盒最好集中整齐放在提篮内,不能随意地放在标本处理室内,以免影响液体与组织之间的正常交换。用于浸透的石蜡温度,最好控制在高于石蜡熔点的2~4℃,并且要每天检查测量并记录温度。防止因温度过高造成组织处理过度,使组织发生硬化或破碎等不良改变。或温度过低,影响组织的浸透效果,使组织切片难以完成。
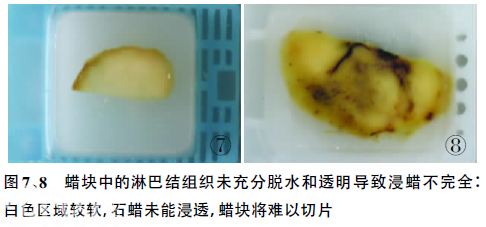
2.1脱水脱水不彻底是组织处理最常见的问题之一。脱水的原理和机制有两方面:一是使用亲水性的试剂,从组织中吸收水分;二是使用溶水性的试剂,不断从组织中溶解组织中的液体。乙醇是常规组织制片最常用的脱水剂,如果时间宽裕,可从低浓度开始多换几次,这样可防止组织脱水过度造成扭曲。如果时间紧凑,可从95%乙醇开始,接着行无水乙醇脱水。通常的方案是从60%~65%乙醇开始,换2次95%乙醇,2次无水乙醇。如果使用的乙醇浓度高于70%,中性缓冲福尔马林中的磷酸盐,将会在组织中沉积,沉积的结晶会妨碍组织切片。所以,组织脱水时应尽量避免在高浓度的乙醇如无水乙醇中停留的时间过长,否则会造成组织过硬、扭曲,影响切片[5](图7、8)。
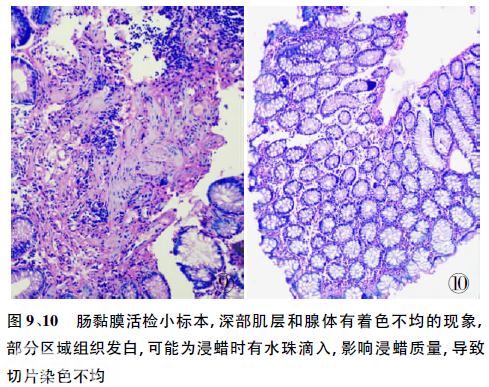
2.2透明切片着色不均多数是因为透明或浸透的蜡液中混有一定的水分。组织开放式处理,空气中湿度较大;组织密闭式处理,固定液中的水分,或加温引起的水珠,滴入液中。这类问题在小标本中比较多见,如皮肤、乳头状瘤、胃、肠黏膜活检等标本[3]。可以改用对水宽容度性大一些的透明剂,如用甲苯替代二甲苯来解决此类问题(图9、10)。
2.3浸蜡真空和加温是现代化组织处理仪器提供的有利条件和手段,但是应该慎用。不少单位在使用现代化的仪器进行组织处理时,因使用的程序不当,标本的处理容易出现过度或不足的现象。根据我科使用的情况,建议推荐使用如下程序,便于大家在设计使用时参考:(1)固定程序2次,固定液为10%中性缓冲福尔马林,时间为45min,设置加温50℃,加压,搅拌。(2)脱水程序8次,前4次为95%乙醇,后4次为100%乙醇,时间均为60min,仅在最后一次的95%和100%乙醇设置加压、搅拌。(3)透明程序2次,第一次为硬脂酸和石蜡,比例为3∶2,第二次为硬脂酸和石蜡,比例为2∶3,时间均为60min,均设置加温65℃,加压,搅拌。(4)浸蜡程序2次,均为56~58℃纯蜡,时间均为60min,设置加温65℃,加压,搅拌。
3、包埋和标本的定位
组织的切片质量好坏、是否利于切片,完全依赖于组织处理的每一个步骤,而每一个步骤的质量又与前一个步骤密切有关。虽然良好的组织切片需要合适的组织固定、准确的组织处理和精致的组织切片保证,但是最容易毁坏组织切片的步骤是不合适的组织包埋,即组织不合适的摆放和不合适的排列方向。因此,组织病理技术人员必须熟悉每一个包埋组织标本的各项元素,认真分析它们的结构,仔细判断它们在包埋模中的位置;多与病理医师沟通,了解组织的性质,对需要标记的组织可用印度墨水进行标记,或在塑料包埋模的边筐上写上记号,以便正确进行包埋操作。
包埋操作时具体的注意事项:先取大小合适的不锈钢模型,注入蜡液置于热台上,液面刚好与模型的上缘平齐,不得低于或高于此限。取出包埋盒内的组织,校对正确后用干净的热镊子将所有组织悉数放入模型的底部,待组织与模型内的蜡液充分融合后,按要求排列后迅速移动模型至冷台,底部石蜡刚开始凝固,用镊子轻压组织数秒,待组织埋平后,迅速盖上包埋盒注上蜡液,10~15s后等包埋盒与模型周边的蜡液凝固时,再次补充注入少许蜡液,以增加包埋盒的稳固性,防止切片时因包埋盒松动引起切片震颤。注意液面高度不得高于包埋盒上缘,加盖包埋盒时一定要保持其与模型底部平面平行,无前后、左右倾斜的现象。用塑料包埋盒包埋组织时,应注意待包埋模型底部石蜡开始凝固后,盖上包埋盒,待其四周凝固后,进行二次加蜡。这样做的目的是使包埋盒与组织蜡块接触更加稳固,减少和防止切片时产生振颤或包埋盒与组织蜡块脱落。另外,还需注意的是二次加蜡不能过满,否则蜡块不能与切片机夹具完全吻合,造成切片时松动震颤,影响切片质量[4](图11~15)。

在组织定位后,石蜡刚开始冷却时,要轻压组织,否则,组织切片就不容易切全,造成切片不完整。硬组织,尤其是脱钙后的骨组织,包埋方向显得尤为重要,否则很难得到一张完整的组织切片。如果沿对角线包埋,情况可能会改善很多,因为切片刀是一点一点地接触到组织,而不是像横过来包埋时,一下子全接触到骨组织。
包埋时最好养成一个良好习惯,打开一个包埋盒,包埋一份组织,包好一个再打开下一个。千万不要同时打开好几个包埋盒,同时包埋,这样容易手忙脚乱,更容易造成组织混淆。每包埋完一个组织,有条件的话更换一把镊子,或者用软布擦拭一下,防止组织尤其是破碎小组织残留造成混淆污染。因为混淆污染是一个严重的问题,极易导致病理医师的错误诊断。
石蜡组织包埋后,蜡块要尽快冷却,形成蜡块最小的结晶体,既减少石蜡的疏松,又增加石蜡的密度。小的结晶体有助于使石蜡紧紧包裹被包埋的组织,为良好切片提供有利保证,如果包埋后石蜡与组织分离,留有间隙,切片就难以完整。
建立包埋的质控,每天记录包埋蜡块总数,核对每个包埋盒内组织块数。总的蜡块数与切片数,在染色结束后应该核对一下,切片与对应号码的蜡块进行比较:检查是否一致,有无差错,是否切全,有无遗漏,标签是否有误等。此为检查最重要的步骤,工作中不可或缺。
组织的定位或方向是包埋的重要步骤,否则,不恰当的组织定位或排列方向会导致切片时毁坏组织。许多组织大而平,易于包埋定位,只要将最大最平的组织面朝下置于包埋模即可。特殊需要的组织面可用墨汁标记,以便包埋时准确定位(图16~20)。

以下蜡块显示的是多块组织不正确的包埋。这种类型的包埋使得切片比较困难,不利于将组织同时切全,容易给病理医师阅读切片时造成遗漏或忽略观察组织的机会(图21~23)。







免疫组化染色免疫组化染色免疫组化染色免疫组化染色免疫组化染色免疫组化染色免疫组化染色免疫组化染色免疫组化染色
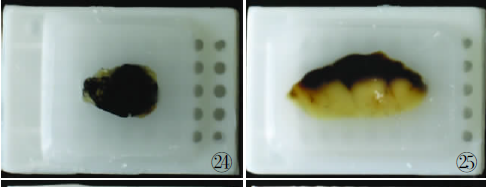
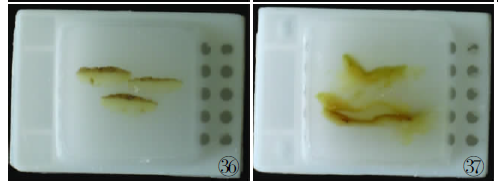
圆形、椭圆形及方形、四边形等组织正确的包埋模式见图24~29,不正确的包埋模式见图30~32。阑尾等腔性组织或囊壁样组织的正确包埋模式见图33、34。皮肤组织正确的包埋模式见图35、36。胆囊等胃肠黏膜的正确包埋模式见图37。
图34囊壁样组织以横切面竖立方向包埋为准,切片时能切到组织全层图35、36表皮层方向朝下,真皮层方向朝上,组织切片时不易损
伤组织,保证切片完整,减少切片的裂隙图37在一张切片上同时观察多部位的黏膜组织,可以将2到3块组织叠放在1个蜡块内,并保证每块组织面的方向一致
参考文献:
[1]BancroftJD.Theoryandpracticeofhistologicaltechniques[M]。London:Churchilllivingstone,2008:53-74.
[2]CarsonFL.Histotechnology.Aself-instructionaltext[M]。Chicago:AmericanSocietyofClinicalPathologistsPress,2009:4-44.
[3]马恒辉,周晓军。HE染色常见问题与对策[J]。临床与实验病理学杂志,2008,24(4):478-81.
[4]马恒辉,周晓军。如何提高组织处理的技术水平[J]。临床与实验病理学杂志,2011,27(4):415-8.
[5]马恒辉,周晓军。组织切片常见问题与对策[J]。临床与实验病理学杂志,2009,25(2):211-4.




























共0条评论