细胞块 - 从最小的侵入性方法获取最大的信息
Susan D. Rollins, MD, Donna K. Russell, CT (ASCP) CAP TODAY August-2017
翻译:王巍伟 审阅:杨怀涛 赵澄泉
足够量和高质量细胞块的制备是对细胞学涂片及细胞学印片的一种很有用的辅助材料。足够量的细胞块让我们有进行辅助的研究,提供特异性诊断并且为靶向治疗方案提供必要的信息。大多数细胞学样本都可以制备细胞块,例如:细针穿刺(FNA)、体腔液、冲洗液、刷取物及妇科和非妇科液基细胞学样本。
细针穿刺样本的现场快速评估有助于最佳样本的采集和标本分流研究。在进行快速评估时,与以患者为中心的手术团队通力合作有助于手术方案的确定及患者预后的改善。专门留取细针穿刺的材料以备制备细胞块有助于获得高质量的细胞块的制备。单纯性细针穿刺样本冲洗是一种次佳细胞块制备方法。获取足够细胞块样本可以进行其他一些辅助性研究,例如:免疫细胞化学染色、荧光原位杂交(FISH)、以及其他一些可以在细胞学样本中进行的分子学研究。这些研究通常有助于对病变进行明确分类和确定治疗方案。与外科手术获取活检样本的额外花费相比,细针穿刺及细胞块制备不仅创伤较小,而且花费低。在保存原始涂片的同时,细胞块也可以存档,用于后续的诊断和研究。另外一点好处是,新兴微波处理技术可以用于小的活检组织和细胞块,并且可以缩短加急病理病例的的周转时间。
不同的细胞块制备方法需要使用不同的介质进行冲洗、转移和固定样本。使用盐水和RPMI(Roswell Park Memorial Institute)液处理的样本对于将来辅助性研究具有更多的选择性(例如:流式细胞术)。液基细胞学介质(例如:那些用于储存宫颈细胞学和尿液样本的介质)中含有酒精(甲醇或乙醇)。如果细胞来源于乙醇固定直接涂片,那么在细胞块制备步骤之前,细胞块标本就有可能与酒精接触。
中性福尔马林缓冲液是最常使用的固定剂。其他固定剂包括福尔马林/95%酒精冲洗以及Nathan酒精福尔马林替代品(9份 100 %已醇/1份 40%福尔马林),后者是一种毒性较小的固定剂。甲醇是Cellient自动化细胞块技术的样本固定剂。许多辅助性检测平台使用福尔马林固定、石蜡包埋组织,并且已经验证了其有效性。假阴性免疫细胞化学染色结果可以发生于非福尔马林固定样本,这是由于其抗原性发生了改变。用于免疫细胞化学和分子技术的酒精固定和福尔马林固定细胞块需要实验室验证。Varghese等进行了一项验证性研究(文章发表于《Modern Pathology》),该研究比较了免疫细胞化学染色结果(来源于细胞块)和免疫组织化学染色结果(来源于相对应的外科手术样本组织)。该研究包括41例样本,对其进行118种染色并设立足够的对照。细胞块染色模式与外科手术样本组织染色模式一致的有113种染色,一致率为95.7%。
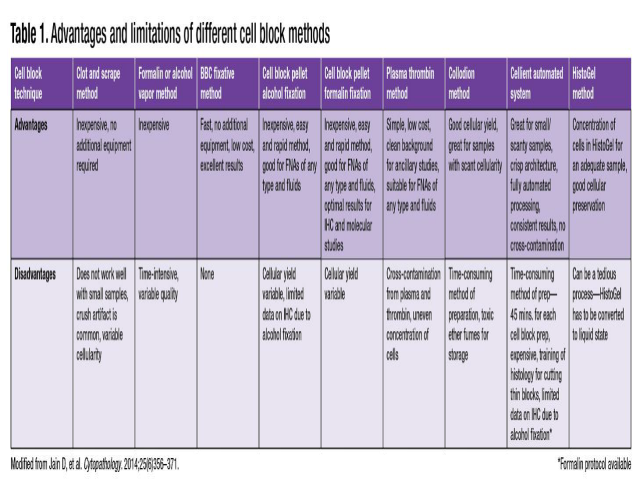
一些实验室采用不同的细胞块制备方法,从技术含量较低的“低廉蒸汽固定法”到技术含量较高的Cellient自动化细胞块技术不等。一些细胞块的制备方法描述如下,不同制备方法的优缺点如表1所示。当实验室决定采用哪种细胞块制备方法时,必须考虑到实验室资源、样本数量、样本类型以及工作流程。
各种各样的细胞块制备方法如下。所有的包埋盒以及锥形离心管均应按照实验室的规程进行标识。
(1)凝结、剥除法(Clot and scrape method)
通过将细针穿刺样本放至玻片的方法可以获取细胞块。样本放置至玻片后使其干燥或凝结;然后,将样本从玻片上剥除并且用纸巾包裹。将其置于组织包埋盒及中性福尔马林缓冲液中,然后在组织学实验室进行常规处理。
(2)BBC 细胞块固定法(BBC cell block fixative method)
将穿刺针中的样本冲洗置于含有1ML BBC Cyto-CellBlock Fix的非涂层试管中。将试管倒置于合适的滤纸上。待液体排净后,刮取滤纸上的细胞样本使其集中于小的区域。然后,该样本在组织学实验室进行常规处理。
(3)血浆凝血酶细胞块制备(Plasma thrombin cell block preparation)
这是最常使用的细胞块制备方法。将添加血浆和凝血酶将细胞样本植入凝块中(图1),然后离心将离心物制作成细胞块。
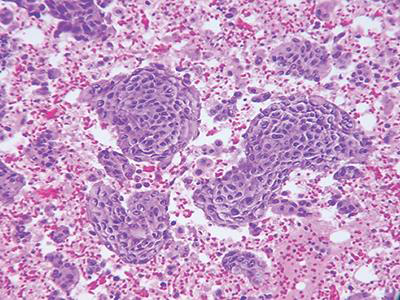
图1 血浆凝血酶细胞块制备,苏木素-伊红(HE)染色,20X。
将20ml样本加入离心管,1650rpm离心10分钟。离心后,将上清液轻轻倒出。在沉淀和简单涡旋中加入0.5 mL血浆和两滴3%水溶性伊红。然后,加入0.25-0.5ml重组凝血酶,快速震荡搅拌溶液。30-60秒后形成凝块。将凝块置于贴有标识的包埋盒后于福尔马林中固定。然后,该样本在组织学实验室进行常规处理。
(4)火棉胶袋细胞块制备(Collodion bag cell block procedure)
该方法将细胞集中于火棉胶袋内,进而制备出细胞更加充足的细胞块(图2、3)。
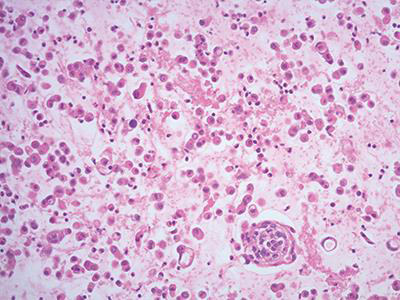
图2 火棉胶袋细胞块制备,苏木素-伊红(HE)染色,20X。

图3 火棉胶袋细胞块制备,苏木素-伊红(HE)染色,20X。
[制备火棉胶袋试管] 将火棉胶试剂倒入15ml玻璃管并且填充至顶部。火棉胶在玻璃管中放置10-15分钟。将火棉胶倒入试剂瓶,倒出同时不断旋转玻璃管。将玻璃管倒置于试管架中,让其静置约30分钟直至干燥。干燥后,玻璃管中填满蒸馏水。如果这个袋子没有充分干燥,那么该玻璃管会呈不透明状, 此时其不能使用,应该予以丢弃。使用之前倒出蒸馏水。火棉胶袋最多可以保存一个星期。
[制备火棉胶袋细胞块] 使用移液管将样本转移至火棉胶袋。含有火棉胶袋的玻璃管内的一部分液体2500rpm离心10分钟。仔细移除上清液。使用镊子聚集位于玻璃管边上的火胶棉袋的边缘。用镊子把袋子从玻璃管中取出,用棉线在小球上方将其系住。用剪刀剪去多余的火棉胶袋及棉线。将剩余的袋子置于组织包埋盒,将包埋盒置于填满10%中性福尔马林缓冲液的标本杯中。然后,该样本在组织学实验室进行常规处理。
(5)Shandon Cytoblock 法
该技术是一种人工细胞块制备方法。该方法使用细胞块包埋盒和试剂(试剂盒自带)在Thermo Shandon Cytospin中进行细胞离心分离,使得细胞得以浓缩。将细胞块包埋盒置于中性福尔马林缓冲液。然后,该样本在组织学实验室进行常规处理。
这种技术取代了耗时且昂贵的琼脂和凝血酶技术,并且组织学处理过程中要求使用无磷固定剂(例如:Zinc Formal-Fixx、Formal-Fixx或 Glyo-Fixx),或者简单跳过处理步骤中的福尔马林固定步骤。细胞块也可以用于快速活检项目。
(6)Cellient 自动化细胞块系统(Cellient automated cell block system)
该技术通常用于含有小的组织碎片的样本,并且由液态制剂瓶制备。这是第一个完全自动化细胞块系统(图4)。
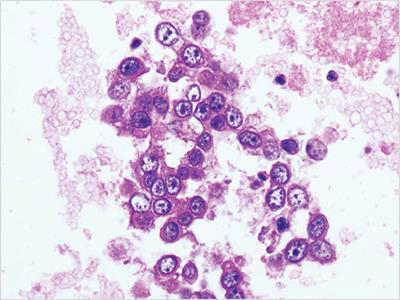
图4 Cellient自动化细胞块系统制备。腹水制备,腺癌,苏木素-伊红(HE)染色,20X。
样本在60ml试剂瓶中2400rpm离心5分钟。样本沉淀,倒出上清液。将三滴细胞沉淀物添加到PreservCyt小瓶中进行固定。将含有样本的小瓶放入Cellient自动化细胞块系统进行处理。每个蜡块的平均制备时间为45分钟。然后,该样本在组织学实验室进行常规处理。
(7)HistoGel 法
该技术用于单个分散细胞为主的细胞学样本。操作流程中包括将细胞沿着平行于细胞块切沿的平面浓缩的步骤。该方法可以用于宫颈ThinPreps样本(通常细胞量较少且可能仅含有少量单个散在的异常细胞)细胞块制备。
样本3000rpm离心5分钟。倒出上清液,沉积物留于管中。将HistoGel(HG)置于微波炉中等功率下加热5到15秒,使其溶化为液态。离心管中加入足够的HG覆盖沉积物(约0.5 mL),并与沉积物混合。使HG凝固(室温下2 - 3分钟;如果使用冷却块则更快)。通过从离心管一侧注射10%中性福尔马林缓冲液将固化HG沉淀物从离心管底部取出。 移出沉淀物细胞块置于贴有标识包埋盒内的滤纸中,包裹好放入福尔马林中固定。然后,该样本在组织学实验室进行常规处理。
细胞块石蜡切片时应格外小心,因为组织碎片可能正好位于蜡块表面。
(8)组织凝结块法(Tissue coagulum clot method)
该方法使得样本在细针穿刺针尖端的腔内形成凝块。然后,直接将凝块转移至福尔马林中固定。这种技术可以防止诊断性样本的丢失。
采用组织凝结块方法制备细胞块时,使用穿刺针盒内的导线芯将21号/22号细胞穿刺针内的样本轻轻推出,而非使用注射器将样本排出到盐水中进行细胞块制备。当样本位于穿刺针尖端时,使针尖指向一个方向在预切滤纸上做紧密圆周运动,将样本转移至滤纸上并且形成一个由组织和血液混合构成的锥形凝块。凝块在滤纸上轻微风干,主要是为了确保凝结物为固态且细胞成分在液态介质中不会分散。使用纸巾将样本包裹后放入包埋盒,置于福尔马林容器。然后,该样本在组织学实验室进行常规处理。
(9)福尔马林或酒精蒸汽法(Formalin or alcohol vapor method)
样本采用福尔马林或酒精蒸汽固定。该方法不需要任何辅助设备,并且试剂需要量最少。从细针穿刺装置中排出所需样本,使其在普通标本容器盖内部形成凝块。翻转容器盖,并将一团纸巾放置于容器底部。将2ml福尔马林加于容器并渗透到纸巾中。
如果使用酒精,将两个异丙醇棉签置于容器底部。
容器在室温下至少需要倒置6小时。所需时间过后,福尔马林或酒精已经将样本固定为固体。通过添加福尔马林破坏样本与容器盖之间的吸力,将其从容器盖取下。该样本一从容器盖取下后就应该立即置于包埋盒并且放入福尔马林中。然后,该样本在组织学实验室进行常规处理。
(10)细胞球或细胞碎片的细胞块技术-方法1(使用95%酒精)
该方法常用酒精对样本进行离心,而样本处于防腐性酒精基础性介质中。
在50ml锥形离心管上标记该患者多方面个体识别标记。在含有样本且带有标识的锥形离心管加入95%酒精至50ml。如果需要,储存一部分样本用于辅助性检测。使用固定剂(95%酒精)或保存介质(例如:CytoLyt)对样本进行离心10分钟(2500rpm)。移除上清液,完全剩下中心样本(确定是否需要进行第二次离心来溶解明显的血液成分或质硬/紧密的细胞颗粒)。样本中加入一部分95%酒精,充分混匀,再次离心。将酒精完全移除。
此时,根据细胞球的大小,可以选择最合适的方法。如果细胞块非常小,和/或沉淀物不足或挤压不好,则使用另外一种技术(例如:HistoGel or agar)。
用抹刀将细胞球从锥形管中取出;必要情况下,将其与硬币宽度相匹配。将其置于组织包埋盒。将一块中间带孔的海绵置于贴有标识的组织包埋盒中。大的、凝固很好的细胞球可能不需要海绵。
将一块大小合适的镜头纸置于蓝色海绵上方。将细胞块置于包埋盒中心镜头纸上方。将第二块镜头纸以45度角置于细胞块上方。将中间带孔的第二块海绵置于第二块镜头纸上方。将包埋盒盖子安全扣合到位后置于福尔马林。然后,该样本在组织学实验室进行常规处理。
(11)细胞球或细胞碎片的细胞块技术-方法2 (Cell block technique for cell pellet or tissue fragments—method No. 2)
该方法使用盐水、RPMI或福尔马林收集样本,经常用于细胞块制备(图5、6)。
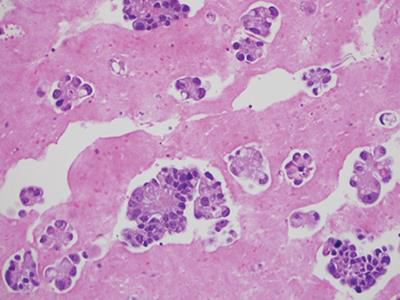
图5细胞球或组织碎片之细胞块技术-方法2(使用盐水、RPMI或福尔马林收集),苏木素-伊红(HE)染色,20X。
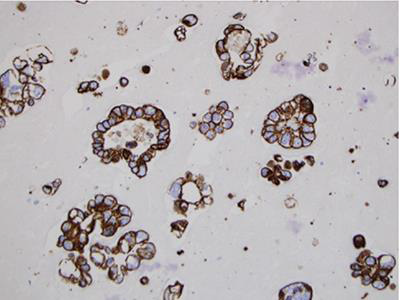
图6 细胞球或组织碎片之细胞块技术-方法2。MOC31免疫组化染色,20X。
将样本转移至50毫升锥形离心管并且标记患者多方面个体识别标记。2400rpm离心5分钟,使细胞聚集形成细胞“纽扣”。倒出上清液。这个细胞“纽扣”可能不具有内聚性,上清液被倒出时其可能会开始脱落。如果发生这种情况,可以加入中性福尔马林缓冲液帮助固定标本。混合后应静置30-60分钟使样本凝固。然后,用金属刮刀使得变硬的细胞“纽扣”边缘松动,直至其从离心管脱落。将细胞“纽扣”置于中性福尔马林缓冲液浸透的纸巾上。从细胞“纽扣”周围折叠纸巾并置于组织包埋盒。
所有步骤完成后,包埋盒及其内部样本置于装满中性福尔马林缓冲液的标本杯中(应该完全没过包埋盒)。样本至少需要固定30分钟或更长时间。然后,该样本在组织学实验室进行常规处理。
如果细胞块非常小,和/或沉淀物不足或挤压不好,则使用另外一种技术(例如:HistoGel or agar)。大的、凝固很好的细胞球可能不需要海绵。
点击下载英文版文献
[参考文献]
1、Castro-Villabon D, Avello Y, Ruiz N, Rodriguez-Urrego PA. Implementation of routine thromboplastin-plasma cell block technique in the evaluation of non-gynecologic specimens. J Microscopy Ultrastructure. 2014;2:177–181.
2、Gill GW. Cell block preparation. In: Cytopreparation: Principles and Practice, Essentials in Cytopathology. New York, NY: Springer-Verlag; 2013.
3、Jain D, Mathur SR, Iyer VK. Cell blocks in cytopathology: a review of preparative methods, utility in diagnosis and role in ancillary studies. Cytopathology. 2014;25(6):356–371.
4、Khan S, Omar T, Michelow P. Effectiveness of the cell block technique in diagnostic cytopathology. J Cytol. 2012; 29(3):177–182.
5、Kulkarni MB, Desai SB, Ajit D, Chinoy RF. Utility of the thromboplastin-plasma cell-block technique for fine-needle aspiration and serous effusions. Diagn Cytopathol. 2009;37(2):86–90.
6、Mayall F, Chang B, Darlington A. A review of 50 consecutive cytology cell block preparations in a large general hospital. J Clin Pathol. 1997;50(12):985–990.
7、Mayall F, Darlington A. The poor man’s cell block. J Clin Pathol. 2010;63(9):837–838.
8、Nathan NA, Narayan E, Smith MM, Horn MJ. Cell block cytology. Improved preparation and its efficacy in diagnostic cytology. Am J Clin Pathol. 2000;114(4):599–606.
9、Varsegi GM, Shidham V. Cell block preparation from cytology specimen with predominance of individually scattered cells. J Vis Exp. 2009;29:e1316.
10、Varghese S, Martin A, Russell D, McMahon L, Fiscella J. Comparison of immunohistochemistry staining performed on cell blocks versus surgical blocks from the same tumor. Mod Pathol. 2017;30(S2):520A–521A.
11、Wagner DG, Russell DK, Benson JM, Schneider AE, Hoda RS, Bonfiglio TA. Cellient automated cell block versus traditional cell block preparation: a comparison of morphologic features and immunohistochemical staining. Diagn Cytopathol. 2011;39(10):730–736.
12、Yung RC, Otell S, Illei P, et al. Improvement of cellularity on cell block preparations using the so-called tissue coagulum clot method during endobronchial ultrasound-guided transbronchial fine-needle aspiration. Cancer Cytopathol. 2012;120(3):185–195.
13、Zanchelli-Astran G, Wood M, Bibbo M. Making the diagnosis with only two levels of nongynecologic cell blocks as opposed to three is more cost effective. Diagn Cytopathol. 2010;38(5):374–376.




















共0条评论