作者:吴永芳,许春伟,张博,李晓兵(军事医学科学院附属医院病理科)魏建国(浙江省绍兴市人民医院病理科)
[摘要]
目的:探讨乳腺非霍奇金淋巴瘤的临床及病理特点,减少误诊误治。
方法:对所获军事医学科学院附属医院病理科诊断为乳腺非霍奇金淋巴瘤1例病例的临床及病理资料进行回顾性分析。结果:本例主因发现双乳肿物一月余,行抗炎治疗后肿物无明显变化,临床以双乳肿物,初步考虑“乳腺癌”收入院。
入院后行PET-CT及腹部CT发现:除了双乳高代谢肿物外,还可见腹盆腔、右肾、右侧髂肌及左侧肛提肌外旁等多发占位,病理穿刺结果开始考虑为乳腺低分化癌并多发转移,后经过免疫组织化学证实为乳腺非霍奇金T细胞性淋巴瘤,类型为ALK阴性的间变性大细胞淋巴瘤。
结论:乳腺非霍奇金淋巴瘤临床及病理类型少见,易误诊为低分化癌,应加强对乳腺淋巴瘤的临床及病理学特征的认识并仔细分析病情,以避免或减少误诊误治。
乳腺非霍奇金淋巴瘤非常少见,而间变性大细胞淋巴瘤(anaplastic large cell lymphoma,ALCL)是NHL一种比较少见的亚型[1]。其细胞表面表达Ki-1(CD30)抗原,又称Ki-1阳性大细胞淋巴瘤。为避免临床及病理医生将乳腺间变性大细胞淋巴瘤误诊为低分化乳腺癌,提高对间变性大细胞淋巴瘤的认识,我们回顾性对所获军事医学科学院附属医院病理科诊断为间变性大细胞淋巴瘤一例病例进行分析,探讨间变性大细胞淋巴瘤的疾病特点:如临床病理学特点及免疫组织化学特点,易误诊为低分化癌的原因及防范措施。
1 、临床资料
患者,男,60岁,主因“发现双乳肿物1月余”就诊。患者1月前无意间于右乳乳头下方触及一肿物,大小约1.0cm ×1.0cm,质硬,活动度差,边界不清,间断出现刺痛。半个月前行乳腺彩超示:右侧乳头处混杂回声团,考虑炎症所致,左侧乳腺局限性增厚。患者遂口服头孢克肟3d,右乳肿物无明显变化。同时触及左乳乳头下一肿物,大小约1.0cm ×1.0cm,质硬,活动度差。后给予青霉素和左氧氟沙星抗炎治疗4d,双乳肿物无明显变化。为进一步诊治入院,就诊于我院,门诊以双乳肿物,初步考虑“乳腺癌”,收入我院,查体:双乳不对称,右侧乳头周围可见一大小约1.0cm ×1.0cm的破溃区,右乳乳晕处可触及一大小约2.0cm ×2.0cm大小肿物,质硬,活动度差,边界欠清;左乳乳晕处可触及一1.5cm ×1.5cm肿物,质硬,活动度差,边界尚清,双侧腋窝和锁骨上未触及肿大淋巴结。入院后2d行腹部CT示:腹腔、右侧髂肌及右肾多发占位,考虑恶性,以淋巴瘤可能性大,邻近胃壁、肠管浸润不除外,不完全排除转移性病变,需结合临床,穿刺活检。PET-CT示:右乳内高代谢肿物、左乳稍高代谢软组织影,腹盆腔、右侧髂肌及左侧肛提肌外旁多发高代谢软组织肿物,胃窦及部分结肠受侵可能,以上符合恶性肿瘤表现,乳癌多发转移入院后3和8d后行超声引导下行右乳头后方低回声实性占位及腹腔占位病变穿刺活检术。术后活检小标本送病理检查,标本经4%中性甲醛液固定,常规脱水,石蜡包埋,切片厚4μm,常规HE染色,光镜观察。疫组织化学采用EnVision法。所用一抗CD2、CD3、CD4、CD5、CD7、CD8、CD15、CD20、CD30、TIA-1、Granzyme B、ALK、Ki-67、PAX-5、CK、EMA及EnVision试剂盒购自北京中杉金桥生物技术有限公司。操作步骤严格按试剂盒说明书进行。
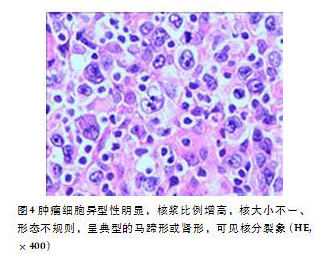
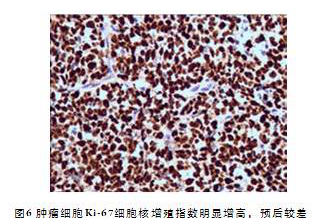
病理检查巨检:(左乳3针)送检灰白色穿刺组织3针,长1.0~1.2cm,全包。(右乳2针)送检灰白色穿刺组织2针,长0.6、1.0cm,全包。镜检:低倍镜下可见肿瘤细胞呈片状及散在分布,部分区域纤维组织增生(图1-2);高倍镜下肿瘤细胞体大,细胞质丰富,核卵圆形或多不规则,可见“肾形”或“马蹄”样核,有的可见核仁,核分裂象较多见(图3-4);免疫组织化学:免疫组织化学染色显示肿瘤细胞:(左乳3针、右乳2针)CD20(-)、CD3(+)、CD5(+)、CD7(散在+)、CK(-)、EMA(-)、CD30(+)、ALK(-)、CD15(-)、CD2(+)、CD4(+)、CD5(+)、CD8(散在+)、Granzyme B(-)、PAX-5(-)、TIA-1(散在+)、Ki-67 (index约90%)(图5-6);病理诊断:非霍奇金T细胞性淋巴瘤,类型为ALK阴性的间变性大细胞淋巴瘤。临床诊断:非霍奇金淋巴瘤(T细胞性)IVA期,IPI3分。入院5、27d后行EPOCH方案(依托泊苷0.07mg d1~4、长春新碱0.5mg d1~4、吡柔比星14mg d1~4、环磷酰胺1200mg d6、强的松100mg d1~5)化疗2周期,患者双乳肿物明显减小,未再出现疾病进展,目前患者准备进入EPOCH方案化疗第3周期,密切随访中。




2 、讨论
间变性大细胞淋巴瘤(ALCL)是一种非霍奇金T细胞淋巴瘤,非常少见,约占非霍奇金淋巴瘤的2%~8%,属于侵袭性淋巴瘤[1]。发生于乳腺的间变性大细胞淋巴瘤则更加少见。Stein等[2]最初于1985年对其命名为间变性大细胞淋巴瘤报告为Ki-1表达阳性的多形性或组织细胞样淋巴瘤,并作为一种独立的疾病被认识,并描述了其组织学特征。间变性大细胞淋巴瘤的临床表现多样,大多数患者初诊时多为III或IV期,典型症状为出现外周和/或腹腔淋巴结肿大,且常有全身症状,尤其是高热。40%以上患者可有结外病变,结外病变主要累及皮肤,其次是骨、软组织、肺、肝和胃肠道。国外[3]曾报告身体其他少见部位如膀胱、肌肉等受累。Savage等的研究[4]显示,ALK阳性和ALK阴性发生结外侵犯的概率相似。骨髓、骨骼、皮下组织和脾脏侵犯更常发生在ALK阳性间变性大细胞淋巴瘤,而皮肤、肝脏、胃肠道侵犯更常见于ALK阴性间变性大细胞淋巴瘤。病变初期骨髓通常不受累。合并外周血和骨髓广泛受累的间变性大细胞淋巴瘤可称为“白血病阶段”的间变性大细胞淋巴瘤,其发病率低,但无论ALK表达与否预后均较差[5]。病理组织学及免疫组织化学特点:间变性大细胞淋巴瘤是一种T细胞淋巴瘤,主要由形态上类似于霍奇金细胞、CD30弥漫阳性的大型淋巴细胞单一性增生构成的肿瘤。肿瘤细胞弥漫分布,排列疏密不一,形态多样。肿瘤细胞体积较大,异型性明显,呈圆形或多边形,胞质丰富、透明、嗜酸性或嗜碱性,可见核周空晕和淡染的高尔基体区。细胞核大、多型性,常呈马蹄形、肾形、圆形、卵圆形、胚胎样、分叶状或不规则形。可有双核、多核、胚胎样和镜影样细胞核,少数瘤细胞可变异,与纤维母细胞样形态类似[6]。染色质呈粗颗粒状或为弥漫细颗粒状,有多个小的、嗜碱性核仁,由大细胞组成的病例,核仁更明显,但嗜酸性核仁很少见。核分裂象较多。肿瘤细胞虽然具有广阔的形态学谱,但几乎所有的肿瘤组织中均具有多少不等的特征性肿瘤细胞(标志性细胞),包括不等量的怪异核、马蹄铁或肾形核,伴有核旁嗜酸性区域的细胞。这些细胞被认为是标记性细胞,因为这些细胞可出现在各种变异型中。肿瘤细胞有成巢和淋巴窦内生长为特点,倾向T区分布,常有滤泡残留,并可混有不同比例的中性粒细胞、嗜酸粒细胞、淋巴细胞及组织细胞等。瘤细胞间含有多量网状纤维和小血管。依据组织形态不同,间变性大细胞淋巴瘤可被分为普通型、淋巴组织细胞型、小细胞型及霍奇金样型等[7]。在间变性大细胞淋巴瘤的病理诊断中,肿瘤细胞一般表达T细胞标记及ALK、TIA-1、EMA,其中ALK和CD30起着决定性的作用。ALK阴性时CD30弥漫强阳性是诊断的要点。CD30通常表现为肿瘤细胞膜和高尔基体区域强阳性。ALK蛋白为t(2;5)基因易位产生的名为NPM-ALK(或p80)的80 kd的嵌合蛋白,可引起细胞恶性转化,在间变性大细胞淋巴瘤中阳性率约为60%~85%,是作为间变性大细胞淋巴瘤发病的重要分子机制[8]。
乳腺低分化癌形态学特点与间变性大细胞淋巴瘤不易区分,低分化癌通常癌细胞异型性较大,散在弥漫分布或由黏着的癌细胞团组成,缺乏混合性的炎症性背景;有时可有特征性的上皮样结构,如腺样分化、角化、乳头状或成巢等特点,而间变性大细胞淋巴瘤可出现特征性的马蹄形核、肾形核等。低分化癌免疫组织化学染色显示CK和EMA呈阳性,CD30、LCA等阴性,而间变性大细胞淋巴瘤则相反。
本例患者肿瘤细胞大小不一,分化很差,无明显组织学结构,形态学与低分化癌相似,病理医生极易误诊为低分化癌,但仔细观察可见较多间变性大细胞淋巴瘤的标志性细胞,如细胞核呈马蹄形核、肾形核,经过免疫组织化学染色证实CK、EMA为阴性,CD30及T细胞标记物为阳性,ALK阴性,诊断为ALK阴性的间变性大细胞淋巴瘤。
乳腺非霍奇金淋巴瘤发病早期临床症状多不典型,无特异性表现,常需经过病理穿刺活检或肿物切除后根据其形态学及免疫组织化学染色结果方可排除乳腺低分化癌的诊断。本例患者首先以双乳肿物就诊,临床极易误诊为低分化乳腺癌,而病理医生容易受临床医生的干扰,再加上形态学上与低分化癌很难区别,从而导致病理医生亦很容易误诊为低分化癌。
具体防范措施如下:
1)临床及病理医生应该加强对乳腺非霍奇金淋巴瘤的认识,不要盲目的以为乳腺内的高代谢肿物即为低分化乳腺癌,需警惕乳腺淋巴瘤的可能。
2)全面系统有针对性的进行各种影像学检查,本例患者入院后及时行腹部CT及PET-CT发现:除了双乳高代谢肿物外,还可见腹盆腔、右肾、右侧髂肌及左侧肛提肌外旁等多发占位,结合影像学检查,避免了临床医生只单独考虑双乳肿物而误诊为乳腺癌之可能。
3)开阔诊断思维,尤其是病理医生不要受临床医生的干扰信息,把所有可能的病理类型根据形态学都考虑进去,通过免疫组织化学染色进一步进行验证,最终得出正确的诊断,以利于临床医生更好的开展诊治工作。
参考文献:(略)



















共0条评论