作者:北京协和医院病理科 周炜洵
炎症性肠病(IBD)是一组病因尚不十分清楚的肠道慢性非特异性炎症性疾病,主要包括溃疡型结肠炎(UC)和克罗恩病(CD),近年来已成为我国消化系统常见疾病。本文结合《中国炎症性肠病组织病理诊断共识意见》,以2例实际病例为基础,介绍病理在IBD诊断中的作用。
病例1:千头万绪寻CD
病历摘要:患者女性,24岁,5年前因急性阑尾炎在外院行阑尾切除术,术后恢复良好。后于劳累、寒冷及情绪激动后出现腹痛,多为脐周及右下腹绞痛,排便后可缓解。排便2~3次/天,为黄色成形便及稀便交替,无黑便、便血、黏液脓血便等。发病后伴反复口腔溃疡,2~3月1次,无发热、盗汗、消瘦。间断于外院就诊,考虑阑尾残株炎可能。自行服中药治疗,效果欠佳。
4月前于外院行结肠钡灌肠造影示:回盲部管腔不规则变窄,见充盈缺损。结肠镜示:升结肠近回盲部环周不规则溃疡增生性病灶,表面结节样隆起,局部管腔狭窄。病理示:(升结肠近回盲部)黏膜慢性炎伴急性炎,肉芽组织增生,炎性坏死渗出,固有层淋巴组织增生。未予特殊诊治。
1月前患者腹痛程度加重,伴右下腹压痛、低热(37.5℃)、食欲下降、嗳气,排便1~2次/天,较前变细。于我院门诊查血沉(ESR)为31mm/h。盆腔增强CT及小肠CT重建示盲肠及阑尾结构显示不清,末段回肠至升结肠形态异常,考虑炎性改变;小肠未见明显异常。予患者加用美沙拉嗪缓释颗粒剂1g,tid治疗,症状未完全缓解。
3天前患者腹痛加重,视觉模拟评分(VAS)>8分,伴进食后呕吐胃内容物。1天前患者排暗红色血便3次,无头晕、心慌、乏力,为求进一步诊治入院。
诊断过程:患者入院后,考虑其为青年女性,以慢性腹痛、下消化道出血为主要临床表现,伴有低热、口腔溃疡,肠镜示回盲部不规则溃疡及管腔狭窄,诊断考虑CD。但患者有低热,回盲部病灶有增生性表现,表面结节样隆起,不能除外肠结核的诊断。且患者起病后伴有反复口腔溃疡,还须警惕白塞病的可能。
患者入院后再次出现活动性出血,肠腔狭窄,复查肠镜溃疡较重,遂行手术治疗并明确诊断。
术后标本大体病理:切除回盲部肠管,小肠长17cm,结肠长4cm,末段回肠近回盲瓣处可见深大溃疡4cm×3cm,形态不规则,底面不平,周围见息肉样隆起,切面局部肠壁增厚,质较硬韧。肠管迂曲,浆膜面互相粘连。
CD大体病理表现:节段性病变,病变与正常段肠管界限清楚,常见肠壁增厚,浆膜面渗出粘连。典型的CD溃疡为线性纵行溃疡,易出现瘘管。
讨论:本例标本以深大溃疡为主要表现,肠壁增厚,浆膜面粘连,符合CD表现,但并不能除外结核或血运异常导致的溃疡。
术后标本镜下病理:较深大溃疡深及肌层,局灶见裂隙状溃疡(图1)。溃疡边界与周围黏膜分界清楚,周围黏膜固有层内淋巴细胞、浆细胞、中性粒细胞浸润,隐窝结构紊乱呈分枝状(图2)。黏膜下层增宽、水肿,散在淋巴细胞浸润,并见多灶性淋巴滤泡形成(图3)。肌层内散在淋巴细胞、浆细胞浸润,浆膜面多灶淋巴滤泡形成。近溃疡处肠壁纤维组织增生,肠壁增厚,黏膜下层及肌层内神经组织增生(图4)。未见肉芽肿表现。
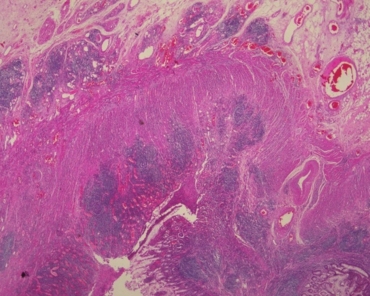
图1溃疡深及肌层,局灶见裂隙状溃疡;肠壁全层炎细胞浸润,黏膜下层及浆膜面淋巴滤泡形成
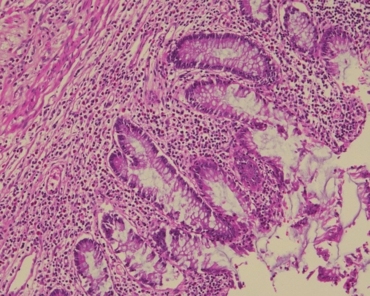
图2黏膜固有层内淋巴细胞、浆细胞、中性粒细胞浸润,隐窝结构紊乱,杯状细胞数目尚正常
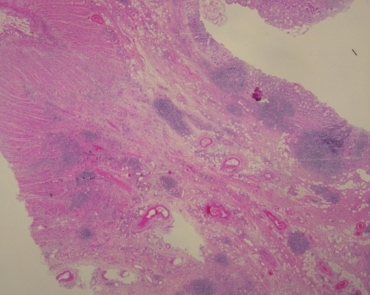
图3黏膜下层增宽,多灶性淋巴滤泡形成
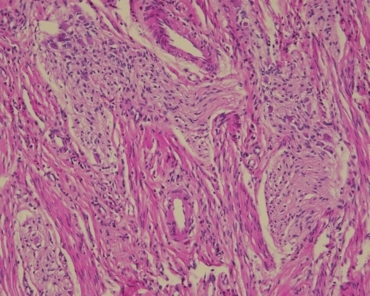
图4黏膜下层及肌层内明显增生的神经组织
CD镜下病理表现:常见全壁炎和全壁淋巴滤泡形成,溃疡较深,特别是可以出现狭窄深凿的裂隙状溃疡。黏膜下层增宽,可因水肿或纤维组织增生所致。神经组织增生和神经节炎也是常见的表现。此外,相对比较特征性的是出现非干酪性肉芽肿,微小无坏死,孤立无融合。
讨论:本例标本镜下表现比较典型,除肉芽肿外的几个形态学特点都具备,所以CD诊断较明确。
小结:
本例患者慢性腹痛、下消化道出血、回盲部病变,临床首先考虑CD。但因其有低热、口腔溃疡等表现,难以完全除外肠结核、白塞病等疾病。这些慢性炎症性疾病均在回盲部好发,临床表现甚至病理表现又有很多交叉点,诊断常常非常困难。病理表现,特别是手术标本的病理检查,可以直观地反映病变表现,在IBD的诊断中占有重要的地位。
本病例即是经手术切除标本的病理明确了诊断,为临床进一步治疗打好了基础,同时患者入院后进一步完善其他检查也帮助除外了结核和白塞病。
结核病变以坏死和干酪性肉芽肿为特点,在本例中没有发现,结合患者入院后的影像学检查和T细胞斑点试验(T-spot)均未发现支持结核的证据,因此可排除结核诊断。而白塞病的诊断则更多依赖临床资料,虽然其本质是血管炎,但常常难以找到。本例患者经进一步眼科检查及详细体检、免疫学检查除外了此诊断。
在日常工作中总有一些病例,即使是手术切除标本也没有特异的病理表现,难以确诊。综合临床、影像、病理等全面信息,多科协作,才是做出正确诊断的最有效办法。
病例2:抽丝剥茧现UC
病历摘要:患者男性,55岁,17年前因恶心、呕吐伴腰痛,于外院检查发现腹主动脉、腹腔干旁多发肿大淋巴结,剖腹探查术后经病理确诊为霍奇金淋巴瘤(混合细胞型,Ⅲ期),行化疗及生物治疗后肿大淋巴结消退,病情平稳,长期无症状。
1年前患者出现黏液及暗红色血便,4~5天1次。半年前开始便次增多,排稀糊便4~5次/日,内有黏液及暗红色凝血。外院予甲泼尼龙40mg及抗感染治疗无明显效果。
盆腔CT及小肠CT重建示:升结肠、结肠肝曲、横结肠、乙状结肠及直肠壁颗粒样增厚,浆膜面渗出样改变,周围血管、腹膜后、肠系膜根部多发淋巴结肿大,考虑霍奇金淋巴瘤结肠、直肠受累可能。
结肠镜示:结直肠黏膜弥漫性充血、水肿,血管纹理消失,自发及接触性出血明显,乙状结肠全程多发多形性溃疡,直肠病变相对较轻。
乙状结肠活检病理示:炎性渗出物,肉芽组织,黏膜急慢性炎,可见隐窝炎及隐窝脓肿。予氢化可的松100mg,q12h静脉滴注7天后改为泼尼松50mg,qd口服,患者体温逐渐恢复正常,腹痛消失,便次及黏液和血逐渐减少。
诊断过程:患者17年前明确霍奇金淋巴瘤病史,CT示结直肠多发肠壁增厚、浆膜面毛糙渗出、淋巴结肿大,都支持淋巴瘤浸润结直肠的可能。同时,溃疡性结肠炎(UC)主要表现为腹泻、黏液血便,结肠镜下可见黏膜连续病变,病理可存在隐窝炎、隐窝脓肿,均与本例患者表现相符。但UC很少会累及结肠浆膜面导致渗出。此外,某些病毒感染如巨细胞病毒(CMV)等也可能造成腹泻、便血,患者有肿瘤基础疾病,长期应用糖皮质激素,不能除外这种可能性。
进一步予患者复查肠镜示乙状结肠黏膜弥漫充血,可见形态不一溃疡形成,部分黏膜呈镂空样改变,直肠黏膜基本光滑。考虑黏膜多发镂空样改变,直肠无明显病变,不支持UC表现,淋巴瘤累及可能性较大,但反复取活检没有淋巴瘤的证据,诊断难以明确。
在此基础上,患者及家属积极要求手术以明确诊断及切除病灶,遂行手术切除全结肠、直肠大部。
术后标本大体病理:切除全结肠、部分直肠共长81cm,距两断端约6cm处黏膜肉眼观大致正常。中间部分远侧段约30cm可见弥漫性黏膜糜烂,呈暗褐色,部分黏膜脱失;可见假息肉样物数十枚,布满肠腔。中间部分近侧段约30cm黏膜广泛水肿,呈灰粉色,布满较小假息肉样结构。病变与较正常黏膜界限较清楚。
UC大体病理表现:弥漫性和连续性慢性炎症,主要累及直肠并向近端连续性分布,黏膜呈暗红色颗粒状表现,广泛分布大小不等的浅溃疡,并且易见假息肉。实际病例会因其发病阶段、治疗程度不同而有不同表现。
讨论:本例标本暗褐色区为比较典型的活动性病变,表现为广泛出血及溃疡。其近侧水肿区则为病变相对较轻的区域,体现出UC远侧重、近侧轻的分布特点。但本例直肠区炎症较轻,可能与其已经经过一段时间治疗有关,不要误以为“节段性”病变而与CD混淆。
术后标本镜下病理:暗褐色病变区黏膜及黏膜下层广泛充血、出血,固有层弥漫中性粒细胞、淋巴细胞及浆细胞浸润,易见隐窝炎及隐窝脓肿(图5),隐窝被破坏或呈分支等紊乱结构(图6)。弥漫溃疡形成,黏膜破坏脱失,伴多量炎性息肉形成(图7)。病变严重区淋巴细胞、浆细胞浸润累及表浅肌层(图8),但多数肌层炎症较轻(图6)。水肿区无弥漫溃疡,黏膜水肿,大量炎细胞浸润,隐窝结构紊乱,炎性息肉形成。通观标本未见异型淋巴细胞,可排除淋巴瘤的诊断。
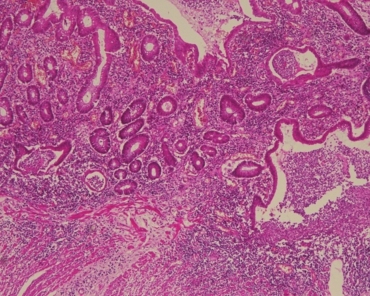
图5黏膜固有层弥漫中性粒细胞、淋巴细胞及浆细胞浸润,可见隐窝炎及隐窝脓肿
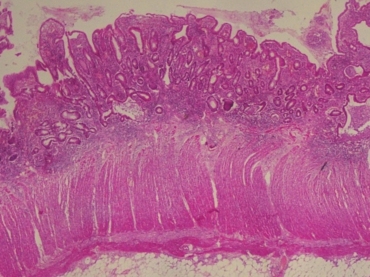
图6黏膜弥漫炎症,隐窝结构紊乱呈分枝状;肌层炎症不明显
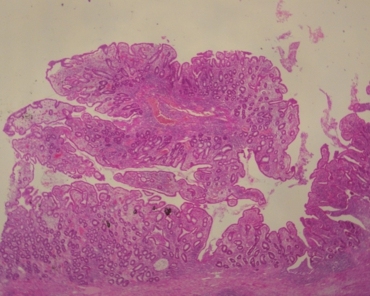
图7炎性息肉形成
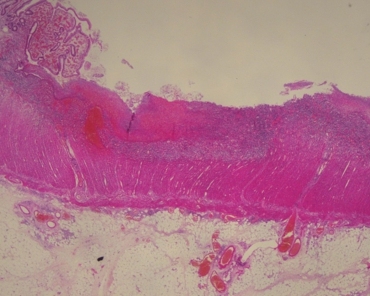
图8病变严重区黏膜破坏脱失,淋巴细胞、浆细胞浸润累及表浅肌层
UC镜下病理表现:以黏膜、黏膜下层炎症及表浅溃疡为特点,炎症为弥漫性、透黏膜性分布,包括急、慢性炎细胞弥漫浸润固有层、基底浆细胞增多、隐窝结构紊乱。活动期易见隐窝炎及隐窝脓肿。随着炎症的持续时间增长,容易出现炎性息肉。炎症及溃疡限于黏膜肌与黏膜下层,肌层及浆膜一般不受累。
讨论:本例标本的黏膜炎症表现比较典型,为诊断的主要依据。但须注意的是,病变较重的区域溃疡连续成片,炎症可以累及肌层,造成类似“全壁炎”的表现,可能会与CD混淆,诊断时要注意综合黏膜、分布等表现综合判断。
小结:
炎症性肠病(IBD)的诊断是一种排除性诊断,观察病变时需要警惕肿瘤、感染等病因并仔细寻找。例如本例患者,有霍奇金淋巴瘤病史,临床难以鉴别是否为淋巴瘤累及肠道,就需要仔细观察以排除淋巴瘤。
在实际工作中,淋巴瘤肠道累及可表现为弥漫性病变,并致肠壁增厚、溃疡、出现息肉样结构,都难以在肉眼观察时与IBD鉴别。此外,一些感染性疾病不仅可以出现溃疡等难以鉴别的表现,还可在IBD的基础上合并感染,给诊断带来困难。因此在诊断时须想到这些可能原因,仔细观察,排除明确病因后诊断。同时,详细的临床病史和实验室、影像学检查结果在IBD的诊断过程中也是必不可少的。





















共0条评论