一、概述
淋巴瘤是临床上诊断难度较大的一类疾病,需要综合血液病理学(包括组织和细胞形态学、免疫表型、遗传学和分子生物学)与临床特征才能做出精确诊断。流式细胞学(flow cytometry,FCM)免疫分型作为与免疫组织化学相补的诊断方法,以其快速、客观、定量及多参数分析等独特优势,在淋巴瘤诊断方面发挥着不可替代的作用[1,2]。为了提高淋巴瘤的诊断和治疗监测水平,规范我国对此类疾病的诊治程序,中国抗癌协会血液肿瘤专业委员会组织国内相关的流式、血液肿瘤和病理专家经过多次讨论,结合国外已有文献资料和国内临床经验,制订了流式检测技术在淋巴瘤诊断中应用的专家共识。本共识旨在推动流式检测技术在淋巴瘤诊疗中的应用,促进多学科合作在淋巴瘤诊疗中的发展。由于目前FCM对霍奇金淋巴瘤诊断价值有限,本文内容仅涉及FCM在非霍奇金淋巴瘤(non-Hodgkin lymphomas,NHL)中的应用。
二、FCM在淋巴瘤诊断中的地位与作用
FCM在淋巴瘤诊断中的作用主要分为三个方面:确定诊断、辅助诊断和微小残留病(minimal residual disease,MRD)检测。
1.可以明确淋巴瘤诊断:
主要见于具有特征表型并常以白血病形式存在的淋巴瘤类型,如急性淋巴细胞白血病/淋巴母细胞淋巴瘤(ALL/LBL)、慢性淋巴细胞白血病/小淋巴细胞淋巴瘤(CLL/SLL)、毛细胞白血病(HCL)、浆细胞肿瘤(PCN)、T大颗粒淋巴细胞白血病(T-LGLL)、NK细胞-慢性淋巴增殖性疾病(NK-CLPD)、成人T细胞白血病/淋巴瘤(ATLL)等。
2.作为淋巴瘤辅助诊断:
主要是指免疫表型不具有特异性,或具有特定遗传学异常的淋巴瘤类型,FCM可以作为形态学、遗传学的重要补充,起到辅助诊断的作用,常见的有:边缘区淋巴瘤(MZL)、滤泡淋巴瘤(FL)、幼淋巴细胞白血病(PLL)、套细胞淋巴瘤(MCL)、淋巴浆细胞淋巴瘤/华氏巨球蛋白血症(LPL/WM)、Burkitt淋巴瘤(BL)、肝脾T细胞淋巴瘤(HSTCL)、蕈样霉菌病/Sezary综合征、非特指型外周T细胞淋巴瘤(PTCL,NOS)和血管免疫母细胞T细胞淋巴瘤(AITL)。FCM在大B细胞淋巴瘤中的诊断作用有限,对于有骨髓或淋巴结等组织/器官受累者有一定的参考价值。
3.MRD监测:
多参数FCM在CLL/SLL的MRD检测中已得到广泛地应用和认可,其次是套细胞淋巴瘤和毛细胞白血病,在其他类型淋巴瘤中的应用则少见报道。虽然PCR技术被认为是监测淋巴瘤MRD最敏感的指标,但随着八色以上FCM的临床应用,同时以10-4作为cut-off值时,FCM和PCR技术可以相互补充。
三、FCM检测流程与方法
(一)样本处理与准备
1.样本来源及制备:
FCM样本主要来源于骨髓、外周血、淋巴结、细针穿刺等细胞学样本和来源于淋巴结、结外器官或组织的新鲜组织学样本以及脑脊液、胸腹水等体液标本。所有样本处理的原则是获得细胞产量最大化的单细胞悬液,同时保持细胞的活性和完整性,防止目标细胞丢失。骨髓、外周血标本为天然单细胞悬液,抽取标本置于抗凝管中(肝素或EDTA),室温保存,尽可能12 h内处理标本。若标本放置时间>12 h,应选择肝素抗凝。组织学样本离体后立即置于磷酸盐缓冲液(PBS)、RPMI 1640培养液等运输介质或用生理盐水浸湿的消毒纱布包裹,在送往实验室的整个过程中需保持其湿度,尽快送检,长途运输建议使用RPMI 1640培养液保存。运输中可加冰袋,但需避免样本与冰袋直接接触。样本应尽量立即处理,将组织沿最大面剖开,肉眼观察标本是否有结节、溶血或坏死。通常部分标本用于组织学诊断,部分标本做流式细胞学及分子病理检测。为了防止肿瘤局灶性分布带来的漏诊,可将样本多点分割,每份厚度2~3 mm,送流式检测的样本应紧邻组织学部分,手动研磨或匀浆机将组织分散成单个核细胞,过滤后进行抗体标记[3,4]。
2.细胞存活率检测及细胞采集数:
检测前需做细胞存活率评估,通常采用着色DNA的荧光染料(如碘化丙啶和台盼蓝),可穿过死细胞膜进入内部而染色,需要注意的是,这些染料能和固定后的细胞染色,因此细胞存活率检测必须采用未做固定的样本。采集的目的细胞总数应达到5 000个以上,特殊情况也应尽量达到1 500个[3]。
(二)NHL免疫表型特点
FCM诊断NHL涉及B细胞、T细胞和NK细胞的相关系列抗体,这些抗体不仅可用于细胞表型检测,还可以对细胞克隆性及细胞功能进行鉴别。只有熟练掌握血细胞发育各个阶段,以及病理和生理情况下可能出现的表型特征(包括细胞大小、颗粒性、胞膜和胞质抗原的表达),才能做到精确诊断。
1.B细胞淋巴瘤:
正常成熟的循环B细胞表达CD19、CD20、CD79b、CD22、FMC7和膜表面免疫球蛋白(surface immunoglobulin,sIg)。sIg的轻链kappa(sIgκ)和lambda(sIgλ)比值在1∶3和3∶1之间。在B细胞的成熟过程中,末端脱氧核苷酸转移酶(TdT)、CD34、CD10等不成熟标志逐渐消失,胞质Ig重链重排时出现CD79a和PAX5表达,CD20在Ig轻链重排时才开始表达,且表达强度逐步增强。正常B细胞成熟过程中抗原的表达增强、减弱或消失多呈渐进性,而肿瘤细胞抗原表达多为均质性增强或减弱[5]。
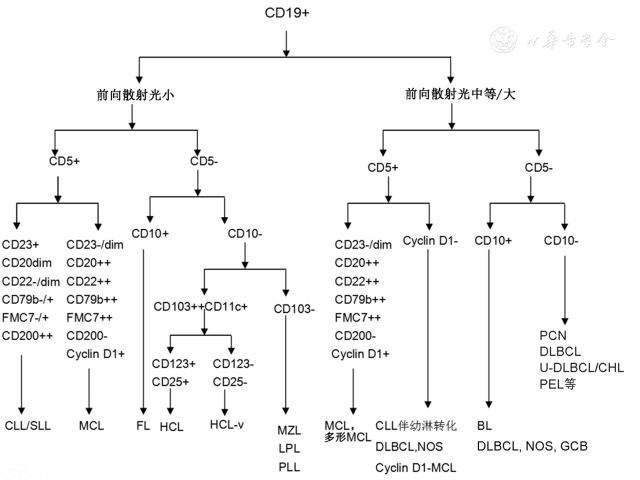
(1)免疫表型特点:大多数成熟B细胞淋巴瘤为表达成熟B细胞标志物(CD19、CD20和CD22等)的单克隆B细胞,某些类型淋巴瘤具有独特的免疫学特征,结合前向散射光(FSC)和CD5、CD10等抗原的表达特征可以对成熟B细胞淋巴瘤进行进一步区分归类。对于大部分小B细胞淋巴瘤,FCM结合遗传学结果可以做出分型诊断,具体可参见中国B细胞慢性淋巴增殖性疾病诊断专家共识(2014年版) [6],对于组织样本活检考虑为惰性小B细胞肿瘤伴明显浆细胞分化,并涉及与浆细胞肿瘤鉴别的病例,可行病变部位穿刺及FCM检查,有助于明确淋巴瘤的具体类型。而大B细胞淋巴瘤由于累及部位所限以及样本制备中的细胞破坏,则更多依赖免疫组织化学的方法确诊[2,7]。常见的成熟B细胞淋巴瘤免疫表型鉴别诊断见图1。
(2)克隆性检测:绝大多数成熟B细胞肿瘤限制性表达sIg轻链κ或λ(κ∶λ>3∶1或<1∶3)。检测中如果其他表型正常,但不表达sIg,建议进一步行胞质轻链检测,因后者仍可能出现限制性表达,只有少数成熟B细胞肿瘤可同时有胞膜和胞质的轻链表达缺失现象。几乎所有的浆细胞肿瘤都限制性表达胞质轻链,通过透膜方法检测胞质轻链可以确定克隆性,仅有极少数病例胞质、胞膜可同时表达或缺失轻链。另外生发中心B细胞可以出现膜表面轻链表达下调。
2.T细胞淋巴瘤:
T细胞占外周血淋巴细胞的60%~70%,在胸腺中分化发育,成熟过程中CD34、TdT、CD99和CD1a等抗原消失,出现T细胞受体(TCR)基因重排,并最终与膜CD3形成复合物。αβ和γδT细胞在胸腺发育早期出现分化,绝大多数(>95%)循环中的T细胞为TCRαβ型。γδT细胞主要分布在脾脏红髓、呼吸道和肠道的黏膜和皮下组织内。正常外周血CD4/CD8比值约为2∶1,骨髓中则相反,约为1∶2,正常成熟T细胞表达CD2、CD3、CD5和CD7,表达CD4或CD8,在外周血中CD4、CD8双阳性和CD4、CD8双阴性细胞比例极低。
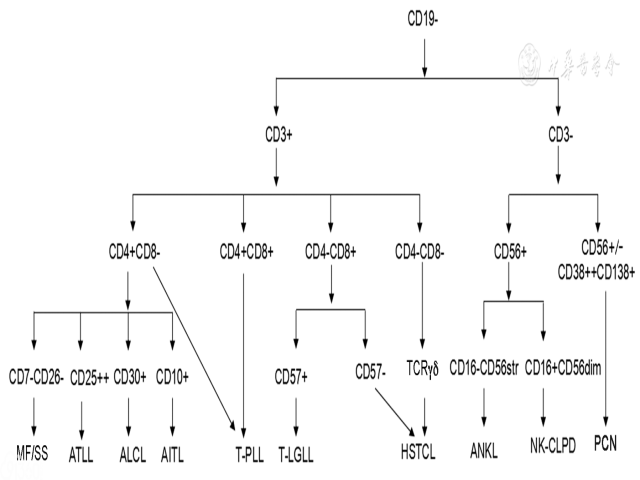
(1)免疫表型特点:以下表型时提示有T细胞淋巴瘤的风险:
①CD4∶CD8比值失衡,大于10∶1或小于1∶10;
②CD4+CD8+或CD4-CD8-比例增高;
③泛T抗原表达异常,最常见CD7、CD5、CD2或CD3抗原表达强度减弱或增强;
④淋巴细胞群中CD16、CD25、CD56、CD57、CD279等抗原表达增多;
⑤伴异常抗原表达(如CD30、CD10、CD20、CD103、CD13和CD33等)。
需要注意的是部分样本中由于肿瘤细胞比例较低而被反应性T细胞掩盖,此时可结合某些标志物的减弱或增强,通过多参数设门进行分析判断。由于良性增生的T细胞也会出现某些抗原表达强度改变,因此不能根据单一异常线索直接诊断为淋巴瘤。对于外周T细胞淋巴瘤及淋巴组织增生性疾病的诊断与分型,主要依靠活检、免疫组织化学染色及TCR基因重排检测,单纯靠FCM表型分析能确诊的类型较为有限(图2)[2,8]。
(2)克隆性检测:70%的αβT细胞可以通过FCM检测TCRvβ的24种表位鉴定其克隆性,出现其中1种TCRvβ抗原的显著增高或者24种表位总和的显著减低提示T细胞的克隆性增生。由于某些免疫反应中也会出现T细胞的克隆性增生,即使FCM检测到克隆性T细胞存在,也要结合临床确定其是否为肿瘤性。如有疑虑,可以通过PCR的方法检测TCR基因重排来提高检出的敏感度和特异性[8]。
3.NK细胞淋巴瘤:
正常NK细胞表达CD2和CD7,部分表达CD8,不表达sCD3、CD5、CD4和TCR,NK细胞特征性地表达CD16、CD56、CD94、CD161和颗粒酶B(granzyme B),或多或少表达CD57和CD8dim,活化的NK细胞在胞质中表达CD3的ε和ζ链,FCM检测结果为sCD3-,cCD3(ε/ζ)+。外周血中存在两个NK细胞亚群,绝大多数为CD56dimCD16+NK细胞,是具有杀伤功能的成熟NK细胞,少数为CD16-CD56strNK细胞,主要分泌细胞因子。
(1)免疫表型特点:通常为sCD3-CD5-伴有NK细胞标志物(CD16、CD56和CD57)的表达,部分可出现CD2和CD7表达减弱或缺失,少数病例可获得CD5的表达。侵袭性NK细胞与EB病毒感染高度相关,白血病表型多为CD3-CD16-CD56str,而NK-CLPD的细胞表型为CD3-CD56dimCD16+,表型更为成熟;结外鼻型NK/T淋巴细胞淋巴瘤(ENTCL)典型表型为sCD3-cCD3±CD2+CD56+,其他NK相关抗原通常为阴性。常见的T/NK细胞淋巴瘤见图2。
(2)克隆性检测:临床工作中通常选择CD158a/h,CD158b、CD158e、CD158k和CD158i等KIR系列抗体用于NK细胞克隆性检测,但目前市面上的抗体仅能覆盖部分CD158抗原簇[8]。与T细胞淋巴瘤类似,FCM检测到NK细胞克隆性并不意味着绝对恶性,需要结合临床背景包括是否有EB病毒感染等进行综合分析。
(三)抗体筛选
1.NHL诊断:
为了尽可能地优化抗体和样本用量及对不同亚型淋巴瘤的精确诊断,临床检测中通常采用两步法:先应用一线抗体确定肿瘤属性和系别,随后应用二线抗体进行精准分型。在具体抗体选择方面,可参考国际认可的标准化方案或专家共识(如Euroflow、ICCS)中推荐的荧光染料和克隆号,例如检测cCD3应选择克隆号为UCHT1能识别CD3T1链的单抗,检测核TdT(NuTdT)可选择克隆号为HT-6兔抗人的FITC标记的多克隆抗体。细胞内抗原检测优先选择小分子荧光素如FITC。B系一线初筛的抗体包括:CD5、CD10、CD19、CD20、CD45、κ和λ;T/NK系一线初筛抗体包括CD2、CD3、CD4、CD5、CD7、CD8、CD45和CD56。确定为肿瘤细胞及其系别来源以后,进行第二步全面精细检测。用于B细胞淋巴瘤精细分型的二线抗体有:CD11c、CD22、CD23、CD25、CD38、CD43、CD79b、CD103、FMC7、bcl-2、cκ、cλ;T/NK细胞淋巴瘤的二线抗体有:cCD3、CD10、CD16、CD25、CD26、CD30、CD57、TCRαβ、TCRγδ、颗粒酶B、穿孔素(perforin)和cTIA-1等[9]。
近年来发现一些新的抗体在淋巴瘤诊断及分型中具有重要价值,已经陆续作为二线抗体应用于临床,其中B系相关的有CD49d、CD52、CD81、CD123、CD160、CD200;T/NK系相关的有CD279(PD1)、CD94、CD161和CD158(KIR)系列抗原[10]。
2.MRD检测:
较为成熟的FCM-MRD检测方案主要集中于B细胞淋巴瘤,由于T/NK细胞淋巴瘤病例往往缺乏明确的克隆性依据,FCM对T/NK细胞淋巴瘤的MRD检测尚不成熟,能用FCM进行MRD检测的标本主要为骨髓、外周血和脑脊液。
(1)慢性淋巴细胞白血病MRD:ERIC(European Research Initiative on CLL)分别于2007年、2013年和2016年推荐了慢性淋巴细胞白血病MRD检测的四色、六色和八色标准化方案[11,12,13]。相对正常B淋巴细胞而言,慢性淋巴细胞白血病细胞除表达CD5外,CD20、CD22、CD79b、CD81表达可见明显下调或消失,而CD43高表达。根据这些免疫表型特点,利用八色单管方案:CD19/CD20/CD5/CD43/CD79b/CD81/CD22/CD3,获取白细胞总数达2×106时,检测灵敏度可达10-5。
(2)其他类型淋巴瘤MRD:80%~90%的套细胞淋巴瘤患者初发时可见骨髓或外周血浸润,这部分患者可以进行FCM-MRD检测。正常B淋巴细胞表达LAIR-1(CD305)、CD11a、CD62L、CD200,而套细胞淋巴瘤的肿瘤细胞不表达或明显低表达上述抗原,利用这些免疫表型特征可以很好地检测套细胞淋巴瘤MRD。(CD3/CD14/CD56)/LAIR-1/CD19/CD5/CD11a/sIgλ/sIgκ/CD45检测方案灵敏度可达10-4,其中CD3/CD14/CD56用以排除正常T、NK细胞以及单核细胞的干扰;CD3/CD5/CD19/CD20/CD23/CD45/CD62L/CD200检测方案灵敏度可达2×10-4。典型毛细胞白血病的肿瘤细胞则过表达CD19、CD20、CD22和LAIR-1,同时表达CD11c、CD25、CD103和CD123,利用CD3/CD19/CD20/CD25/CD45/CD103/CD123/LAIR-1抗体组合检测MRD的灵敏度也可达到10-4,并且与PCR技术有很好的一致性[14,15,16]。由于骨髓/外周血浸润率低,其他类型淋巴瘤的MRD检测少见报道。理论上只要初发时在骨髓或外周血中能检出肿瘤细胞,并且具有淋巴瘤相关免疫表型,均可利用FCM技术进行MRD检测。值得注意的是,CD20等单克隆抗体在治疗中的应用,很可能会给FCM-MRD检测技术带来假阴性结果,数据分析时应紧密结合临床。
(四)结果分析与报告
CD45/SSC设门应用最为广泛,CD19(CD20)/SSC或CD19(CD20)/CD45设门主要针对B细胞白血病/淋巴瘤,但利妥昔单抗治疗后不宜采用CD20设门;(m/cCD3)/SSC或(m/cCD3)/CD45设门主要用于T细胞白血病/淋巴瘤。NK/T细胞淋巴瘤容易丢失某一种或者多种标志,加上经常存在正常淋巴细胞干扰,设门较为困难,建议先从T和NK标记中选择2个以上参数设门,再进行后续抗原检测。
报告中除患者的个人信息、标本类型、送检日期、报告者署名及日期等一般资料外,还应详细描述淋巴瘤细胞的比例、散射光特征、系别、成熟度以及不同抗原的表达特征(增强、减弱、是否缺失以及异常获得等),同时可以显示正常值范围,避免仅对结果进行简单的描述,尽可能给出可能的诊断以指导临床进一步综合判断。如果没有检测到异常细胞,可直接报告各类细胞所占比例。需要注意的是FCM的阴性结果并不能除外骨髓有淋巴瘤浸润;如果FCM检测到单克隆淋巴细胞但缺乏形态学证据,需要在报告中注明,必要时考虑再次行活检,并建议随访[9,17,18]。
四、质量控制
FCM质量控制主要涉及样本、仪器、试剂、人员等。与NHL诊断相关的需注意以下几个方面:
(1)用于实体瘤FCM检测的样本应为具有代表性的活检样本的部分,以防止因采样误差而导致与形态学结果的不一致;
(2)为防止目的细胞丢失,细胞学样本不推荐使用淋巴细胞分层液分离单个核细胞;
(3)组织学样本如红细胞较多,需加入少量肝素抗凝剂,但不可用甲醛或其他固定剂固定;
(4)样本处理过程中应采用溶血剂处理红细胞,氯化铵溶血法适用于骨髓和外周血,而组织学标本尽可能使用甲酸溶血法;
(5)检测B细胞sIg或轻链时,染色前需要洗涤2~3遍;
(6)在轻链检测时如采用一种单抗检测结果为阴性时,需更换克隆号复测,或采用多克隆抗体标记以明确为真阴性[3,19]。
以临床为基础的多学科综合诊断治疗是淋巴瘤诊治未来发展的方向。本共识综合阐述了FCM在淋巴瘤诊断及疾病跟踪监测中的应用,包括方案设计、质量控制以及MRD检测等内容,希望能对淋巴瘤临床和病理工作起到补充作用,未来将结合临床和病理的发展,不断完善该共识。
参与编写专家组成员(按单位名称汉语拼音字母顺序排列):
北京大学肿瘤医院淋巴肿瘤内科(谢彦、朱军);复旦大学附属肿瘤医院病理科(平波);华中科技大学同济医学院附属同济医院血液内科(毛霞、周剑峰);南京医科大学第一附属医院血液科(李建勇、吴雨洁、徐卫);上海交通大学附属瑞金医院血液学研究所(翁香琴);四川大学华西医院病理科(步宏、刘卫平、赵莎);中国医学科学院北京协和医学院北京协和医院病理科(卢朝辉);中国医学科学院血液病医院病理中心(汝昆、王慧君),淋巴肿瘤中心(邱录贵);中华医学会中华病理学杂志编辑部(常秀青);中华医学会中华血液学杂志编辑部(董文革)
参考文献
[1]SwerdlowSH, CampoE, HarrisNL, et al. WHO classification of tumours of haemtopoietic and lymphoid tissues[M]. Lyon: IARC Press, 2008:157-166.
[2]NCCN.org.Non-Hodgkin′Lymphoma,Version 2.2015.NCCN Clinical Practice Guidelines in Oncology(NCCN Guidelins),NHODG-A:1-11.
[3]HussongJW, ArberDA, BradleyKT,et al. Protocol for the examination of specimens from patients with non-Hodgkin lymphoma/lymphoid neoplasms[J]. Arch Pathol Lab Med, 2010, 134(6):e40-e47. DOI:10.1043/1543-2165-134.6.e40.
[4]KalinaT, Flores-MonteroJ, LecrevisseQ,et al.Quality assessment program for EuroFlow protocols: summary results of four-year (2010-2013) quality assurance rounds[J]. Cytometry A, 2015,87(2):145-156. DOI:10.1002/cyto.a.22581.
[5]LeachM, DrummondM, DoigA. Practical flow cytometry in haematology diagnosis[M]. Oxford: Wiley-Blackwell,2013.
[6]中华医学会血液学分会,中国抗癌协会血液肿瘤专业委员会.中国B细胞慢性淋巴增殖性疾病诊断专家共识(2014年版)[J]. 中华血液学杂志,2014,35(4): 367-370.DOI: 10.3760/cma.j.issn.0253-2727.2014.04.028.
[7]中华医学会血液学分会,中国抗癌协会血液肿瘤专业委员会.中国慢性淋巴细胞白血病/小淋巴细胞淋巴瘤的诊断与治疗指南(2015年版)[J].中华血液学杂志,2015,36(10):809-813.DOI: 10.3760/cma.j.issn.0253-2727.2015.10.001.
[8]DeardenCE, JohnsonR, PettengellR, et al. Guidelines for the management of mature T-cell and NK-cell neoplasms (excluding cutaneousT-cell lymphoma)[J].Br J Haematol, 2011, 153(4):451-485. DOI: 10.1111/j.1365-2141.2011.08651.x.
[9]WoodBL, ArrozM, BarnettD,et al. 2006 Bethesda International Consensus recommendations on the immunophenotypic analysis of hematolymphoid neoplasia by flow cytometry: optimal reagents and reporting for the flow cytometric diagnosis of hematopoietic neoplasia[J]. Cytometry B Clin Cytom, 2007,72Suppl 1:S14-S22.
[10]van DongenJJ, LhermitteL, B?ttcherS,et al. EuroFlow antibody panels for standardized n-dimensional flow cytometric immunophenotyping of normal, reactive and malignant leukocytes[J]. Leukemia, 2012, 26(9):1908-1975. DOI:10.1038/leu.2012.120.
[11]RawstronAC, VillamorN, RitgenM,et al.International standardized approach for flow cytometric residual disease monitoring in chronic lymphocyticleukaemia[J]. Leukemia, 2007, 21(5):956-964.
[12]RawstronAC, B?ttcherS, LetestuR,et al. Improving efficiency and sensitivity: European Research Initiative in CLL (ERIC) update on the international harmonised approach for flow cytometric residual disease monitoring in CLL[J]. Leukemia, 2013, 27(1):142-149. DOI: 10.1038/leu.2012.216.
[13]RawstronAC, FaziC, AgathangelidisA,et al. A complementary role of multiparameter flow cytometry and high-throughput sequencing for minimal residual disease detection in chronic lymphocytic leukemia: an European Research Initiative on CLL study[J]. Leukemia, 2016, 30(4):929-936. DOI:10.1038/leu.2015.313.
[14]CheminantM, DerrieuxC, TouzartA,et al. Minimal residual disease monitoring by 8-color flow cytometry in mantle cell lymphoma: an EU-MCL and LYSA study[J]. Haematologica, 2016, 101(3):336-345. DOI: 10.3324/haematol.2015.134957.
[15]ChovancováJ, BernardT, StehlíkováO, et al. Detection of minimal residual disease in mantle cell lymphoma-establishment of novel eight-color flow cytometry approach[J].Cytometry B Clin Cytom, 2015, 88(2):92-100. DOI: 10.1002/cyto.b.21210.
[16]Garnache OttouF, ChandesrisMO, LhermitteL, et al. Peripheral blood 8 colour flow cytometry monitoring of hairy cell leukaemia allows detection of high-risk patients[J]. Br J Haematol, 2014, 166(1):50-59. DOI:10.1111/bjh.12839.
[17]JohanssonU, BloxhamD, CouzensS, et al. Guidelines on the use of multicolour flow cytometry in the diagnosis of haematological neoplasms. British Committee for Standards in Haematology[J].Br JHaematol, 2014, 165(4):455-488. DOI: 10.1111/bjh.12789.
[18]JaffeES, BanksPM, NathwaniB, et al. Recommendations for the reporting of lymphoid neoplasms: a report from the Association of Directors of Anatomic and Surgical Pathology[J]. Mod Pathol, 2004, 17(1):131-135.
[19]KalinaT, Flores-MonteroJ, van der VeldenVH,et al. EuroFlow standardization of flow cytometer instrument settings and immunophenotyping protocols[J]. Leukemia, 2012, 26(9):1986-2010. DOI: 10.1038/leu.2012.122.















共0条评论