1999年,Rosen[1]首先描述了在乳腺病变组织学检查中小管癌常伴有低级别小叶原位癌和柱状细胞不典型增生。2008年,Brandt等[2]建议将乳腺病变组织中同时出现以上3种成分命名为Rosen三联征。我们收集了5例Rosen三联征,总结其临床病理特点并复习相关文献,以提高诊断水平。
一、资料与方法
1.临床资料:
5例患者均为女性,年龄40~53岁,平均47岁;病程5~24个月,平均12个月;右乳3例,左乳2例;术前临床诊断乳腺增生1例、乳腺腺病1例、乳腺癌3例;入院后完善相关检查,均行手术切除,标本常规送病理检查。
2.方法:
5例标本均用3.7%中性甲醛固定,常规脱水,石蜡包埋,3μm厚切片行HE染色和免疫组织化学染色,免疫组织化学标记采用EnVision二步法。所用一抗为雌激素受体(ER)、孕激素受体(PR)、CK5/6,p63、bcl-2、E-cadherin和Ki-67。所有抗体及试剂盒均购自福州迈新生物技术有限公司。诊断标准为Brandt等[2]提出的Rosen三联征诊断标准。
二、结果
1.病理学检查:
大体观察:组织块大小为1.5cm×1.5cm×1.0cm~4.0cm×3.0cm×2.5cm,切面肿块1.0cm×1.0cm×0.8cm~2.0cm×1.5cm×1.5cm,无包膜,边界不清;例1切面黄白相间,似放射状外观;例2切面灰黄灰白色,质地较硬;例3、4切面可见中心性黄斑;例5切面棕黄色,质地硬。
镜下观察:例1病变的主体呈放射状(图1)。
中央区多数为扩张呈大小不一囊状或筛状的导管,导管上皮由1~3层的柱状上皮构成,细胞核相对单一的圆形或卵圆形,核仁明显,核染色质粗块状,胞质嗜酸性,可见非常明显的胞质顶突现象,核/质比增加。细胞复层排列,细胞核不完全垂直于基底膜。部分增生的上皮可形成小丘、簇状,或短的流产型微乳头。呈现平坦型上皮不典型增生(图2)。
该结构的周围杂乱无章地分布着分化良好的增生腺体和小管,小管和腺体由单层上皮细胞组成,周围无肌上皮。小管多呈卵圆形,明显成角伴末端逐渐变细,管腔开放。间质促纤维增生反应,呈小管癌改变(图3)。
病变周边在一个小叶内的多数腺泡内充满着松散排列的肿瘤细胞,细胞核小而一致,圆形至卵圆形,染色质较均匀,核仁不明显或缺乏,核分裂象少见,呈小叶原位癌改变(图4)。
例2小管癌的区域及小叶原位癌的区域与上例相似。柱状细胞变区域见导管扩张,导管上皮高柱状,胞质丰富、嗜酸性,核无明显异型性,1~2层排列。
例3镜下可见小管癌的区域中出现少量筛状癌的特征,可见钙化,但数量较少(<5%),其余形态特征与例1相似。
例4小管癌的区域及小叶原位癌的区域与例1相似。柱状细胞增生区域见导管扩张,导管上皮高柱状,核无明显异型,胞质丰富、嗜酸性。细胞增生,复层排列,极性可见,细胞核基本垂直于基底膜。
例5镜下特征与例1相似,在小管癌周边区域可见导管内乳头状瘤结构。
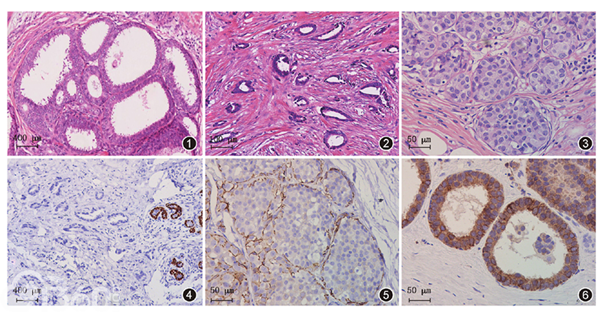
图1 乳腺Rosen三联征,显示病变呈放射状,间质纤维组织增生,瘢痕样收缩 HE 低倍放大;
图2 平坦型上皮不典型增生,细胞轻至中度异型,在导管腔内形成小丘、簇状或短的流产型微乳头 HE 中倍放大;
图3 小管癌,分化良好的增生腺体或小管由单层上皮细胞组成,杂乱无章排列 EnVision法 高倍放大;
图4 小叶原位癌,细胞类圆形,细胞核小而一致,胞质丰富,腺泡因充满这种肿瘤细胞而膨胀 EnVision法 低倍放大;
图5 E-cadherin表达缺失 EnVision法 高倍放大;
图6 平坦型上皮不典型增生,上皮细胞bcl-2阳性 EnVision法 高倍放大。
2.免疫表型:
5例患者免疫表型均相似。小管癌中ER、PR阳性,CK5/6、p63阴性显示无肌上皮组织存在;低级别小叶原位癌中ER强阳性表达,细胞黏附分子E-cadherin的表达缺失(图5),符合小叶原位癌的诊断;平坦型上皮不典型增生上皮细胞弥漫表达ER和PR,这些细胞也呈bcl-2细胞质强阳性(图6),而周围的肌上皮呈不同程度的CK5/6阳性。但例2和例4中Ki-67阳性指数在低级别小叶原位癌区域低于平坦型上皮不典型增生区域。
3.病理诊断:
Rosen三联征,其中柱状细胞不典型增生例1、3、5为平坦型上皮不典型增生,例2为柱状细胞变,例4为柱状细胞增生。
4.随访:
术后随访最短时间1年,最长4年,患者一般情况良好,未见肿瘤复发。
三、讨论
柱状细胞病变是一种上皮增殖过程,涉及终末导管和小叶单位,通常发生在围绝经期妇女,分为柱状细胞变、柱状细胞增生和平坦型上皮不典型增生。细胞异型性特征相对单一的圆形到卵圆形核,核染色质分布均匀或轻度边集,核仁明显或不明显,少见核分裂象。
乳腺癌传统分类为导管癌和小叶癌。现已证实大部分乳腺癌均自终末导管小叶原位单位发生,导管癌与小叶癌之分是由于分化方向不同,主要累及导管者为导管癌,累及小叶者为小叶癌,小叶原位癌可能是原位癌的早期阶段,可在原位发展为导管原位癌,真正自乳腺导管发生的癌只占少数。乳腺组织活检观察到不典型柱状细胞病变常伴有导管原位癌及某些类型的浸润性癌(特别是小管癌)。某些柱状细胞病变基因改变与导管原位癌或浸润癌相同,提示不典型柱状细胞病变是肿瘤性增生,可能是低级别导管内癌的癌前期或最早期形态学表现,或者是浸润癌(特别是小管癌)的前期改变[3]。Simpson等[4]研究提示柱状细胞病变可能进展为导管原位癌或浸润性癌,是“某些原位癌和浸润性癌发展的非必须中间步骤”。Abdel-Fatah等[5]也认为,柱状细胞变、柱状细胞增生、柱状上皮不典型增生、原位癌、小管癌为同一肿瘤的不同进展阶段,故活检时能观察到其形态共存同一标本,表明乳腺小管癌也遵循柱状上皮增生-柱状上皮不典型增生-原位癌-浸润性癌的线性发展模式。
1999年,Rosen[1]首次进行了分类描述小管癌癌变周边甚至在癌组织中常有柱状细胞病变分布,偶尔出现导管原位癌。2008年Brandt等[2]提议乳腺病变组织中同时出现小管癌、低级别小叶原位癌和柱状细胞病变3种病变成分(至少有1张切片同时出现3种成分)命名为“Rosen三联征”。由于所有小管癌病例均含有至少1个类型的柱状细胞病变成分,而约53%小管癌含有低级别小叶原位癌(不能诊断不典型小叶增生或多形性小叶癌)病变成分,因此将只含小管癌、柱状细胞病变而缺乏低级别小叶原位癌成分的病例命名为“非Rosen三联征”。两者比较,Rosen三联征似乎更具有多灶性或多中心性(在乳腺的1个象限或同侧乳腺不同象限的肿瘤分别存在2个或更多的病灶)、平均瘤体更大、合并其他高级别侵袭性癌以及转移性淋巴结受累。E-cadherin免疫组织化学染色常用于灶性区域的高核分级或管腔坏死部位的低级别小叶原位癌与原位癌(包括小叶、终末导管和导管部位的原位癌)的鉴别诊断,有浸润性病例中柱状细胞病变成分均是ER阳性、PR阳性。
Rosen三联征与细胞遗传学有联系,研究常发现3种成分具有相同的染色体改变特征,如低级别小叶原位癌有多条染色体基因增多和缺失,目前公认的突变形式是16q上的CDH1基因失活,导致随后钙黏蛋白的表达减少;小管癌也表现出16q丢失,而且比其他浸润性乳腺癌更常见。16q完全或部分丢失后,这些实体之间链接将通过其他方式进行,而低级别导管原位癌的链接方式将通过低度恶性乳腺肿瘤间的分子通路方式进行。另外,黏附导管原位癌、小管癌和小叶瘤3种病变有相同的单克隆模式,而且黏附DCIS的3p、16q和11q上的杂合体经常丢失[6]。
参考文献
[1]RosenPP.Columnar cell hyperplasia is associated with lobular carcinoma in situ and tubular carcinoma[J]. Am J Surg Pathol, 1999, 23(12): 1561.
[2]BrandtSM, YoungGQ, HodaSA.The “Rosen Triad” : tubular carcinoma, lobular carcinoma in situ, and columnar cell lesions[J]. Adv Anat Pathol, 2008, 15(3): 140-146.
[3]丁华野,皋岚湘。 乳腺柱状细胞病变:新版WHO分类中平坦上皮不典性的形态学问题[J]. 临床与实验病理学杂志,2004,20(3):257-260.
[4]SimpsonPT, GaleT, Reis-FilhoJS, et al.Columnar cell lesions of the breast: the missing link in breast cancer progression? A morphological and molecular analysis[J]. Am J Surg Pathol, 2005, 29(6): 734-746.
[5]Abdel-FatahTM, PoweDG, HodiZ, et al. High frequency of coexistence of columnar cell lesions, lobular neoplasia, and low grade ductal carcinoma in situ with invasive tubular carcinoma and invasive lobular carcinoma[J]. Am J Surg Pathol, 2007, 31(3): 417-426.
[6]MoinfarF, ManYG, BratthauerGL, et al.Genetic abnormalities in mammary ductal intraepithelial neoplasia-flat type ( “clinging ductal carcinoma in situ” ): a simulator of normal mammary epithelium[J]. Cancer, 2000, 88(9): 2072-2081.














共0条评论