▌来源:生物探索
导读:免疫细胞与干细胞之间如何交流?会带来哪些好与坏的影响?当下,研究进程正处于黎明阶段,我们已经开始解析不同免疫细胞与干细胞之间的关联,这对于利用干细胞治疗疾病有着重要意义和前景。
作为一类具有自我更新、复制和多向分化潜能的细胞,干细胞被医学家誉为“万用细胞”。这些特性奠定了干细胞在组织修复、细胞治疗、药物研发、毒理评估、疾病模型构建等多方面的应用价值。
现在,每个人都可以预见干细胞治疗的巨大潜力,但是瓶颈在于跨越细胞本身与实现治疗的鸿沟。这也是很多研究团队、医药企业正在努力和创新的方向。多年来,科学家们都专注于研究干细胞本身,试图弄清楚赋予它们再生、分化成多类型细胞能力的分子机制。
虽然这些研究已经挖掘出一系列维持干细胞“干性”的基因和蛋白质,但是干细胞微环境,即“干细胞巢”(stem cell niche),却很大程度上被忽视。相邻细胞、分泌的蛋白质、细胞外基质、新陈代谢信号(氧气、葡萄糖等)以及力学参数(剪切应力、组织硬度等)……统统都会影响干细胞的“行为”。
免疫细胞如何与干细胞“交流”?
肠道干细胞巢(ISC niche)是研究哺乳动物干细胞微环境的最典型“案例”。
肠道干细胞分化、迁移的速度异常快速,这主要得益于肠道特有的潘氏细胞(Paneth cells)。潘氏细胞是一类位于小肠、防御微生物侵犯的特殊细胞,由肠道干细胞分化而来,保留在干细胞巢内,负责分泌一种维持肠道干细胞生命力的关键蛋白质。研究证实,潘氏细胞一旦失活,肠道干细胞功能几乎完全丧失。(文献1)
除了干细胞巢里的细胞,干细胞定期还会与免疫细胞互作。作为防御入侵病原体的主要防线,免疫细胞被认为是维持体内稳态、促进损伤愈合的关键元素。值得注意的是,免疫细胞对于干细胞的影响并不单一,要根据物种、发育阶段、受损器官或组织、受伤程度、干细胞池特性而具体分析。
在某些情况下,免疫细胞甚至会攻击正常组织,促进癌变细胞的增殖和扩散。掌握免疫系统对于干细胞功能发挥的影响,有利于科学家们更好的应用干细胞治疗多种疾病,例如贫血、多发性硬化症、肌肉萎缩症和心脏衰竭。
免疫细胞参与干细胞分化:维持体内平衡
维持体内平衡的重要分支是细胞的持续更新,而干细胞巢内的免疫细胞对于细胞更新过程至关重要:
骨髓中的巨噬细胞被证实直接与红血球母细胞(erythroblast)互作。如果这种直接互作过程受阻,红血球母细胞将不能正常成熟,补充血液中的红细胞,最终易引发再生障碍性贫血。(文献2)
大脑神经发生曾被认为仅仅发生于胚胎和妊娠后期,现有研究证实这一神经干细胞再生的过程贯穿于整个成年时期,且发生在大脑海马齿状回和侧脑室下区,因为这两个区域是神经干细胞的聚集地。神奇的是,科学家发现免疫细胞参与调节海马体记忆和学习功能。
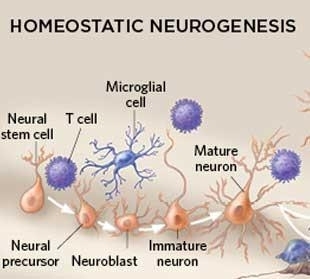
▲免疫细胞参与神经发生(图片来源于IKUMI KAYAMA/STUDIO KAYAMA)
来自于以色列威兹曼科学院的研究团队证实,啮齿动物的海马体神经发生过程与T细胞和小胶质细胞(大脑和脊髓的巨噬细胞)有关联。免疫缺陷小鼠的神经发生过程会出现故障,进一步导致记忆、学习能力衰退。(文献3)
目前,仍然不清楚海马区神经发生过程中免疫细胞如何影响神经干细胞巢。然而,因为仅仅只有一小部分新生神经元融入海马回路,大多数新生神经元会走向凋亡。所以,科学家们推测,小胶质细胞负责吞噬剩余的大部分神经元。(文献4)
免疫细胞也参与青春期乳腺发育过程。出生时,乳腺由脂肪垫和小导管组成。进入青春期后,在卵巢激素的刺激下,乳腺导管向外增生。同时,不同的免疫细胞(肥大细胞、嗜酸粒细胞、巨噬细胞)会迁移至导管周围区域。其中,肥大细胞分泌降解蛋白的丝氨酸蛋白酶,该酶调控乳腺导管周围胶原纤维的降解和重组。(文献5)巨噬细胞负责清理凋亡细胞碎片,直接作用于乳腺干细胞,但是其作用机理并不清楚。(文献6、7)研究发现,小鼠的肥大细胞、巨噬细胞发生突变后,会抑制青春期乳腺导管细胞的快速增值和分化。
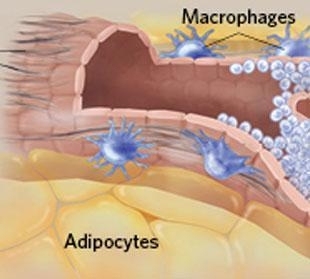
▲青春期,乳腺导管增生过程(图片来源于IKUMI KAYAMA/STUDIO KAYAMA)
总结上述对于骨髓、乳腺、大脑的研究,我们可以发现干细胞巢中的免疫细胞会调控干细胞功能的行使,维持细胞增殖和凋亡的“收支平衡”。
免疫细胞与干细胞“合作”:应对伤害
验证免疫细胞和干细胞合作的最佳“案例”也许是骨骼肌损伤修复:
首先,免疫细胞负责清除受损的肌肉纤维。
随后,嗜酸性粒细胞促进纤维/脂肪母细胞(FAPs)生成纤维细胞和脂肪细胞,进一步分泌胶原蛋白和生长因子激活肌肉纤维再生。(文献8)
同时,T细胞分泌双调蛋白(amphiregulin),该蛋白参与肌肉干细胞“卫星细胞”(satellite cells )的分化,促进新肌肉细胞生成。(文献9)
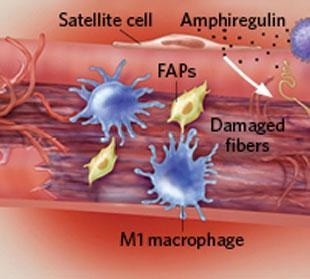
▲骨骼肌损伤修复过程(图片来源于IKUMI KAYAMA/STUDIO KAYAMA)
除了骨骼肌组织,小鼠其他器官组织同样存在着干细胞和免疫细胞互作的过程:当肝脏出现慢性损伤时,巨噬细胞会分泌Wnt3a蛋白质,启动肝脏干细胞分化、生成成熟的肝细胞;(文献10)当肠道受损后,巨噬细胞会激活肠道干细胞增殖、再生;(文献11)当神经系统受伤,抗炎M2巨噬细胞负责启动髓鞘的再生,促进神经元轴突的递质传递。(文献12)
除了身体内的器官组织,科学家还发现了一个暗含干细胞、免疫细胞互作风云的有趣场所——毛囊。去年,来自于南加州大学的Cheng Ming Chuong团队发现,巨噬细胞调控掉发后新头发的再生过程。(文献13)
当研究人员去除老鼠背上所有的毛后,结果发现,所有受损的毛囊都会分泌 CCL2蛋白。该蛋白作为一种“求救信号”,负责吸引巨噬细胞迁移至毛囊之处,并分泌肿瘤坏死因子(TNF),启动毛囊干细胞再生出新的头发。
越来越多的研究揭示免疫细胞是干细胞研究领域不可忽视的部分,是启动组织再生、损伤修复的关键元素。理论上,靶向这些免疫细胞应该能够加快损伤修复的过程。然而,免疫细胞群存在多样性和异质性,所以很难开发出统一、有效的治疗方法。这意味着,我们需要对免疫细胞种群进行细化研究,以精准挖掘到控制组织修复的特定免疫细胞。
免疫细胞与肿瘤干细胞“交流”:助纣为虐
免疫细胞和干细胞的沟通并不总是有益的!
有时,细胞互作会导致纤维化、组织功能障碍。以患有慢性肌肉损伤的小鼠为模型(类似于杜氏肌肉萎缩症,DMD),研究发现该小鼠体内的浸润性免疫细胞和纤维/脂肪母细胞异常活跃,而卫星干细胞修复能力减弱。这些异常都是因为抗肌萎缩蛋白基因出现突变,导致胶原蛋白沉积过度和紊乱,最终引发纤维化和肌肉功能丧失。
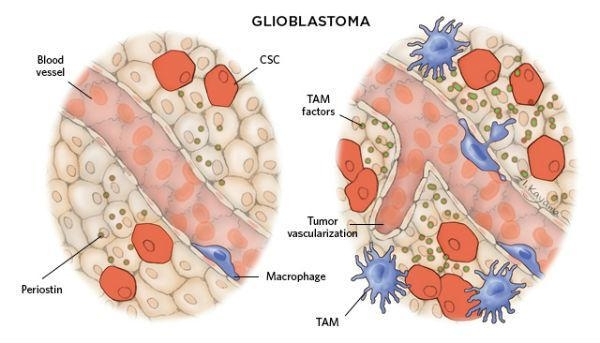
为什么会发生这些呢?答案可能跟浸润性巨噬细胞如何与纤维/脂肪母细胞互作有关联。
去年,加拿大哥伦比亚大学的研究团队发现,对于正常肌肉组织,在其受伤后的三天内,纤维/脂肪母细胞数量显著增加,但是在第五天会迅速下降至正常水平。(文献14)
研究表明,巨噬细胞直接负责调控纤维/脂肪母细胞数量的下降。正常情况下,免疫细胞通过分泌肿瘤坏死因子与纤维/脂肪母细胞结合,并传递细胞凋亡的信号。然而,对于患有DMD的小鼠模型,其体内巨噬细胞分泌的却是另一种蛋白质——转化生长因子b1(TGFb1)。不同于肿瘤坏死因子,转化生长因子b1会延长纤维/脂肪母细胞的存活期,并分化成一种分泌胶原蛋白的细胞。这种细胞数量一旦超标,易导致肌肉纤维化和功能障碍。
当免疫细胞与癌症干细胞互作时,则会出现更糟的结果——支持肿瘤细胞的增殖和转移。许多传统的抗癌治疗方案会以不同的方式消灭癌症干细胞和他们的复制后代,但是抗癌药物却不能识别分裂慢的癌症干细胞,使其成为“漏网之鱼”,从而埋下治疗失败的祸根。
目前,科学家们正在转变抗癌的靶标,有趣的是,成功的关键可能是我们自己的免疫系统。肿瘤微环境中最丰富的免疫细胞是巨噬细胞。现有研究已经表明,肿瘤微环境中充满着重塑肿瘤相关巨噬细胞(tumor-associated macrophages,TAMs)的信号,这些巨噬细胞会刺激肿瘤朝着恶性、侵袭性和耐药性发展。许多临床研究已经表明,巨噬细胞数量的增加可以预测甲状腺癌、乳腺癌、肺癌和肝癌的发生率。
研究人员正在探索更有效的方法阻止巨噬细胞浸润性,干扰肿瘤干细胞和肿瘤相关巨噬细胞的互作。2013年,一项以胰腺癌老鼠为模型的研究表明,抑制与巨噬细胞迁移和生存相关联的CSF1R和CCR2蛋白因子能够有效降低胰腺癌干细胞的数量,增强化疗效果、抑制肿瘤的转移。(文献15)值得高兴的是,当这一研究转入临床,胰腺癌患者接受靶向CSF1R的治疗后,其体内肿瘤相关巨噬细胞数量明显降低。(文献16)
总结
干细胞有着非凡的自我更新、多向分化的能力,且对于机体生存不可或缺。为了扮演好它们在组织再生、修复中的角色,干细胞依赖于周围环境提供的信号,包括免疫细胞。当下,研究进程正处于黎明阶段,我们已经开始解析不同免疫细胞与干细胞之间的关联,这对于利用干细胞治疗、治愈疾病有着重要意义和前景。
参考文献:
1、T. Sato et al., “Paneth cells constitute the niche for Lgr5 stem cells in intestinal crypts,” Nature, 469:415-18, 2011.
2、A. Chow et al., “CD169+ macrophages provide a niche promoting erythropoiesis under homeostasis and stress,” Nat Med, 19:429-36, 2013.
3、Y. Ziv et al., “Immune cells contribute to the maintenance of neurogenesis and spatial learning abilities in adulthood,” Nat Neurosci, 9:268-75, 2006.
4、A. Sierra et al., “Microglia shape adult hippocampal neurogenesis through apoptosis-coupled phagocytosis,” Cell Stem Cell, 7:483-95, 2010.
5、J.N. Lilla, Z. Werb, “Mast cells contribute to the stromal microenvironment in mammary gland branching morphogenesis,” Dev Biol, 337:124-33, 2010.
6、V. Gouon-Evans et al., “Postnatal mammary gland development requires macrophages and eosinophils,” Development, 127:2269-82, 2000.
7、D.E. Gyorki et al., “Resident macrophages influence stem cell activity in the mammary gland,” Breast Cancer Res, 11:R62, 2009.
8、J.E. Heredia et al., “Type 2 innate signals stimulate fibro/adipogenic progenitors to facilitate muscle regeneration,” Cell, 153:376-88, 2013.
9、D. Burzyn et al., “A special population of regulatory T cells potentiates muscle repair,” Cell, 155:1282-95, 2013.
10、L. Boulter et al., “Macrophage-derived Wnt opposes Notch signaling to specify hepatic progenitor cell fate in chronic liver disease,” Nat Med, 18:572-79, 2012.
11、S.L. Pull et al., “Activated macrophages are an adaptive element of the colonic epithelial progenitor niche necessary for regenerative responses to injury,” PNAS, 102:99-104, 2005.
12、V.E. Miron et al., “M2 microglia and macrophages drive oligodendrocyte differentiation during CNS remyelination,” Nat Neurosci, 16:1211-18, 2013.
13、C.-C. Chen et al., “Organ-level quorum sensing directs regeneration in hair stem cell populations,” Cell, 161:277-90, 2015.
14、D.R. Lemos et al., “Nilotinib reduces muscle fibrosis in chronic muscle injury by promoting TNF-mediated apoptosis of fibro/adipogenic progenitors,” Nat Med, 21:786-94, 2015.
15、J.B. Mitchem et al., “Targeting tumor-infiltrating macrophages decreases tumor-initiating cells, relieves immunosuppression and improves chemotherapeutic responses,” Cancer Res, 73:1128-41, 2013.
16、C.H. Ries et al., “Targeting tumor-associated macrophages with anti-CSF-1R antibody reveals a strategy for cancer therapy,” Cancer Cell, 25:846-59, 2014.
备注:文章参考自The Scientist文章“Immune Cell–Stem Cell Cooperation”。


















共0条评论