译者按:“2016年版WHO中枢神经分类概述”于5月9日在Acta Neuropathol杂志在线发表。我们在第一时间将中文翻译版本推送,希望能够给神经肿瘤临床工作者提供一点帮助。由于翻译团队都是神经外科医生,文中部分病理诊断名词的翻译可能与临床实践有部分出入,同时表格内的诊断专有名词未全文编译,敬请谅解。
【摘要】
2016世界卫生组织(WHO)中枢神经系统肿瘤分类是2007版本概念和实践上的进一步推进。新的中枢神经系统WHO 分类系统首次针对大多数肿瘤在组织学分型基础上增加了分子分型来分类,从而建立了分子时代CNS肿瘤诊断的新概念。2016 CNS WHO分类主要在弥漫型胶质瘤、髓母细胞瘤和其它胚胎性肿瘤中进行了重分类,这之中包含了结合组织学和分子学特征的新名称定义原则,包括胶质母细胞瘤-IDH野生型和胶质母细胞瘤-IDH突变型;弥漫型中线胶质瘤-H3 K27M突变型;RELA融合阳性室管膜瘤;髓母细胞瘤-WNT激活型和髓母细胞瘤-SHH激活型;胚胎性肿瘤伴有多层细胞菊形团-C19MC激活等。2016版增加了部分新的肿瘤,删除了部分不再与诊断和生物学相关的名称、变化和形式等。其它需要指出的变化还包括在非典型性脑膜瘤中增加脑侵犯作为一个诊断标准,在新的单独神经纤维瘤/血管外皮细胞瘤联合体中引入了软组织类型分级系统,这种分型系统不同于其它CNS分型系统。总之,希望2016 CNS WHO分类系统能使临床、实验室研究和流行病学的研究更便利,并且改善脑肿瘤患者的生存。

【前言】
过去的一个世纪中,脑肿瘤的分类很大程度上基于肿瘤组织学发生的概念,肿瘤根据微观中的相似和不同之处来假定其细胞起源和分化水平。这些组织学的特征主要依赖于光学显微镜下H-E染色,免疫组织化学染色显示相关蛋白质和部分超微结构特征。比如,2007版中将星形细胞表型的肿瘤与少突细胞表型的肿瘤区别开来,而不论这些不同的星形细胞肿瘤临床上是否相似或不同。
过去20年,关于这些常见或罕见肿瘤发生的遗传学基础逐步阐明,这些都有助于针对肿瘤的分类。一些基因改变在2007版的时候就已经熟知了,但是当时并没有认为这些变化可能会用来定义特定的病变,不过,它们还是在传统组织学为基础的分类下提供了预后或预测数据。2014年在荷兰哈勒姆举行的国际神经病理联合会议上建立了如何将分子病理结果加入脑肿瘤诊断的指南,并建立了2007版分类修订的路线图。新版的(2016)CNS WHO分类打破了完全基于显微镜下诊断的百年诊断原则,将分子变量加入到CNS肿瘤分类中来。这些工作依赖于来自20个国家117名贡献者的国际合作,以及来自10个国家35名神经病理和神经肿瘤专家和学者针对最具争议的问题进行了为期3天的讨论。本综述将简述2007和2016两版本分类的主要变化。

【分类】
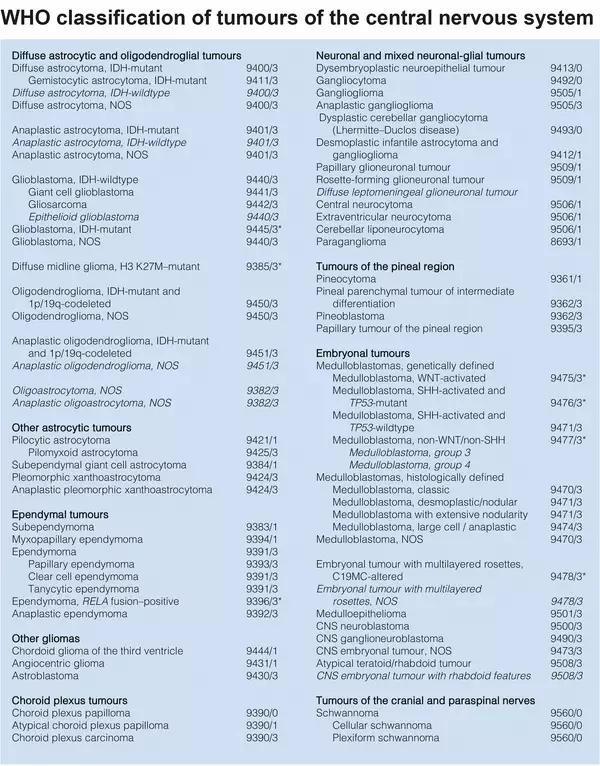
2016 CNS WHO分类见表1,官方定义为2007 第4版修订版不是正式的第五版。所以第五版的WHO蓝皮书并没有出版,不过鉴于该领域的一致性进展,血液/淋巴和CNS肿瘤卷被许可更新。2016版较2007版有大量的更新,重要的不同点在表2中体现,并在下文中体现,肿瘤分级概要见表3。

【总的原则和挑战】
CNS肿瘤分类中“整合”表型和基因型参数的方法在客观性上提高了一个水平。这种客观性的增加有助于增加诊断的均质性,出现更准确的定义,最终导致更准确的诊断并改善病人的管理,提高诊疗的精确性。不过,这将会出现一大部分不符合这些限定性高的诊断群体,这部分群体需要有进一步的研究和新的分类标准。
其中,引人注目的例子就是有关少突星形胶质细胞瘤的诊断,这一诊断通常很难界定,研究者之间有很多的不同意见,在部分中心很常见,但是在部分中心很少见。应用表型和基因型(IDH 突变和 1p/19q联合缺失状态)联合的诊断方法来诊断包括星形细胞瘤、少突星形细胞瘤和少突胶质细胞瘤的整体来说,很少会见到包含有组织学和遗传学截然不同的星形细胞(IDH-突变, ATRX-突变, 1p/19q-未缺失)和少突胶质细胞(IDH-突变, ATRX-野生,1p/19q-联合缺失)成分的“纯”的少突星形胶质细胞瘤。因此更常见的星形细胞瘤和少突胶质细胞瘤的组成将变得更为均一。2016 CNS WHO分类中,先前诊断的少突星形细胞瘤和间变少突星形细胞瘤被定义为NOS分类,原因是这些诊断可能出现在缺乏分子诊断的部分或极少数的双基因型少突星形细胞瘤。
应用组织学和分子基因特征的诊断提高了不一致结果出现的可能性。例如:弥漫型胶质瘤出现组织学上星形细胞成分但是却具有IDH突变和1p/19q联合缺失,或者肿瘤光镜表现为少突胶质细胞形态但是具有IDH, ATRX和TP53 突变及1p/19q未缺失。需要指出的是,在这些情况下,基因型表型胜过组织学表型,前述第一例诊断为少突胶质细胞瘤IDH突变和1p/19q联合缺失,第二例诊断为弥漫型星形细胞瘤IDH突变。
星形细胞瘤、少突胶质细胞瘤和少突星形细胞瘤的分类标准带来一个问题:是否基因学诊断可以单独执行,而不依赖于组织学诊断。目前来说,这是不可能实现的。病例依旧需要诊断为弥漫型胶质瘤(而不是其它肿瘤类型),通过这个了解疾病的分类和基因变化的临床意义。此外,WHO分级标准依旧以组织学分类为基础。另外一个,表型依旧很必要的原因是部分肿瘤仍不能完全符合这种具体的表型和基因型的定义。例如,部分少见的表型分类为弥漫星形细胞瘤者缺乏明显的IDH和ATRX等基因型特征。无论如何,将来的WHO分型依旧需要保留弥漫型胶质瘤,更深更广的基因型设置,可能需要更少的组织学评价,或许只需要诊断为“弥漫型胶质瘤”就足够了。目前,2016 CNS WHO 建立了基于联合表型和基因型的诊断标准,进入“整合”诊断时代
最后,非常重要的一点是更改包含基因型的诊断依据可能会对病理检测和报告带来挑战。这些挑战包括:基因分型或替代基因分型检测的可用性和选择;没有能力达到分子技术或免疫组化技术的单位获得结果的途径;“整合”诊断的标准格式。尽管如此,联合表型和基因型的诊断方式在一些大的中心实现,伴随着更多的免疫组化替代分子基因方法的逐步发展,在不久的将来,这部分挑战将被很容易的克服。
【命名法】
联合组织病理和分子特征的诊断需要尽可能使用标准化的诊断术语。总的来说,2016 CNS WHO 标准参照血液/淋巴系统诊断体系。CNS诊断包含组织病理诊断加基因特征,如:弥漫星形细胞瘤,IDH突变和髓母细胞瘤,WNT激活型。
具有超过一个表型者,在名称中加上表型:少突胶质细胞瘤,IDH突变和1p/19q联合缺失。
如果肿瘤缺乏基因突变,则描述为野生型,如胶质母细胞瘤,IDH野生型。但是,需要指出的是,缺乏突变检测应该被诊断为NOS分类。
一些特殊的基因型中,“阳性”表明这种分子表性存在,如室管膜瘤RELA融合阳性。
缺乏分子诊断测试被定义为NOS(非其它分类)。NOS分类表明没有足够的证据分到其它特定的诊断。在本文中,NOS多数指肿瘤没有充分的检测相关基因参数,但是其它一些较少的情况也包括肿瘤经过检测,但是并没有发现诊断相关的基因型选项。换句话说,NOS并不是限定一个整体:而是指不能分类进入任何限定的肿瘤分类组中。因此,NOS分类代表一类我们没有足够的病理学、基因学和临床特征的诊断,需要进一步的研究来细化其分类。
对于格式和字体。斜体字被用来指示基因符号(ATRX),但是不包括基因家族(IDH,H3)。最后,WHO分级用罗马字(I, II, III 和 IV)而不是阿拉伯数字。
弥漫型胶质瘤
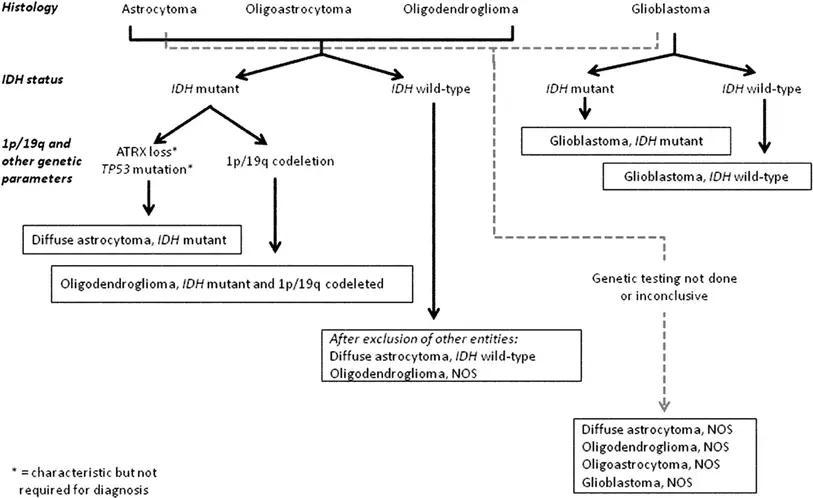
在弥漫型胶质瘤中,疾病分类的改变基于表型和基因型(图1)。最显著的变化是,过去所有星形细胞瘤归于一类,而新的分类将所有弥漫浸润性胶质瘤(无论是星形细胞还是少突胶质细胞)归于一组,这样分类不仅仅是基于生长方式和行为表现,更多的是基于IDH1和IDH2基因共同的驱动突变。从发病机制角度看,这提供了一种基于表型和基因型的动态分类;从预后的角度,将具有相似预后标志物的肿瘤归为一组;从病人管理角度,新的分类将对生物学和基因学相似的肿瘤指导治疗(传统的或者靶向的)。
在新分类,弥漫型胶质瘤包括WHO分级II级和III级的星形细胞瘤,II级和III级的少突胶质细胞瘤,IV级的胶质母细胞瘤,以及儿童相关的弥漫型胶质瘤(详见下文)。这种分类使得那些具有局限生长方式的、缺乏IDH基因家族突变以及频繁伴随BRAF突变(毛细胞星形细胞瘤,多形性黄色星形细胞瘤)或TSC1/TSC2突变(室管膜下巨细胞星形细胞瘤)者显著区分于弥漫型胶质瘤。换句话说,弥漫型星形细胞瘤和少突胶质细胞瘤在疾病分类上比弥漫型星形细胞瘤和毛细胞星形细胞瘤之间更类似;疾病的谱系图已经改写。
弥漫型星形细胞瘤和间变型星形细胞瘤
WHO II级弥漫型星形细胞瘤和WHO III级间变型星形细胞瘤现在都各自分为IDH突变型,IDH野生型和NOS三类。对于II级和III级肿瘤,如果检测IDH,绝大部分都属于IDH突变型。如果免疫组织化学显示IDH1 R132H蛋白突变以及基因测序IDH1位点132和IDH2位点172基因突变均为阴性,或者单纯基因测序结果为阴性,则该病变诊断为IDH野生型。值得注意的是,尽管对于弥漫型星形细胞瘤,IDH野生型是比较少见的,但是这种诊断需要与更低级别的病变仔细鉴别以免误诊,比如节细胞胶质瘤;而间变型星形细胞瘤IDH野生型也是相当罕见的,绝大部分这种肿瘤将与IDH野生型胶质母细胞瘤的基因改变高度相似。最后,对于弥漫型星形细胞瘤或间变型星形细胞瘤,如果IDH检测没法实现或者完成不好(比如,免疫组织化学显示阴性但缺乏基因测序),导致诊断分别为弥漫型星形细胞瘤,NOS或者间变型星形细胞瘤,NOS。
传统上,WHO II级弥漫型星形细胞瘤和WHO III级间变型星形细胞瘤的预后差别是非常显著的。但是,最近的一些研究提出IDH突变的WHO II级弥漫型星形细胞瘤和IDH突变的WHO III级间变型星形细胞瘤的预后差别并没有那么显著。然而,这一点并没有在所有的研究中受到关注。当前,对于IDH突变和IDH野生型的星形细胞瘤仍然推荐保留WHO分级,虽然在WHO II级和III级星形细胞瘤,IDH突变的预后更佳。对此,2016分类增加了注意标识。
需要注意的是,2个弥漫型星形细胞瘤的变种已从WHO分类中删除:原浆型星形胶质细胞瘤,这个诊断之前的定义含糊,现在几乎不用,因为具有该型组织学表现的肿瘤往往表现为其它更精细的病变;纤维型星形胶质细胞瘤,因为这个诊断几乎与所有标准弥漫型星形细胞瘤重叠。因此,只有与弥漫型星形细胞瘤,IDH突变显著不同的肥胖型星形细胞瘤得以保留。
大脑胶质瘤病作为一个独立的诊断也从2016 CNS WHO分类中删除,而是作为一种生长模式,见于多种胶质瘤中,包括IDH突变的星形细胞瘤和少突胶质细胞瘤以及IDH野生型的胶质母细胞瘤。因此,脑内广泛侵及包括3个或更多脑叶,通常双侧生长和经常突入幕下结构的原先大脑胶质瘤病现在作为多种弥漫型胶质瘤亚型的特殊类型。对于那些不常见的广泛侵润的胶质瘤的生物学基础有待更多的研究。
胶质母细胞瘤
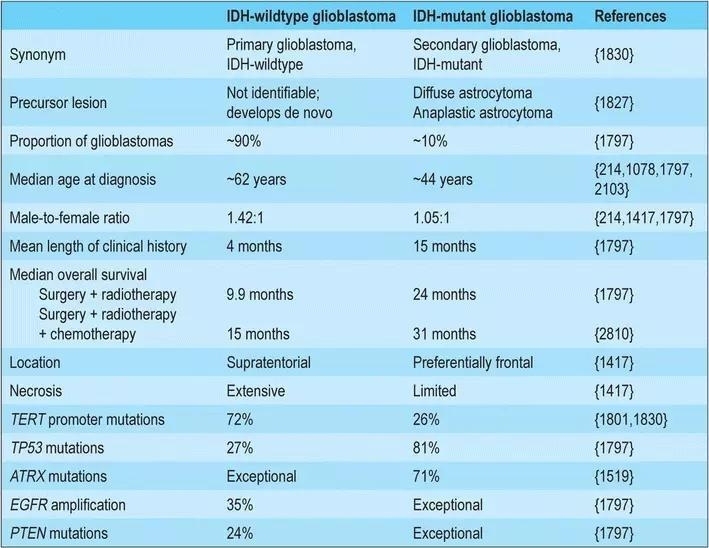
2016年WHO中枢神经系统肿瘤分型将胶质母细胞瘤分为(1)胶质母细胞瘤,IDH-野生型(约占90%的患者),其与临床所定义的原发或新发胶质母细胞瘤相一致,主要发生于55岁以上的患者;(2)胶质母细胞瘤,IDH-突变型(约占10%的患者),其近似于临床所定义的继发胶质母细胞瘤,具有弥漫型较低级别胶质瘤病史且常见于相对年轻的患者;以及(3)胶质母细胞瘤,NOS,特指那些未能对IDH进行全面评价的胶质母细胞瘤。对IDH进行全面评价能够区分老年患者的胶质母细胞瘤、青年患者的胶质母细胞瘤以及WHO Ⅱ、Ⅲ级的弥漫型胶质瘤:对于后者,若R132H IDH1免疫组化染色提示为阴性则强烈推荐行IDH基因测序,然而55岁以上的胶质母细胞瘤患者几乎没有R132H IDH1和IDH2的突变,因此对于此类患者若R132H IDH1免疫组化染色为阴性则无需行IDH基因测序。
增加了一个新的胶质母细胞瘤分型:上皮样胶质母细胞瘤。其在IDH-野生型的胶质母细胞瘤中混有巨细胞样胶质母细胞瘤和胶质肉瘤。上皮样胶质母细胞瘤以大的上皮样细胞为特征,其富含嗜酸性的胞浆,染色质呈泡状,核仁明显(常类似于黑色素瘤细胞),表现出各种不同的横纹肌样细胞(图 2)。
其常见于儿童及青年患者,常表现为大脑皮层或间脑的病变,常含有BRAF V600E的突变(可由免疫组化检测)。一系列横纹肌样的胶质母细胞瘤缺乏INI1的表达从而有别于同样具有上皮样表现的其它肿瘤。IDH野生型的上皮样胶质母细胞瘤同样缺乏传统成人IDH野生型胶质母细胞瘤的相关分子特性,例如EGFR的扩增和10号染色体的缺失;相反其常有ODZ3半合子的缺失。这些病例可能具有相关低级别胶质瘤的病史,其常具有多形性黄色星形细胞瘤的特性(并非全部)。
具有原始神经元成分的胶质母细胞瘤为其另外一种分型。而这种分型之前文献报道被认为具有PNET成分的胶质母细胞瘤,其常由各个级别的弥漫型星形细胞瘤组成(少数病例还具有少突胶质细胞瘤成分),具有界限清楚的结节包含原始细胞并具有神经分化作用(例如,Homer Wright rosettes,突触素呈阳性表达而GFAP表达缺失)而有时具有MYC或MYCN的扩增;这些肿瘤具有全脑全脊髓播散的趋势。其中1/4的患者具有较低级别胶质瘤的病史,该亚组的R132H IDH1在神经胶质和原始神经成分均具有免疫活性。从临床角度来看,对于该类型的认识可能会促使对全脑全脊髓的评估从而排除肿瘤的播散。
仍然具有小细胞胶质母细胞瘤/星形细胞瘤和颗粒细胞胶质母细胞瘤/星形细胞瘤的分型,前者以统一的平淡小细胞为特征,类似于少突胶质细胞瘤,且常具有EGFR的扩增,后者具有巨噬细胞样的颗粒,富含溶酶体的肿瘤细胞。上面这两个例子都具有胶质母细胞瘤样的不良预后,即使病理缺乏典型的微血管扩增或坏死。
少突胶质细胞瘤
少突胶质细胞瘤和间变型少突胶质细胞瘤的诊断需要IDH基因家族突变和1p19q联合缺失证实。当IDH1 R132H免疫组化阳性突变缺失时,需要IDH1 132密码子和IDH2 172密码子测序。当检测缺失或无确切的基因结果时,组织学上典型的少突胶质细胞瘤应诊断为NOS。在没有基因诊断结果的间变型少突胶质细胞瘤,应仔细评估胶质母细胞瘤的基因特征。而且证实儿童组织学与少突胶质细胞瘤相似的肿瘤,往往无IDH基因家族突变和1p19q联合缺失。这些肿瘤在分子水平被更好的认识之前,应该包含在少突胶质细胞瘤,NOS分类里。但应仔细排除组织学表现像毛细胞型星形细胞瘤、胚胎发育不良性神经节细胞瘤和透明细胞室管膜瘤。
少突星形细胞瘤
在2016中枢神经系统WHO分类中,少突星形细胞瘤的诊断存在很大争议。几乎所有组织学特征显示星形和少突2种成分的肿瘤应用基因检测均可分类至星形细胞瘤或少突胶质细胞瘤中的一种。因此WHO II级和WHO III级少突星形细胞瘤的诊断应归为NOS,提示只有适当的分子病理诊断缺失时才能如此。值得注意的是,具有明确少突胶质细胞瘤和星形细胞瘤表型和基因型成分的“真的”少突星形细胞瘤极少在文献中报道。在进一步报道证实这些肿瘤获得作为下一版WHO分类部分的评估之前,均应包含在先前的少突星形细胞瘤NOS或间变型少突星形细胞瘤NOS中。此外在这种背景下,由于辅助技术问题所致的异质性,如ATRX免疫染色假阴性或1p19q联合缺失FISH结果假阳性,需特殊关注来避免误解。
儿童弥漫型胶质瘤
在过去,尽管知道组织学相似的儿童和成人胶质瘤生物学行为不同,儿童弥漫型胶质瘤仍与成人分组相似。儿童弥漫型胶质瘤明确的基因异常使得一些亚型从组织学相似的成人亚型分开。以组蛋白H3基因H3F3A或更为少见的相关HIST1H3B基因K27M突变为特征的一个狭义的儿童原发肿瘤组(偶见于成人),呈弥漫型生长,且位于中线结构(如丘脑、脑干和脊髓)。该新定义的组命名为弥漫型中线胶质瘤,H3 K27M突变以及包含先前提到的弥漫内生型脑桥胶质瘤(DIPG)。这些肿瘤分子表型的鉴别提供了一种对抗这些突变效果治疗方法的理论基础。
其它星形细胞瘤
间变型多形性黄色星形细胞瘤,WHO III级,作为一个明确分型加入2016年中枢神经系统WHO分类,代替过去具有间变特征多形性黄色星形细胞瘤的描述。多形性黄色星形细胞瘤分级为间变型要求每10个高倍镜视野5或更多个有丝分裂像;可能出现坏死,但当没有评估有丝分裂活性时坏死的重要性尚不清楚。与WHO II级多形性黄色星形细胞瘤患者相比,这部分患者生存时间更短。
毛细胞粘液样星形细胞瘤的分级也发生了改变。尽管以前将其分为WHO II级,最近的研究显示在毛细胞粘液样星形细胞瘤和毛细胞型星形细胞瘤存在广泛的组织学和基因重叠,部分前者在一定时间后成熟转变为后者,还有可能的是相比更为经典的鞍上毛细胞型星形细胞瘤,毛细胞粘液型表现为侵袭性更强的进展过程。因为这些原因,是否应该将毛细胞粘液样星形细胞瘤自动的归为WHO II级尚不清楚,在进一步研究清楚他们的生物行为之前建议应降低毛细胞粘液样星形细胞瘤的分级。
室管膜瘤
目前依照现有的WHO标准很难对室管膜瘤进行分级,其临床的应用价值亦值得怀疑,一个能够有效判断预后并具有可重复性的分类及临床分级尚有待探究。因此很难将临床意义反映到室管膜瘤的组织病理分级中,因此在分级章节对室管膜瘤和间变室管膜瘤的组织病理分级进行了讨论。尽管如此,人们期望对室管膜瘤分子特性的进一步研究能够提供更多精确、客观的方法从而对此类肿瘤进行分型,以助于更加确切的定义这些肿瘤。与此同时,一个由基因定义的室管膜瘤亚型已经获得认可:室管膜瘤,RELA融合基因阳性。该变体约占绝大多数的儿童幕上肿瘤。该变体免疫组化染色发现具有特异性的L1CAM表达,但尚有待进一步的阐明。最后,1个室管膜瘤的变体,即细胞型室管膜瘤从经典的分型中被删除,他被认为与标准的室管膜瘤具有广泛的重叠。
神经元与混合型神经元--胶质肿瘤
新命名的分型:弥漫型软脑膜胶质神经元肿瘤,在既往的文献中亦有类似的词组,其中最引人注意的是小儿侵润性少突胶质细胞样的软脑膜肿瘤。这类肿瘤以弥漫的软脑膜疾病为特征,有或没有可辨认的薄壁组织(通常在脊髓),好发于儿童和青少年,组织学发现具有胶质形态的单一透明细胞,类似于少突胶质细胞瘤(图 5),但其除了表达OLIG2和S-100之外还表达突触素。在一部分的病例中可以额外的检测到神经元成分。这些病变常具有BRAF基因的融合以及染色体1p的缺失,同样单独或联合有19q的缺失。然而并不存在IDH的突变。但是到目前为止这些肿瘤的疾病分类尚不明确,一些病理和基因学特性提示其与毛细胞星形细胞瘤或胶质神经元混合肿瘤具有一定关系。该类型患者预后是多变的,肿瘤往往生长缓慢但继发性脑积水的发病率较高。
新近发现其形态学上具有多发结节并有囊泡形成,可能与神经节细胞肿瘤相关。以好发于小脑的多发结节以及囊泡形成为特征。其病变由多发结节以及显著的囊泡组成,肿瘤细胞为神经胶质和/或神经元分化,在部分病例中还具有神经节细胞。要想进一步描述这些疾病就必须理解其在中枢神经系统肿瘤疾病分类中的位置。
髓母细胞瘤
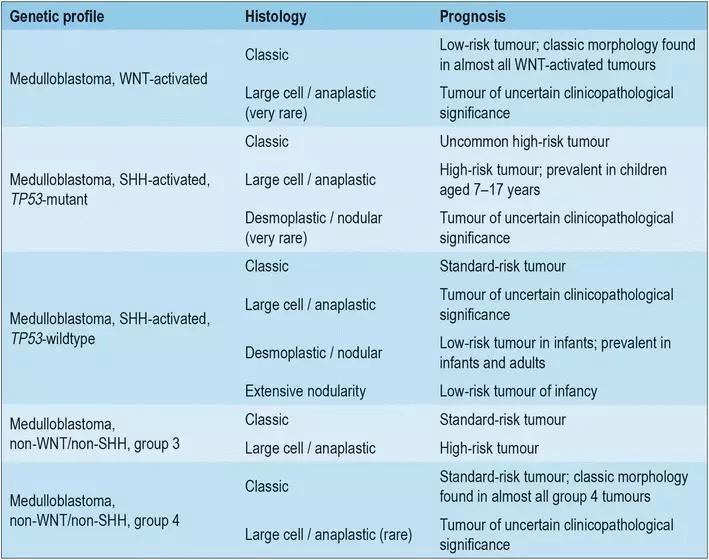
髓母细胞瘤的分型由于联合组织学和分子分型引起最大的概念挑战。临床应用存在长期建立的组织学分型(如促结缔组织增生型/结节型,广泛结节型,大细胞和间变型),而且现在被广泛接受的4种基因亚型:WNT活化型,SHH活化型,组3、组4。这些与组织学和基因亚型相关的预后和治疗存在明显差异。不是提供一长列许多可能的组织学-分子联合体,而是明确的基因定义和组织学定义亚型分类,期望病理学家有能力分子分型从而产生一个包含分子分组和组织学亚型的联合诊断。在这方面,强调存在一个与临床最相关的集成诊断组,见表5。
这种模块和集成方法对诊断是新颖的,随着对肿瘤基因和表型-基因型了解的增加,这可能代表一种更为普遍的方法。可与预见随着知识的扩展这种集成方法使将来的分型有更大的弹性。
其它胚胎源性肿瘤
髓母细胞瘤外的胚胎源性肿瘤在分型上也经历重要改变,将PNET从诊断词条中删除。许多重新分类基于承认许多这些少见肿瘤显示19号染色体(19q13.42)C19MC区域的扩增。C19MC扩增肿瘤包括先前所知的病变如ETANTR(存在大量神经纤维网和真性菊形团的胚胎源性肿瘤,但也包括多层菊形团的神经源性肿瘤)、室管膜母细胞瘤和一些髓上皮瘤。在2016年中枢神经系统WHO分类中,C19MC扩增的出现导致多层菊形团(ETMR)、C19MC改变的胚胎源性肿瘤的诊断。当C19MC扩增的缺失时,组织学特征与ETANTR/ETMR组织学一致的肿瘤应诊断为多层菊形团神经源性肿瘤,NOS,一个具有髓上皮瘤组织学特征的肿瘤应诊断为髓上皮瘤(承认一些明显的真正的髓上皮瘤没有C19MC扩增)。
非典型畸胎样/横纹肌样瘤(AT/RT)现在以INI 1或者非常罕见的BRG1突变来定义。这些突变可以用免疫组织化学检测相应的蛋白来评估,伴有相关基因改变的核表达缺少(需有精确的对照表达)。如果一个肿瘤具有AT/RT的组织学特点但是不具有基因突变,只能描述性地诊断为具有横纹肌样特征的CNS胚胎源性肿瘤;换句话说,AT/RT的诊断需要明确的特征性分子检测。
对于其它胚胎源性肿瘤的理解正在改变,期望分子标记物可以使得这些肿瘤及其亚型的诊断更精确。同时,2016CNS WHO为CNS胚胎源性肿瘤留下了可能是“垃圾篓”类别的分类,即NOS,包括先前诊断为CNS PNET。
神经鞘瘤
中枢神经和外周神经鞘瘤的分类与2007 CNS WHO分类类似,不过还是有一点小的变化。黑色素性神经鞘瘤的诊断区别于传统的施旺氏细胞瘤的依据同时来自临床(显著的恶性表现)和基因学(与Carney复合体和PRKARIA基因有关)。现在把它单独列为一个独立诊断,而不是一个部分。混合神经鞘瘤纳入到2016 CNS WHO分类是因为这种肿瘤在各种各样的组合中越来越多地被认可,正因为如此,这一版的分类中将它列为一个单独诊断,尽管它代表的是一类肿瘤而不是一个单独的分类。最后,2016 CNS WHO制定两种恶性的外周神经鞘瘤(MPNST):上皮型MPNST和MPNST伴神经束膜分化。这些都充分考虑不同的临床因素来进行诊断,其它的亚类如MPNST伴不同的分化仅代表组织学形态。
脑膜瘤
除了增加将脑侵犯作为非典型脑膜瘤的诊断标准外,脑膜瘤的分级没有发生变化。一般来说,出现脑侵犯的WHO-I级脑膜瘤更多地与WHO-II级脑膜瘤存在一样的复发和死亡率。之前的WHO分级将脑侵犯作为一个阶段分类因素而不是分级因素。2016分级中,脑侵犯联合大于4个核分裂像作为组织组织学特征可以单独诊断WHO-II级非典型性脑膜瘤。在过去,非典型性脑膜瘤可以诊断的依据为下列5条中满足3条标准:自发性坏死,片状生长,核仁明显,高密度细胞和小细胞。
孤立性纤维性肿瘤和血管外皮瘤
在过去十年间,软组织病理诊断从界定血管外皮瘤开始进步了很多,在孤立性纤维性肿瘤分类下,神经病理专家保留了血管外皮瘤,这依据于其历史理解和明确的临床病理相关性,如更高的复发率和长期系统转移的风险。尽管如此,孤立性纤维性肿瘤和血管外皮细胞瘤,包括轴内病变,都具有12q13倒置,NAB2和STAT6融合,融合导致了STAT6在核内表达,这可以被免疫组织化学方法检测到。因此如果没有单独的诊断条目,可能孤立性纤维性肿瘤和血管外皮细胞瘤会诊断重叠。由于这个原因,2016 CNS WHO诊断创建了一个联合诊断条目来描述这一类疾病:孤立性纤维性肿瘤/血管外皮细胞瘤。大家认为这个诊断名称比较长,可能会在下一版的指南中简化。
建立一个结合原来低级别的孤立性纤维性血管瘤和高级别的原来是血管外皮细胞瘤的及间变型血管外皮细胞瘤的单一诊断为其它颅内肿瘤的分级提出了挑战。WHO有关CNS分类通常将级别作为恶性程度的标志,它将不同的级别分配到不同的诊断中,而不是将不同的级别放在一个诊断中。为了界定前述的孤立性纤维性肿瘤/血管外皮细胞瘤这一诊断,2016 版WHO CNS诊断打破了既往WHO CNS的传统,将三个不同的级别包含在一个孤立性纤维性肿瘤/血管外皮细胞瘤诊断中:I级对应有更多的胶原,相应较低的细胞密度,有之前类似孤立性纤维性肿瘤的梭形细胞;II级出现较多的细胞,较少的胶原,肥大的细胞和“鹿角”样血管,类似之前诊断的血管外皮细胞瘤;III级,更多的出现之前间变型血管外皮细胞瘤的特征,具有每10个高倍镜下大于5个的核分裂像。尽管如此,以前组织学类似于孤立性纤维性肿瘤的部分肿瘤表现为恶性表型的仍会诊断为WHO-III级,因为它可能在每10个高倍镜下有大于5个的核分裂像。因此更多的研究需要进一步的完善这一分级系统。尽管如此,这种打破CNS肿瘤分级原则的情况,允许CNS肿瘤将来的分级更为灵活,尤其是在分子特征进展的时代。
淋巴瘤和组织细胞性肿瘤
鉴于淋巴瘤和组织细胞肿瘤在过去10年发生的巨大变化,2016 CNS WHO 将这部分肿瘤的诊断与血液淋巴系统WHO分类一致。
【总结】
2016中枢神经系统WHO分类相比2007版的一个明显进步是首次将分子参数应用于脑肿瘤诊断。这给命名法、疾病分类学和报告结构提出挑战,同时下一版的中枢神经系统WHO分型在分型中将掺入更客观的分子数据,当前版本可能回顾作为过渡阶段,2016中枢神经系统WHO分类为这种进步创造了条件。希望这些更客观更精确的分型将促进患者治疗的个体化、更好的临床试验和实验室研究分、更精确的流行病学分类。此外,因为该分类留下一些“垃圾篓”类别的分类,允许更多地研究集中在这些未明确定义的分组从而最终确定这些分型。而且该分型在许多情况下能够在缺乏分子数据时诊断,这些允许分子定义和无分子定义组差异的分型被明确制定。最后,我们相信2016中枢神经系统WHO分类将促进临床、实验室和流行病学研究从而改善脑肿瘤患者的生存。
本文由唐都医院胶质瘤中心 冀培刚,杨晨,刘竞辉 编译,王樑教授审校,转载请注明出处
Ref:Acta Neuropathologica First online: 09 May 2016
(来源:西北胶质瘤中心)




















共0条评论