解读WHO(2014)女性生殖器官肿瘤分类(外阴)
外阴肿瘤在WHO(2014)第4版《女性生殖器官肿瘤分类》[1](简称新版)中位列最后一章;与WHO(2003)第3版《乳腺及女性生殖器官肿瘤病理学和遗传学分类》[2](简称旧版)相比,新版增加了该领域研究的最新进展,简化及重新命名一些疾病,用二分法的鳞状上皮内病变(squamousin traepitheliallesion,SIL),代替旧版的外阴上皮内瘤变(vulvar intraepithelialneoplasia,VIN)系统,并与非 HPV感染相关的外阴SIL———分化型外阴上皮内瘤变(differentiated typevul varintraepithelialneoplasia,dVIN)分开。将皮肤附属器肿瘤整节删除,使之结构更合理,内容更充实。本文现介绍新版外阴肿瘤的主要变化,为临床病理医师认识新增病种提供参考。
1、新版结构与主要内容变化
与旧版不同,新版按恶性肿瘤在前,良性肿瘤在后排序。将旧版鳞状上皮肿瘤及其相关病变和前驱病变中的“相关病变”删除。鳞状细胞癌中删除“角化棘皮瘤样”、“伴有肿瘤巨细胞的”及“其他”三个亚型。与子宫颈一样,采用SIL替换VIN系统,以VIN作为别名,保留dVIN名称,并作为SIL新的亚型。良性鳞状上皮病变栏目下,将纤维上皮性息肉(fibroepithelialpolyp,SP)改为“上皮间质息肉(fibroepithe lialstromalpolyp,FSP)”;删除翻转性毛囊角化病。腺上皮肿瘤及癌前病变中删除“小细胞癌”及“移行细胞癌”。上皮性肿瘤中新增神经内分泌肿瘤(neuroendocrinetumour,NET)一个分类,与子宫颈不同,无低级别所列类癌及非典型类癌,将上述小细胞癌改为小细胞神经内分泌癌(smallcell neuroendocrinecarcinoma,SCNEC),与大细胞神经内分泌癌(largecellneuroendocrinecarcinoma,LCNEC)一起并列为高级别,同时将旧版其他肿瘤”栏目下的Merkel细胞肿瘤(Merkelcelltumour,MCT)也归于其下。旧版删除“其它肿瘤”一个大项,包括卵黄囊瘤、表皮样囊肿及成熟性囊性畸胎瘤;同时新增一个大项为生殖细胞肿瘤,仅将原先其它肿瘤中的卵黄囊瘤保留。上皮性肿瘤中将与鳞状上皮肿瘤及腺体肿瘤并列的皮肤附属器肿瘤,包括:恶性汗腺肿瘤、皮脂腺癌、汗管瘤、结节状汗腺瘤、毛发上皮瘤(trichoepithelioma,TE)、外毛根鞘瘤及其他,进行整体删除。新版将皮肤隆突性纤维肉瘤的ICD O编码由8832/3改为8832/1,即由恶性改成中间型(罕见转移);将侵袭性血管黏液瘤(aggressive angiomyxoma,AAM)的ICD O编码由8841/1改为8841/0,即由交界性改成良性,以与软组织肿瘤分类相一致[3]。将旧版淋巴组织和造血组织肿瘤中的恶性淋巴瘤(特殊类型)及白血病(特殊类型)中的“恶性”及括号内的“特殊类型”取消,用髓系肿瘤代替白血病。以上变化即恢复了WHO(1994)第2版[4]的一些结构和术语,并融入了新进展。
2、新增病种
新版不仅改换了部分病变名称,而且还增加了新的内容。
2.1 SIL 外阴SIL常为女性下生殖道HPV相关性病变区域反应的一部分,因其浅表或直观而易于发现,超过30%的病例可与阴道和(或)子宫颈的类似病变共存,呈多点或多中心源性发病,故检测 HPV并分型很有必要,同时应提示临床及时检查阴道及子宫颈,以免漏掉隐秘性病变。与子宫颈及阴道一样,新版取消模棱两可的灰区状态,将SIL分为低级别鳞状上皮内病变(low gradesquamousintraepithelialle sion,LSIL)及高级别鳞状上皮内病变(highgradesquamous intraepitheliallesion,HSIL)。LSIL的同义词为VIN1级、普通型VIN1级、轻度鳞状上皮异型增生、扁平湿疣、非典型挖空细胞、挖空细胞形成。而HSIL的同义词为VIN2级、VIN3级、普通型VIN2级、普通型VIN3级、中度鳞状上皮异型增生、重度鳞状上皮异型增生、原位癌、Bowen病、鲍温样异型增生。随着时间推移及研究的进展,同义词经历了变化。
1976年,国际外阴疾病学会(InternationalSocietyforthe StudyofVulvarDisease,ISSVD)将外阴癌前病变分为外阴非典型及外阴原位癌[5],现在看来,分别相当于新版分类中的LSIL及HSIL。1986年ISSVD学会根据病变细胞成熟度、核异型性、成熟障碍及有丝分裂活跃性,分为VIN1~3级[6],类似于子宫颈上皮内瘤变(cervicalintraepithelialneoplasias,CIN)的1~3级,随后被WHO(1994)第2版分类采纳。2004年ISSVD重新进行修订[7]:(1)VIN1级不再使用;(2)VIN2、3级之间因病理诊断中常有交叉,可重复性差,不再进行区分;(3)新的VIN定义仅指高级别VIN病变(VIN2/3级),与HPV感染相关者命名为普通型VIN(usualtypeVIN,uVIN),包括疣型、基底样型和混合型;与HPV感染不相关者命名为dVIN;外阴Paget病等其他不能归入上述两类的 VIN病变而归入未分类型VIN或VIN非特殊型;(4)分类仅基于形态学标准进行,而非临床表现及HPV分型。2012年美国病理学会(CollegeofAmericanPathologists,CAP)和美国阴道镜及子宫颈病理学会(AmericanSocietyforColposcopyand CervicalPathology,ASCCP)联合发表下生殖道 HPV相关的鳞状病变命名标准化计划[8](简称 LAST计划),将外阴SIL进一步简化,分为HSIL及LSIL两级,随后被WHO采纳并加入dVIN。旧的分类几经修订[5-11],部分至今仍为临床及病理所用,但与新版衔接尚需时日。
LSIL被定义为由HPV感染导致的、在临床和形态学上表现为SIL,它们复发和转化为恶性的风险较低,常见于育龄期妇女,病变呈斑疹、丘疹或出现过度角化。镜下示上皮增生,核大小形态不一,角化不全、过度角化和各种非典型挖空细胞均可见。一些病变类似脂溢性角化病,而另一些呈现凋亡。一些表达p16,但只有呈连续线性水平染色而不是垂直累及基底细胞层,即大块阳性才被考虑为阳性,而单个细胞微弱或斑片状染色均应视为阴性。对于年轻患者具有湿疣的其他特征而缺乏挖空细胞形成的病变,称为没有细胞病变效应的湿疣,可借助于 p16及 Ki67进一步检测以明确病变,绝大多数病变维持原状,甚至可逆,建议随访或观望。
HSIL本质上为克隆性增生,如果不予治疗有发展为浸润性癌的风险。外阴HSIL多见于绝经期前妇女,与HPV(尤其HPV16型)感染密切相关,使发生子宫颈癌或肛管肿瘤的概率增加3倍。醋酸白实验阳性或出现色素沉着,2/3多为灶性。年轻妇女出现小的多发性色素沉着,临床上往往伴鲍温样丘疹病。大体表现为斑疹、丘疹或尖锐湿疣。镜下可见HPV感染后细胞各种病变效应:上皮胞核深染,拥挤,核形态大小不一,形成棘皮症,出现角化不全及角化过度。1/3累及皮肤钉突,类似浸润。根据成熟程度区分亚型,基底样型及湿疣型均被认为是高级别。年老患者和病变范围较大及临床症状明显者,与癌伴发的危险度增加 20%,甚至可进展为浸润性癌。由于活检小标本随机包埋可能出现“平切头”现象,难以确定浸润,应首先厘清其表皮面及基底面,尽量立起包埋。VIN3/HSIL若出现上皮广泛受累、异型性显著、角化珠、坏死以及新生血管,常提示为早期(微小)浸润,但外阴鳞状细胞癌不推荐使用“微小浸润性癌”一词,根据疑症从无原则,多个切片经深切仍然不能肯定有无浸润者,应归于前驱病变,而非浸润性癌。当间质未能显示,难以确定是否真的发生浸润,则推荐使用“至少 HSIL,浸润癌不能排除”这样的描述性术语。SIL的治疗措施包括手术切除、激光消融或药物治疗,如外用15%的咪喹莫特。复发病例常与吸烟、病变范围广及切缘阳性有关,若切缘累及,约50%病例复发。
2.2 dVIN 与uVIN相对应,dVIN为新版中唯一保留瘤变(neoplasia),而不是病变(lesion)的特例。由于其分化程度较高,易被漏诊[12]。dVIN常伴鳞状上皮增生及硬化性苔藓[12,13],相互重叠。镜下表皮通常增厚,伴角化亢进,病变上皮体积大,细胞间桥清晰,胞质丰富、嗜酸,核大小相对一致,核染色质粗糙,基底细胞呈现非典型伴核深染,出现巨核及显著的核仁,基底层细胞可见非典型核分裂、异常角化及拉长,与表皮突吻合。终末分化往往视为正常,但角化不良和单个细胞内角化均为异常。异型细胞反向角化,局限于上皮基底层或靠近之,可见角化不良细胞、有时有角化珠形成、上皮间海绵状水肿、真皮纤维组织增生、胶原化、慢性炎细胞浸润。基底和副基底层 Ki67染色明显,但不像 uVIN那样扩展至整个上皮层。p16染色呈阴性(仅弱阳性或斑片状显色)。尽管 p53可阳性,但变化较大,仅用于辅助诊断(表1)。
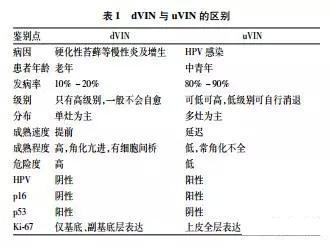
此外,dVIN易与鳞状细胞增生(squamouscellhyperplasia,LSC)混淆[13],后者细胞分层不清,呈非典型。LSC常见角化亢进的白色病变及鳞屑。镜下棘层肥厚,上皮脚下延,但表皮层次有序,渐进成熟,核均匀一致,无异型,常见过度角化,有时伴角化不全及颗粒层过度增生,增厚的表皮突呈杵状或尖刺,可融合。真皮有不同程度的炎细胞浸润及水肿。而dVIN通常表皮突伸长、出现分支,具有明显的细胞间桥,基底层及副基底层可见过早角化细胞,即反向成熟,网脊内常有角蛋白形成及角化珠样改变,棘细胞层的鳞状细胞出现增大的泡状核、核仁突出。dVIN常表达p53,LSC不表达p53。
2.3 前庭乳头状瘤 新版取消乳头状瘤病的附加说明,既然简化也是一种变化,其同义词前庭乳头状瘤病、阴唇微乳头状瘤病或生殖器珍珠样丘疹病更能体现其特点:病变局限于处女膜环或前庭区域,多发,比尖锐湿疣的小而矮钝,表面光滑。该病与 HPV感染无关[14],有人甚至认为是正常解剖所见[15]。与尖锐湿疣相比,可总结为以下5点:无复杂的乳头状分支、无棘层肥厚、细胞无非典型性、无挖空细胞形成、无p16表达。
2.4 恶性叶状肿瘤 起源于特化性肛门生殖腺,而非异位乳腺,但要除外转移性[16]。大体与纤维腺瘤相似,但叶状生长方式更明显。镜下由高低不同级别的乳腺样导管上皮及占主体地位的分叶状间质构成,导管周富于细胞,核分裂多见,带状分布,可突入腺腔。分级取决于间质的丰富程度及细胞非典型性,形成的肿块与邻近正常组织存在推挤式边缘,可复发[17],但若局部完整切除,预后较好[17,18]。
2.5 混合瘤 新版取消限定词外阴,又称为多形性腺瘤或软骨样汗腺瘤,形态类似涎腺同名肿瘤。一般无症状,典型病变表现为界限清楚的黏膜下肿物。大体界限清楚,灰白色,质软或韧。镜下双向分化,上皮成分埋置于黏液样、软骨样或骨样基质中,形成分支状小管,也可见实性上皮索或上皮岛。有的向毛囊分化;有的细胞发生透明或玻璃样变,类似浆细胞,但 CK、EMA均呈阳性;有的以梭形细胞成分为主,但细胞无异型和核分裂。多结节状生长或切除不完整者可复发[1,19]。
2.6 NET 其是一种显示神经内分泌分化的高级别癌,定义为外阴不存在低级别的类癌及非典型类癌,该点与宫体不同。新版独立成节:将旧版腺体肿瘤栏目下的小细胞癌纳入,更名为SCNEC;将形态及免疫表型一致而细胞体积较大者命名为LCNEC,并列其后;同时将旧版“其他肿瘤”栏目下的MCT归入并更名为 Merkel细胞癌(Merkelcellcarcinoma,MCC)。SCNEC的同义词为小细胞癌、燕麦细胞癌或神经内分泌癌3级,小细胞型;而LCNEC的同义词为神经内分泌癌3级,大细胞型。外阴是否真的存在非 Merkel细胞型的SCNEC,已经受到质疑。MCC发病率随年龄增长而增加,HIV阳性和器官移植的患者发病率更高,常表现为皮肤结节、表面形成红斑或溃疡。可累及局部淋巴结,同时合并SIL(VIN)或鳞状细胞癌。MCC主要位于真皮内,可有出血、坏死区,临近表皮可出现溃疡及硬结[20]。镜下MCC呈多向分化模式,分为肺型及非肺型两种,后者又称为经典型,细胞小圆形至多角形,伴空泛的胞质和苍白的核,染色质细腻,具有小核仁。可有腺样或鳞状分化,毗邻鳞状上皮可见佩吉特样(Paget like)播散。瘤细胞表达多种角蛋白,如CAM5。2、CK20及CK(AE1/AE3),核旁胞质呈点状表达,还可表达NSE和CD56,一些病例CgA和Syn均呈阳性,但并非全部。大多数CD117呈阳性,而HMB-45、S 100蛋白、TTF 1和desmin均呈阴性。
2.7 尤因肉瘤(Ewing’ssarcoma,EWS) 一般认为起源于节后胆碱能神经元或神经脊。新版中删除曾并列使用外周原始神经外胚层肿瘤(peripheralprimitiveneuroectodermal tumour,PNET),转为同义词使用,这点与宫体及子宫颈不同,因为宫体及子宫颈只留EWT,而将PNET删除。旧版将EWS定义为位于中枢神经系统以外的胚胎性肿瘤,由未分化或低分化的神经上皮细胞构成。新版定义其临床病理特点:软组织恶性肿瘤,一般由小圆细胞构成,不同程度显示神经内分泌分化,多数情况下发生染色体t(11;22)(q24;q12)转位。EWS大体表现为质软的皮下结节或息肉状肿块,切面呈大小均匀一致的结节或呈分叶状,可见坏死区,无包膜,与周围正常组织边界不清。镜下由小圆蓝色细胞组成,可呈片层状或实性密集排列,也可呈条索状、菊形团或假菊形团,胞质稀少,核深染,可见圆形核仁,染色质分散,细颗粒状。可表达CK、CD99(胞膜阳性)及Fli 1,弥漫表达vimentin,但不表达desmin。90%的患者可检测到EWSFLI1融合基因,EWS预后极差,多发生肺转移,但经完整手术切除及辅助化疗,也有长期存活(超过3年)的报道[21]。
2.8 FSP FSP可能起源于女性生殖道远端具有激素依赖性的上皮下间质细胞,以边界不清的息肉状间质增生为特征,伴不同程度鳞状上皮增生,中央形成纤维血管轴心。典型者由形态温和的梭形细胞构成,伴纤细的单极或双极胞质突起,星状或多核间质细胞较醒目,常出现于上皮 -间质交接区或围绕中心血管。大体表现为孤立性、息肉状或带蒂病变,直径通常<5cm。切面水肿样,灰白色,质软。其又称为皮赘、软纤维瘤、软垂疣及纤维上皮性息肉(fibroepithelial polyp,SP),后者为旧版别称[2],新版进行调换,将其作为正式名称使用,此种改变很有新意。事实上,FSP除了纤维外,还有脂肪、血管等,有时较大病变中脂肪组织丰富,貌似皮肤脂肪瘤;若集中分布于皮区,可误认为脂肪瘤样痣;有时瘤体较大,表皮过度角化,表面粗糙或形成丝状乳头,易与巨大尖锐湿疣混淆。FSP与 HPV感染无关,上皮缺乏棘层肥厚,无挖空细胞形成,不具有形成 SIL的潜能,但如果手术切除不完整,可复发。怀孕期间病变常加重,又称为妊娠性息肉,间质细胞可出现显著核的多形性、核染色增多及特别的核分裂活性,并不影响其生物学行为。
2.9 浅表肌纤维母细胞瘤(superficialmyofibroblastoma,SMF) SMF是一种成年妇女不常见的良性肿瘤,可能起源于子宫颈、阴道乃至外阴独特的间质细胞层。大多数病例表现为外阴单侧无痛性包块[22]。据报道,与使用他莫西芬和激素替代治疗有关。大体通常为卵圆形或结节状,切面白色,质硬。镜下肿瘤位于皮下或黏膜下,有薄层纤维性假膜,细胞呈卵圆形、星芒形或梭形,伴波状核及空泛的胞质。间质富含大量纤细而致密的胶原纤维。中央血管聚集,壁薄,扩张,常呈鹿角状。核分裂、坏死、细胞异型性及正常结构陷入其内均不可见。免疫组化检查示细胞表达 vimentin、desmin和CD99,不同程度表达CD34、ER及PR,但不表达SMA。SFM与浅表性血管黏液瘤(superficialangiomyxoma,SAM)均浅表生长,容易混淆。与血管肌纤维母细胞瘤(an giomyofibroblastoma,AMF)相比,SAM边界不清,肿瘤一般无包膜,血管数量较少,细胞稀疏围绕血管少见,但肿瘤内上皮细胞陷入及中性粒细胞浸润较常见。
2.10 AMF 外阴AMF临床少见,起源于具有肌纤维母细胞分化能力的间质细胞,为良性非复发性肿瘤。大体呈无痛性包块,貌似Bartholin囊肿,通常较小,直径一般<5cm,边界清楚,状如橡皮,质地软,实性,切面灰褐色。镜下病变细胞较丰富,由间叶细胞和血管两种成分组成。细胞密集区与疏松区交替出现,肿瘤由多角形上皮样细胞及小梭形细胞构成,倾向于簇状围绕大量薄壁、管腔中等大小到毛细血管样的血管。细胞异型性小,核分裂少,间质疏松,含有肥大细胞。可见病变内脂肪组织,当肿瘤以脂肪为主时,被称为脂肪瘤样变异型[23,24]。肿瘤细胞vimentin、desmin、ER和PR均呈阳性,CD34呈阴性。梭形或星形细胞无明显异型性,缺乏坏死。富于细胞性血管纤维瘤(cellularangiofibroma,CAF)是新近描述的一种外阴良性肿瘤,与AMF共享某些形态特征,需鉴别二者。与SMF相比,CAF直径较小,一般<3cm,密集的梭形细胞形态单一,血管数量较多,分布均匀,双核或多核细胞罕见,desmin呈阴性。
2.11 AAM 肿瘤位置较深,旧版又称深部血管黏液瘤。病变体积较大,边界不清,不规则向周围组织扩展。大体呈胶冻状、橡皮样或均匀一致的黏液样,有的病例具有更加明显的纤维样外观。镜下肿瘤细胞稀疏,细胞小而淡染,具有卵圆形或短梭形的核,胞质不清。偶尔呈星芒状,散布于丰富的黏液样基质中,一般缺乏核分裂及核异型。常见红细胞外渗,大量各种口径的血管从薄壁毛细血管到中等大小血管,再到具有厚壁平滑肌的大血管均可见。一些病例从厚壁大血管发出呈放射状排列的管周平滑肌纤维。肿瘤周围呈浸润性生长,边缘区脂肪组织及横纹肌陷入其中,但缺乏坏死,细胞异型性及核分裂。AAM可能起源于女性下生殖道具有激素受体阳性的皮下间质细胞,来自肌纤维母细胞肿瘤家族。治疗方法以外科手术为主,需完整局部切除,若初次切除不彻底,病变具有显著的局部复发倾向。恰如其分的局切也许较困难,因为肿瘤扩散范围远比术前估计的广泛。对不宜手术切除的病例可采用促性腺激素释放激素激动疗法,或许能使肿瘤变小而易切除。新版将AAM从交界性转变成良性,是否与其生物学行为一致,尚待观察。但AAM与AMF必须区分,因为二者预后明显不同(表2)。
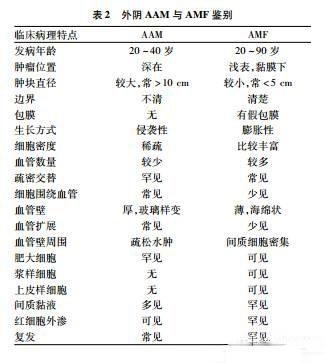
AAM与SAM鉴别并非仅在部位深浅,前者肿块较大,常>10cm,弥漫无边界,仅累及真皮或皮下,1/3含上皮成分,间质缺乏中性粒细胞,复发率高;后者直径1~5cm,常累及皮下深层,肿瘤呈多结节状,间质常见中性粒细胞,但不含上皮成分,复发率低。
2.12 横纹肌肉瘤 新版中横纹肌肉瘤代替葡萄状肉瘤,并列举两个常见亚型:胚胎性及腺泡状。二者desmin均可阳性,有时核灶性表达myogenin及 MyoD1。胚胎性横纹肌肉瘤通常发生于10岁以下儿童,外阴可见息肉状肿块伴出血或溃疡。有时呈葡萄状外观,但远比原发于阴道者少见。低倍镜下肿瘤细胞疏密交替,紧邻鳞状上皮可见细胞丰富的形成层,与皮肤或黏膜面平行浸润,由密集排列的未分化细胞组成,具有小而深染的核及普遍空泛的胞质,部分相对丰富,嗜酸性,偶见胞质横纹。腺泡状横纹肌肉瘤患者发病年龄较大,肿瘤细胞呈巢状生长,被纤维性间隔分开或围绕血管呈乳头状,巢团中央细胞自由漂浮,而边缘区域黏附于纤维性间隔上。
2.13 上皮样肉瘤 其组织起源不明,由大的上皮样细胞组成的恶性间叶性肿瘤常围绕坏死区形成肉芽肿样结构。新版将其简化,取消近端二字,将旧版名称近端型上皮样肉瘤作为同义词使用。肉眼观察直径<6cm,切面常呈灰白色多结节状,常累及皮下软组织。镜下肿瘤细胞较大,胞质丰富、嗜酸,核偏位,空泡状,核仁明显,横纹肌样包涵体常见。肿瘤细胞通常表达CK、EMA及 vimentin,约50% CD34呈阳性,偶尔表达actin、desmin。
2.14 Kaposi肉瘤 属于罕见的血管内皮增殖性恶性肿瘤,可能起源于血管或淋巴管内皮,呈多中心性,又称为皮肤特发性多发性色素性肉瘤、多发性血管肉瘤或多发性出血性肉芽肿。与单纯疱疹病毒8(HHV 8)感染密切相关。常发生于下肢皮肤,也可累及淋巴结及内脏。根据临床与流行病学特征,分为以下4型[3]:(1)经典型惰性Kaposi肉瘤,主要发生于地中海、东欧或犹太裔老年男性;(2)地方性非洲Kaposi肉瘤,主要发生于中非地区无 HPV感染的中年人及儿童;(3)医源性Kaposi肉瘤,主要发生于器官移植者或大量使用免疫抑制剂治疗的患者;(4)艾滋病(acquiredimmunodefi ciencysyndrome,AIDS)相关的Kaposi肉瘤,好发于伴HIV感染的同性或双性恋男性,该型进展最快,预后最差。发病于外阴者与其他部位一样,皮肤病变呈紫红或棕红色斑块或结节,伴皮肤溃疡或形成融合性出血性结节,但位于真皮层,若认识不足可引起误诊[25]。镜下主要可见异型血管增生、嗜酸性梭形细胞及炎细胞浸润,红细胞外溢、含铁血黄素沉积及玻璃样小体形成。按病变进展可大致分为4期:Ⅰ期为早期,皮肤病变轻微,仅为微血管增生;Ⅱ期为斑点期,血管数量增加,与表皮平行排列,形状不规则,将真皮胶原纤维分隔,周围淋巴细胞、浆细胞浸润,含铁血黄素沉积,少数病例可见淋巴管瘤或血管瘤样区域,真皮乳头无累及;Ⅲ期为斑块期,血管增生更为明显,病变弥漫而广泛,血管周围嗜酸性梭形细胞增生,管腔轮廓呈锯齿状,炎细胞浸润,大量红细胞外渗、含铁血黄素沉积和玻璃样小体形成;Ⅳ期为结节期,肿瘤由网状或裂隙状毛细血管及其周围交错排列的嗜酸性细胞构成,出现境界清楚的结节,梭形细胞有一定的异型,核分裂偶见,其间可见红细胞及透明小体,间质见淋巴细胞、浆细胞及含铁血黄素。组织变异型包括间变性、血管内及淋巴瘤样。淋巴结内 Kaposi肉瘤可呈单个或多个结节,早期病变表现为淋巴窦内血管数量增多伴浆细胞浸润,后期完全被肿瘤组织破坏,失去正常结构。发生于实质脏器者,病变常沿血管结构扩展至周围实质。肿瘤细胞常表达CD31、CD34或D2 40,HHV 8呈不同程度的核阳性。
2.15 纤维肉瘤 由密集的肿瘤性梭形细胞构成,排列纵横交错,常呈特征性的人字形或鲱鱼骨样,胞质少,分界不清,核两端渐细,深染。与其他部位的同名肿瘤一样,除了形态特点外,可借助于免疫组化,排除性诊断而确立。
2.16 淋巴瘤 旧版淋巴瘤称为恶性;新版取消“恶性”,将其定义为由淋巴细胞组成的恶性肿瘤,可原发也可为转移性。表现为结节、外阴肿胀、瘙痒或硬化。结节位于完整或形成溃疡的皮肤或黏膜下。多种组织学类型均有报道,但最常见的是弥漫性大 B细胞淋巴瘤。多为侵袭性,预后不良。
2.17 髓系肿瘤 旧版名为白血病。临床上,髓系肿瘤(粒细胞肉瘤、绿色瘤或髓外髓系肿瘤)常表现为肿块,形成所谓的实体瘤,即肉眼可见的疾病或病种。与眶周一样,外阴组织疏松,易于发病,可伴或不伴累及阴道及子宫颈。肿瘤细胞一般染色质细腻,具有丰富的强嗜酸性胞质,若发现嗜酸性粒细胞有助于诊断。MPO及溶菌酶均呈阳性,有助于与淋巴瘤等其他蓝色小圆细胞肿瘤鉴别。
3、一些易混淆疾病的诊断问题
新版保留基底细胞癌(basalcellcarcinoma,BCC),而整节删除包括 TE在内的皮肤附属器肿瘤。BCC与TE均由栅栏状排列的基底样细胞巢组成,易混淆[26]。若将BCC误诊为TE,可因切除范围过小、治疗不足导致病变复发;同样,如将TE看成BCC,可因切除范围过大、治疗过度造成器官功能障碍,鉴别诊断非常重要。尽管存在争议,WHO将TE与毛母细胞瘤合并,作为其同义词,隶属于伴毛囊分化的良性肿瘤,共享ICDO编码:8100/0。一般认为,TE已经向毛源性终末分化,大多位于真皮浅层,部分与表皮相连,角质囊肿常见,中央角化突然而完全;而毛母细胞瘤常位于表皮和皮下组织内,与表皮不相连,含有丰富的毛源性间质成分,作为母细胞性肿瘤,分化较为幼稚。镜下毛母细胞瘤形成毛胚芽或向毛囊方向分化,发育顿挫。基底细胞条索、巢团及其伴随间质常形成毛乳头。其他名称:毛母细胞纤维瘤,强调其丰富的特化性纤维间质;毛源性毛母细胞瘤表明其组织起源;成釉细胞瘤样毛母细胞瘤,突出其栅栏状排列特点;毛胚瘤,指出其分化方向及特点;硬化性上皮错构瘤,形容其异质性及多形性,呈多向分化;淋巴腺瘤,着眼于显著的淋巴细胞浸润并形成结节;至于以先驱者名字命名的BrookeFordyce病及BrookeSpiegler病作为综合征,常形成特征性的多发皮肤丘疹。BCC亚型繁多,临床上多出现糜烂或环堤状溃疡,与表皮有联系,不对称浸润性生长,细胞异型性、核分裂及坏死多见,细胞巢与间质之间有黏液样基质,裂隙明显;而 TB常呈结节状,膨胀性对称性生长,边界清楚,小叶样或器官样结构比较明显,有毛球或毛乳头特有结构,瘤细胞团推挤周围皮肤附件,形成衣领样,细胞大小较一致,形态温和,核分裂罕见,无坏死而角化物明显,细胞巢周边有基膜,边缘与间质分离空隙少见,缺乏黏液,有时可见 Merkel细胞样细胞。BCC多表达CD10、CK6[27],Ki67高表达;而毛母细胞瘤则相反。
4、存在的问题
湿疣状癌与疣状癌易混淆。二者生物学行为及预后不同,治疗方法也有差异,但新旧版具有相同的ICDO编码:8051/3,建议分开。疣状癌干燥,表层过度角化,无纤维血管轴心,细胞形态温和,胞质丰富,核异型性小,无挖空细胞。边缘清楚,宽大球状钉突呈推进式生长。可复发,但罕见转移。湿疣状癌表面湿润,类似湿疣或鲍温病,融合成片,可见纤维血管轴心,细胞较大,融合的乳头峡部或表层可见典型挖空细胞,核分裂多见。瘤巢轮廓不规则,基底部呈明显浸润性生长。与疣状癌相比,预后明显较差。
腺体肿瘤栏目下其他类型腺癌中的肠型腺癌及汗腺型腺癌,具有相同的ICDO编码:8140/3,应及时分开单独编码。
新版将原先ICDO编码为8826/0的 SAM改为ICDO编码为8841/0,与AAM相同,而他们的生物学行为不同,建议将其分开。否则,鉴于互有重叠或形成一个谱系,像胃肠间质瘤那样,干脆进一步简化,将外阴SMF、SMF、CAF、AMF及AAM全部合并,总称为良性生殖道间质瘤[28]或黏液血管纤维瘤,不仅方便形态学诊断,而且有利于临床处理。
生殖道型非典型性黑色素细胞痣及异型增生性黑色素细胞痣的ICDO编码分别为8720/0及 8727/0,是否与其名称所表述的一样,应属于交界性而非良性,应引起临床重视,密切观察,防止将分化良好的恶性黑色素瘤误诊为痣。
皮肤癌及恶性黑色素瘤均有各自单独的TNM分期,同样适用于外阴,但外阴解剖及功能独特,缺乏明显的颗粒层,即使是薄层肿瘤亦可发生转移,故建议按照新版TNM或CAP推荐的方法处理,本文补充旧版删除的皮肤黑色素瘤Clark水平分级及Breslow厚度测量以便查询(表3)。

Breslow厚度测量从被覆表皮的颗粒层下方至肿瘤浸润最深处的距离。厚度 <0.76mm的黑色素瘤转移潜能很小或无病理报告中应包括:(1)浸润深度;(2)肿瘤厚度;(3)肿瘤浸润深度和厚度的测量方式;(4)有无血管浸润;(5)肿瘤直径,若有临床测量直径,应包括在内。
5、WHO/FIGO肿瘤 TNM分期与 CAP相关内容的衔接问题
外阴癌TNM/FIGO分期被新版WHO采纳[1]。CAP外阴癌标本检查指南也已发表,前者侧重临床,后者突出病理。新分期中I期病灶局限于外阴,Ⅱ期侵犯邻近器官,Ⅲ期有淋巴结转移,Ⅳ期有远处转移,为治疗提供科学依据。治疗主要是为了缓解症状,去除病灶,防止恶性转化,同时尽可能地保护外阴的解剖完整性和功能,由于VIN发病趋于年轻化,为保存器官的生理功能,其外科处理也趋于保守。手术方式以局部切除为主,包括:Mohs显微术[29]、削皮式外阴切除、病灶局部扩大切除和单纯外阴切除等,各自具有严格的手术适应症,在此不一一赘述。
外阴作为生殖系统终端,内藏尿道及阴道,经会阴毗邻直肠,四周环绕皮肤,解剖结构复杂,肿瘤种类繁多,是妇科、皮肤科和泌尿科医师共同关注的部位。不同病变处理各有差异,为采取个体化治疗,诊断细节非常重要。与旧版相比,新版简明阐述了所列疾病的临床病理特点,通过学习与解读,力求掌握其精髓,继承与发扬并举,有望早日用于临床实践。
参考文献
[1]Kurman R J,Carcangiu M L,Herrington C S,et al。WHO classi-fication of tumours of female reproductive organs[M]。4th ed。Ly-on:IARC Press,2014:228-53。
[2]Tavassoli F A,Devilee P。The World Health Organization classiffi-cation of tumors:pathology&genetics of tumour of the breast and female genital organs[M]。3rd ed。Lyon:IARC Press,2003:313-3。
[3]Fletcher C D M,Bridge J A,Hogendoorn P C W,et al。WHO classification of tumours of soft and tissue bone[M]。Lyon:IARC Press,2013:170-2。
[4]Scully R E,Bonfiglio T A,Kurman R J,et al。World Health Organization international histological classification of tumours:histological typing of female genital tract tumours[M]。NewYork:Springer Verlag,1994:13-31。
[5]diPaola G R,Friedrich E G Jr。The international society for the study of vulvar disease。A brief history[J]。Int J Gynaecol Obstet,1976,14(6):565-6。
[6]Ridley C M,Frankman O,Jones I S,et al。New nomenclature for vulvar disease:international society for the study of vulvar disease[J]。Hum Pathol,1989,20(5):495-6。
[7]Sideri M,Jones R W,Wilkinson E J,et al。Squamous vulvar intraepithelial neoplasia:2004 modified terminology,ISSVDvulvar oncology subcommittee[J]。J Reprod Med,2005,50(11):807-10。
[8]Darragh T M,Colgan T J,Cox J T,et al。The lower anogenital squamous terminology standardization project for HPV-associated lesions:back ground and consensus recommendations from the college of American pathologists and the American society for colpos copy and cervical pathology[J]。Arch Pathol Lab Med,2012,136(10):1266-97。
[9]Medeiros F,Nascimento A F,Crum C P。Early vulvar squamous neoplasia:advances in classification,diagnosis,and differential diagnosis[J]。AdvAnat Pathol,2005,12(1):20-6。
[10]Lynch P J,MoyalBarracco M,Scurry J,et al。2011 ISSVD Terminology and classification of vulvar dermatological disorders:an approach to clinical diagnosis[J]。JLow Genit Tract Dis,2012,16(4):339-44。
[11]Reyes M C,Cooper K。Anupdate on vulvar intraepithelial neoplasia:terminology and a practical approach to diagnosis[J]J Clin Pathol,2014,67(4):290-4。
[12]van de Nieuwenhof H P,van Kempen L C,Massuger L F,et al。 Differentiatedtype vulval intraepithelial neoplasia has a highrisk association with vulvar squamous cell carcinoma[J]。Int J Gynecol Cancer,2010,20(1):194-5。
[13]van de Nieuwenhof H P,Bulten J,Hollema H,et al。Differentiated vulvar intraepithelial neoplasiais often found in lesions,previ ously diagnosed as lichens clerosus,which have progressed tovulvar squamous cell carcinoma[J]。Mod Pathol,2011,24(2):297-305。
[14]Sangueza J M,Saenz M L。Challenge。Vestibular papilloma of vulva[J]。Am J Dermatopathol,2007,29(2):210,219-20。
[15]DiazGonzales J M,Martinez Luna E,Pena Romero A,et al。Vestibular papillomatosis as anormal vulvaranatomical condition[J]。Dermatol Online J,2013,19(10):20032-3。
[16]Khangembam B C,Sharma P,Singla S,et al。Malignant phyllodes tumor of the breast metastasizing to the vulva:(18)FFDG
PET-CTdemonstrating rare metastasis from a rare tumor[J]。Nucl Med Mol Imaging,2012,46(3):232-3。
[17]Heffernan T P,Sarode V R,Hoffman B,et al。Recurren tphyllodes tumor of the vulva:acasereport with review of diagnostic criteria and differential diagnosis[J]。Int J Gynecol Pathol,2010,29(3):294-7。
[18]FuL,LauS,RoyI,etal。Phyllodes tumor with malignant stromal morphology of the vulva:a case report and review of the literature[J]。Int J Gynecol Pathol,2011,30(2):198-202。
[19]Su A,Apple S K,Moatamed N A。Pleomorphic adenoma of the vulva,clinical reminder of arare occurrence[J]。Rare Tumors, 2012,4(1):e16-7。
[20]AlboresSaavedra J,Batich K,ChableMontero F,et al。Merkel cell carcinoma demographics,morphology,and survival based on 3870cases:apopulation based study[J]。J Cutan Pathol,2010,37(1):20-7。
[21]Che S M,Cao P L,Chen H W,et al。Primary Ewing’ssarcoma of vulva:a case report and a review of the literature[J]。J Obstet Gynaecol Res,2013,39(3):746-9。
[22]Ganesan R,McCluggageW G,Hirschowitz L,et al。Superficial myofibroblastoma of the lower female genital tract:report of aseries including tumours with a vulval location[J]。Histopathology,2005,46(2):137-43。
[23]Magro G,Salvatorelli L,Angelico G,et al。Lipomatous angiomyofibroblastoma of the vulva:diagnostic and histogenetic considerations[J]。Pathologica,2014,106(4):322-6。
[24]LuisP P,Quionez E,NogalesF F,et al。Lipomatous variant of angiomyofibroblastoma involving the vulva:report of 3 cases of an extremely rareneoplasm with discussion of the differential diagnosis[J]。Int J Gynecol Pathol,2015,34(2):204-7。
[25]Laartz B W,Cooper C,Degryse A,et al。Wolf in sheep’sclothing:advanced Kaposi sarcoma mimicking vulvar abscess[J]。 South MedJ,2005,98(4):475-7。
[26]Regauer S,NogalesF F。Vulvar trichogenic tumors:a comparative study with vulvar basal cell carcinoma[J]。Am J Surg Pathol,2005,29(4):479-84。
[27]Vega Memie M E,Luna E M,de Almeida O P,et al。Immunohistochemistry panel for differential diagnosis of basal cell carcinoma and trichoblastoma[J]。Int J Trichology,2014,6(2):40-4。
[28]Folpe A L,Goldblum J R,Weiss S W。Enzinger and Weiss’ssoft tissue tumors[M]。6th ed。StLouis:Mosby,2014:537-44。
[29]Golda N J,Wheeland R G。Vulvar squamous cell carcinoma treated using the Mohs technique:case and assessment of treatment strategies[J]。DermatolSurg,2009,35(8):1294-7。
临床与实验病理学杂志 JClinExpPathol 2016Mar;32(3)
作者:方三高,薛德彬,肖华亮,石群立,周晓军
来源:临床与实验病理学杂志
本站欢迎原创文章投稿,来稿一经采用稿酬从优,投稿邮箱tougao@ipathology.com.cn
相关阅读
 数据加载中
数据加载中
我要评论

热点导读
-

淋巴瘤诊断中CD30检测那些事(五)
强子 华夏病理2022-06-02 -

【以例学病】肺结节状淋巴组织增生
华夏病理 华夏病理2022-05-31 -

这不是演习-一例穿刺活检的艰难诊断路
强子 华夏病理2022-05-26 -

黏液性血性胸水一例技术处理及诊断经验分享
华夏病理 华夏病理2022-05-25 -

中老年女性,怎么突发喘气困难?低度恶性纤维/肌纤维母细胞性肉瘤一例
华夏病理 华夏病理2022-05-07







共0条评论