译者:郭晓红 广东省珠海市人民医院病理科;校对:薛德彬
摘要
结膜黑色素瘤非常罕见,从而阻碍了该类肿瘤患者治疗方面的发展,但是近年来却发生了很大进展。目前,原发性获得性黑变病组织学上分为色素沉着症和结膜黑色素细胞上皮内瘤变,并已建立一套客观的可重复性评分系统。结膜疾病分布和临床分期已有所改进。辅助性放疗和局部化疗已较成功地使该肿瘤得以控制,并降低其发病率。遗传学分析已经确定了BRAF及其他基因突变,这可预测新化疗药物的治疗反应,如可抑制转移性疾病进展的威罗菲尼(Vemurafenib)。多中心研究正在通过将疾病临床分期与恶性肿瘤组织学分级和基因异常进行整合,以提高生存预测。这些改进的预测方法不仅与个体患者息息相关,也为基础科学研究提供更多的机遇。
前言
结膜黑色素瘤(CoM)大约占眼部恶性肿瘤的2%,占眼部黑色素瘤的5%[1,2]。CoM居结膜恶性肿瘤的第二位,仅次于鳞状细胞癌[3]。除了其罕见性外,还有几个阻碍性因素使我们对CoM的理解复杂化。例如,结膜黑色素细胞病变这个术语就很令人困惑[1]。目前,CoM的最佳治疗方法尚无共识,这是由于现有证据是基于少数病例报告和有限的病例系列研究[1,4]。此外,临床、组织学与遗传学特征之间缺乏足够的相关性,这也使我们对这些肿瘤生物学的理解受局限[5]。
我们已经建立了结膜肿瘤的分布图(mapping)[6](图1)。这已获得授权审核,提示眼部内侧肿瘤,尤其是累及泪阜的病变,预后相对较差[5]。我们还设计了一套结膜黑色素细胞上皮内瘤变(C-MIN)的组织学评分体系,这在我们机构已经取代原发性获得性黑变病(PAM)伴有不同程度非典型性(主观评价)的术语[4]。我们的数据促使美国癌症联合委员会(AJCC)编制的第七版肿瘤-淋巴结-转移(TNM)分期系统的发展[7,8]。多中心研究必须将临床表现与组织学和遗传学数据进行整合,以提高预测。
本文的目的是回顾性分析CoM和C-MIN的分级、分期以及治疗处理。
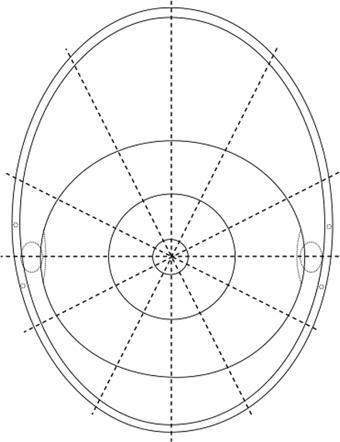
图1.结膜肿瘤分布示意图。结膜呈一平面,分为四个象限,结膜的中央部为角膜中心,向外周依次为角膜缘、球结膜、穹窿部、睑结合膜、睑缘和皮肤。经Bertil Damato允许引用[6]。
结膜黑素细胞疾病的分类
根据临床特征,结膜黑素细胞疾病可分为先天性和获得性两类病变[8](表1和图2)。
表1.结膜黑色素细胞疾病的临床分类

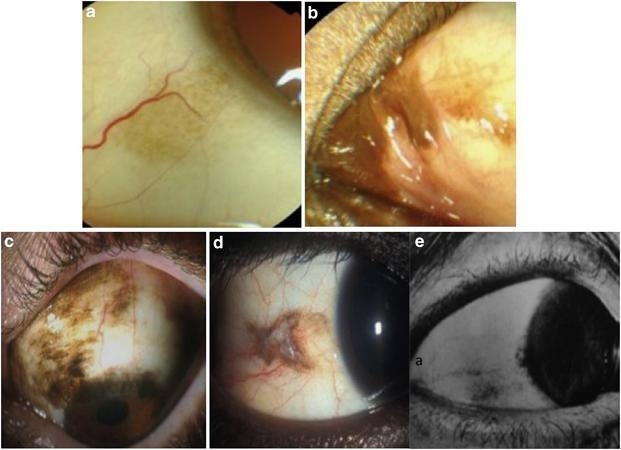
图2.结膜黑变病的临床表现。a.雀斑,b.皮肤黑变病,c.黑色素细胞上皮内瘤变(C-MIN),d.侵袭性黑色素瘤,e.色素性鳞状细胞癌
组织学上,结膜黑变病根据涉及的病理过程可分为两组:结膜黑色素沉着症和黑色素细胞肿瘤(表2和图3)。
表 2. 结膜黑色素细胞疾病的组织学分类
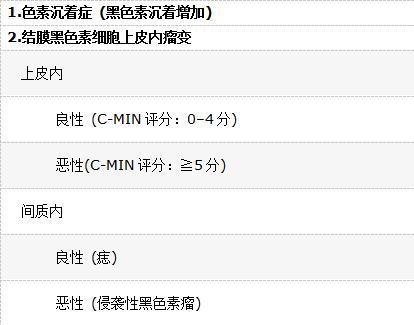
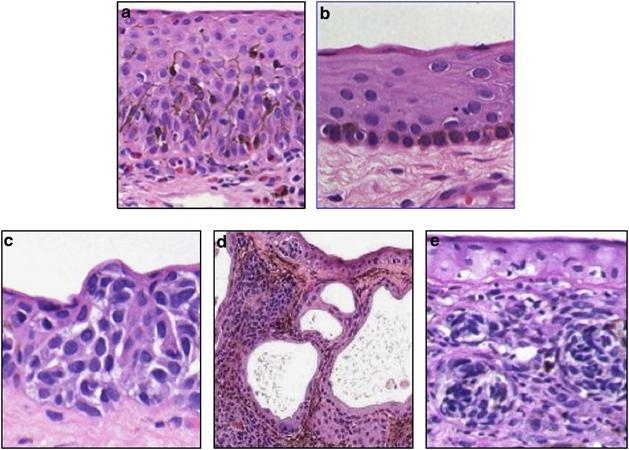
图3.结膜黑变病的组织学显微图像(HE):a.雀斑/皮肤黑变病;b. C-MIN:评分=1;c.C-MIN:评分≧5;d.痣;e.黑色素瘤
原发性获得性黑变病(PAM)和结膜黑素细胞上皮内瘤变(C-MIN)
流行病学
据报道,结膜黑色素细胞病变的发生率在白种人中高达36%,而非白种人则为4%,但这些数据尚存争议[9]。
临床特征
“PAM”这个术语准确地描述了该病的临床表现:褐色结膜色素沉着,出生后发病,与任何潜在的眼部或系统性疾病均无关。
PAM中位发病年龄为56岁,表现为单侧、单灶或多灶性结膜黑变病,呈褐色、扁平及不规则状。一些报道指出,女性患者发病率较高[10]。色素沉着随着在水平面上增加和减少而表现为凹凸不平[9]。并非所有结膜黑色素细胞病变都有色素沉着,且也可累及角膜[1,11 -13]。
组织形态学表现
术语“PAM”错误地将两种病理过程归为同一术语:(1)“色素沉着症”,即结膜黑色素细胞或上皮细胞胞质内黑色素聚集增加;(2)结膜黑色素细胞增生活跃。不同的是,术语“结膜黑色素细胞上皮内瘤变”仅仅指的是后一种病变,即黑色素细胞增生所导致的PAM。这是一个组织学诊断。 C-MIN的评分是基于水平位置的上皮受累方式、上皮内黑色素细胞浸润的垂直深度和细胞异型性程度,后者根据细胞核和细胞直径以及核仁和核分裂像的存在而进行分级。最高分为10分;因此,评分为0的C-MIN仅仅相当于“黑变病”;评分为1的C-MIN相当于“PAM伴轻度非典型性”;评分为2-3的C-MIN相当于“PAM伴中度非典型性”;评分为4的C-MIN相当于“PAM伴重度非典型性”;评分≧5的C-MIN相当于“原位CoM”(图4)。

图4.C-MIN评分系统。最高分为10分。经作者Damato和Coupland[4]授权允许引用。
鉴别诊断
C-MIN的鉴别诊断包括各种原因引起的色素沉着症(即雀斑及皮肤黑变病)、继发性黑变病(如,Addison病和色素性鳞状细胞癌)以及结膜下色素沉着症(即先天性眼黑色素细胞增多症)[11]。 “先天性眼部黑色素细胞增多症”表现为巩膜上的蓝灰色色素沉着,位于透明的结膜下方,其可随棉签移动而识别。部分类型的黑变病需要活检进行诊断和C-MIN评分(图5)。
图 5.a.上睑部C-MIN,b.球部和穹窿部结膜C-MIN,c.皮肤黑变病
治疗
C-MIN/ PAM治疗的目的是预防侵袭性黑色素瘤的发生。关于其最佳的处理方式尚未达成共识。有人提倡小的病变进行定期观察[9]。治疗方法包括:切除并辅助性冷冻疗法,用或不用羊膜移植物[ 9,14,15];丝裂霉素C、5-氟尿嘧啶和干扰素α-2-β局部化疗[10,16-18]。目前倾向于局部化疗[17,19]。
在利物浦,我们的方法是进行定位活检,然后采用0.04%的丝裂霉素C进行局部化疗,4次/天,7天/疗程,每隔3周进行一疗程,共4个疗程。在无反应区域采用液氮喷雾法进行冷冻治疗。当丝裂霉素C治疗失败时,我们偶尔高C-MIN评分的患者进行辅助性近距离放射治疗。随后患者每4-6个月进行一次治疗,持续5年,然后每年不定期的进行治疗。遵照上述方法,当出现新的色素沉着时再进行定位活检[5]。
临床病程及预后
据报道,不伴细胞非典型性的结膜黑色素细胞病变,手术切除后病变复发非常罕见,然而,PAM伴非典型性(即Folberg[20]描述的轻度、中度、重度非典型性特征),单纯手术切除后病变复发率约为60%,其中约一半病例复发为侵袭性黑色素瘤。PAM伴非典型性治疗失败后,平均复发时间为2.5年[20]。
结膜黑色素瘤
流行病学
CoM在白种人中的发病率约为0.2-0.8/百万人/年,而非白种人中仅有极少病例报道[1,3,21]。一些研究显显示示男、女发病率相等[2,3],但也有报道显示男性患者发病率较高[2,21]。
临床表现
高达70%的侵袭性黑色素瘤起源于C-MIN,25%起源于痣,或极少数是经de novo途径即原发性恶性黑色素瘤[1,2,9,11,22-25 ]。CoM为单侧发病,通常发生于成年人,中位发病年龄为60岁,仅极少数发生于儿童期[26]。这些肿瘤通常好发于角膜缘周围、睑裂、球结膜、半月皱襞和泪阜。侵袭性黑素瘤大多数为孤立性病变,但极少数多灶性病例也有报道[11]。可表现为伴色素沉着或无色素沉着,边缘不连续或弥漫性或呈混合性,50%的病例伴有 C-MIN[8]。
邻近角膜缘的肿瘤还可累及角膜,但鲍曼氏膜可作为屏障防止深层浸润[1]。手术切除期间接种组织或通过污染的器械获取黏膜移植物过程中,肿瘤可自然地在邻近部位包括眼睑或皮肤中发生局部肿瘤播种[4,27]。罕见情况下,肿瘤可扩散至眼球,尤其治疗不彻底之后。病变还可侵犯眼眶、鼻泪管和鼻窦[2,4,25]。
组织病理学特征
CoM表现为非典型性黑色素细胞从表面覆盖的结膜上皮浸润性生长,并穿透基底膜,进入到上皮下结缔组织(固有层)[11]。对肿瘤浸润的四周和深部边缘进行组织病理学评估是有必要的。为了对肿瘤浸润深度做出最佳判断,应垂直于上皮表面制作组织切片(图6)。这需要外科医生将标本放置到纸板上,并在操作过程避免损伤组织[4]。
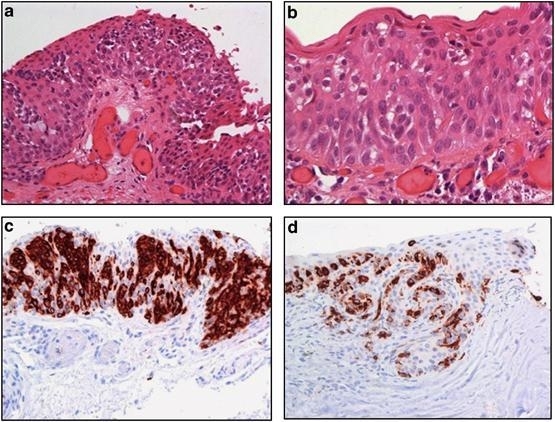
图 6.侵袭性C-MIN的组织学显微图像。图a和b出现上皮样细胞,部分呈巢状分布,肿瘤细胞侵犯角膜基质(HE)。图c和d,免疫组化染色示肿瘤细胞呈melan-A阳性。经Sarah E Coupland允许引用。
鉴别诊断
鉴别诊断包括:(1)结膜痣:通常发生于青年或儿童,最常见于球结膜和泪阜,常常含有透明的囊肿[11];(2)鳞状细胞癌和结膜鳞状上皮内瘤变变:通常是无色素的,但可以获得色素沉着而类似于CoM[11];(3)罕见病变,如葡萄肿、结膜下血肿、异物和血性囊肿[1];(4)葡萄膜黑色素瘤和黑色素细胞肿瘤的眼球部扩展,这可能需要行高频率超声检测来区分[28];(5)转移性皮肤黑色素瘤[29]。我们倾向于病变切除活组织检查而非切取活检,后者是非常危险的,因为若肿瘤是黑色素瘤则可能引起肿瘤种植性生长。
临床处理
由于冷冻治疗、放射治疗以及化疗技术的发展,CoM患者已很少进行眼球切除术[5]。
手术方法先前已有阐述[5](图7)。首先,采用双极高频电凝器在结膜上标注结膜切口标记线,同时也可防止出血。如果肿瘤扩展到角膜缘,则采用酒精和巴德-帕克刀清除受累的角膜上皮。采用钝头弹簧剪将肿瘤切除,并使用非接触技术及精细的止血术切除最小的安全缘。采用双极高频电凝器将巩膜的附着物剥离,并保持巩膜表面完好无损。肿瘤的角膜部分则通过巴德-帕克刀进行仔细解剖,并清除受累的角膜上皮。在完成切除之前,将标本放置到纸架上,并通过组织窄桥进行稳固,这也可防止组织卷曲。使用新的器械,将结膜破坏,并用可吸收缝合线将其不连续的封闭。一旦结膜伤口愈合,立即采用100 Gy剂量、15mm的钌离子斑放置到深约1mm处进行辅助性近距离放射治疗。如果病变呈单侧、弥漫性、上皮内播散或本质为C-MIN,则采用丝裂霉素C进行辅助性局部化疗。我们不做板层巩膜切除术,其可导致难看的瘢痕,也可增加该区域的黑色素瘤复发,并可能引起眼内浸润。仅有极少数病例有必要行羊膜移植。由于常规切片可能会漏掉肿瘤浸润最深的部分,因此即使组织学显示手术完全切除,也应进行近距离放射治疗。如果肿瘤累及结膜穹窿或泪阜区,我们则采用质子束放射治疗[5](图8)。

图 7.结膜肿瘤的手术切除方法。经作者 Damato和 Coupland允许引用[4]。
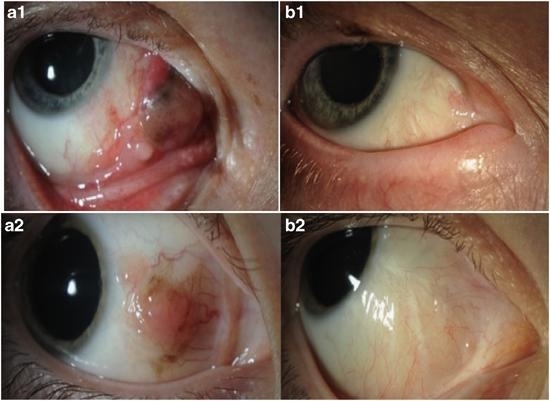
图 8.CoMs放射治疗举例。a1,右侧CoM:病变累及鼻侧球结膜、泪阜和穹窿部;b1,手术切除、质子束放射治疗及局部化疗后肿瘤完全消退;a2,右侧鼻侧球结膜CoM;b2,同一患者,钌近距离放射治疗和局部丝裂霉素C化疗后。
在疾病扩散期,当眼睛不能保留,则须进行眶内容物摘除术,可或无辅助性放射治疗[27]。 Paridaens等[30]表明,这仅仅是姑息疗法,对生存无任何影响。
采用前哨淋巴结活检(SLNB)对疾病进行分期,并识别淋巴结微转移的患者,这尚存争议[31-33]。厚度在2mm及以上的眼附属肿瘤行前哨淋巴结活检可获益,但当伴有溃疡时,稍小的肿瘤也可有帮助[33]。然而,关于前哨淋巴结活检的时机和适应症尚无共识,且该技术需要特殊的专业技能[34]。值得注意的是,在高达50%的全身转移患者中,全身转移之前可显示局部淋巴结受累[35];反之,26%的局部转移患者从未进展为全身转移[36]。
部分诊疗中心已常规进行高危患者的全身性筛查,通常包括全面体检、胸片、肝脏超声扫描、肝功能检查,每6个月一次,持续10年。虽然正电子发射体层扫描显像技术(PET)的功能尚不明确[32],但已有报道显示,全身PET / CT在检测全身转移方面优于常规放射成像技术,尤其是骨受累,但由于其费用昂贵、假阴性结果以及非特异性,使其应用大大受限[37]。
预后
肿瘤位于穹隆部结膜、泪阜、半月皱襞或睑缘的患者预后较差[5,27]。这些部位的病例50%以上可发生局部肿瘤复发[23,38,39]。据报道,复发的危险因素包括:多灶性病变、非角膜缘部位的肿瘤、手术切缘受累以及手术切除后无辅助性治疗[27,40]。我们病例中,首次在本医疗中心治疗的患者复发率仅为1.5%,中位复发时间为2.2年,而首次在其他单位手术治疗的患者复发率为1.9%,中位复发时间为1.6年,复发时间为0-6.98年。这很可能是因为不管患者是否组织学上切除干净,我们都会常规进行辅助性放射治疗[5]。患者的平均复发时间估计为2.5 年[27]。由于无法控制病情复发,高达20%的患者最终需要行眼球摘除术[27,38]。我们76例患者的系列研究中,随访时间长达13年,仅有1例必须行眼球摘除术。这例患者最初是在其他单位就诊治疗,之后到我们诊疗中心,开始行辅助性放射治疗[5]。
20-30%的患者可发生远处转移[8,27,39,41]。临床危险因素包括:疾病复发,非球部结膜、内侧球结膜、泪阜和半月皱襞受累,以及肿瘤厚度大于2mm[23,27,30,35,39,42]。临床上,CoMs根据美国癌症联合委员会(AJCC)和国际抗癌联盟(UICC)编制的第7版TNM分期系统进行分期[7]。预后不良的组织病理学特征包括:高核分裂像计数、上皮样细胞、上皮内弥漫性播散、血管外基质的结构模式、淋巴管侵犯/微血管密度、淋巴细胞/巨噬细胞浸润以及表面溃疡[4,27,43]。局部肿瘤复发与远处转移相关性具有强有力的间接证据[8,27,39,41]。45-60%的病例首次转移的部位是局部淋巴结,其发生的中位时间为2.3年[44]。全身转移最常累及肺、脑、肝、皮肤、骨骼和胃肠道,通常检测到的中位时间为3.4 年[40 ]。Com的5年死亡率估计为12-19%,而10年死亡率约为30%[1,23,25,27,42]。
CoM遗传学异常
CoMs显示有BRAF(7q34)基因的突变[45,46,49-52,55]。BRAF基因编码丝裂原活化蛋白激酶(MAPK)通路中的一种丝/苏氨酸激酶,其与信号转导有关[52]。通过采用多重连接依赖式探针扩增技术(MLPA)我们已经证实,在50%的原发和转移性CoM中存在BRAF V600E突变[45]。目前,我们对所有CoMs均常规检测BRAF V600E突变,这可预测可能发生转移的患者对威罗菲尼(Vemurafenib)的治疗反应[56]。我们还证实,原发性CoM显示有CDKN1A和RUNX2(两者均位于6p21.2)基因扩增;转移性CoM常常有MLH1(3p22.1)和TIMP2(17q25.3)基因扩增,MGMT(20q26.3)和ECHS1(10q26.3)通常显示基因缺失[45]。CoMs还已确定了许多其他遗传学改变,表3总结了一些重要发现。这些遗传学异常的意义仍有待确定。
结论
该综述对近些年来CoM分类、诊断、治疗和预后等方面的进展进行了回顾。越来越多的医疗中心逐渐用C-MIN来取代模糊的术语“PAM”,因为前者更为精确,其将非典型黑色素细胞增生与色素沉着症区分开来。目前,C-MIN中细胞异型性的程度和上皮受累的范围进行客观的评分,而不是模糊的描述为“轻度、中度和重度”。结膜疾病的分类已有所改进。 TNM分期也进行了强化,第7版中包括原位黑色素瘤,而且与生存率相关性更强。所有患者肿瘤切除后均给予辅助性放射治疗,使得肿瘤局部控制也已有改善。局部采用丝裂霉素C化疗,虽然不是万能的,也证实显著优于冷冻疗法。目前,仅有极少数患者需要进行眼球摘除术。遗传学分析现已可确定哪种患者将发生远处转移,并可从化疗试剂如威罗菲尼(Vemurafenib)中获益。
多中心研究正在将TNM分期与组织学和基因预测因子进行整合,以提高预测,并在葡萄膜黑色素瘤已经完成。除了使预测更切合个别患者,此类研究将增进对CoM分子驱动的理解,并进一步为延长CoM患者生命而提供新方法。
文献来源:N Kenawy, SL Lake, SE Coupland, et al. N Kenawy, SL Lake, SE Coupland, et al. Conjunctival melanoma and melanocytic intraepithelial neoplasia. Eye (2013) 27, 142–152
英文版文献下载






















共0条评论